基于二代测序的碳青霉烯耐药高毒力肺炎克雷伯菌的分子特征分析*
陈典典,曹敬荣,白向荣,杨文硕,王培昌△
首都医科大学宣武医院:1.检验科;2.药学部,北京 100053
肺炎克雷伯菌(KP)是社区获得性感染和院内感染最常见的致病菌之一,临床上根据其致病性的强弱分为经典型肺炎克雷伯菌(cKP)和高毒力肺炎克雷伯菌(hvKP)[1]。随着碳青霉烯类抗菌药物的广泛应用,hvKP菌株的耐药性也逐渐增加,且已有产超广谱β-内酰胺酶(ESBLs)hvKP的报道[2],而随着耐碳青霉烯酶肺炎克雷伯菌(CRKP)在临床上的大量出现,碳青霉烯耐药高毒力肺炎克雷伯菌(CR-hvKP)分离株的报道越来越多[3]。CR-hvKP菌株不仅具有CRKP菌株的高耐药性和传播性,还具有hvKP菌株的高致病性,使得临床治疗非常棘手。既往研究发现,CRKP主要集中于CC258克隆复合群的ST11型和ST258型[4],hvKP主要集中于CC258克隆复合群中的ST23、ST65及ST86型[5]。而二代测序为全面了解细菌耐药、毒力基因分布、分子型别等的可靠方法,因此,为进一步明确本院分离的CR-hvKP菌株,尤其CC258流行株的基因分布与分子特征,本研究收集本院分离的17株CR-hvKP,进行了二代测序,现将结果报道如下。
1 材料与方法
1.1菌株来源 收集本院检验科2016—2020年临床分离的17株CR-hvKP为研究对象。入选标准:改良碳青霉烯类灭活试验(mCIM)与EDTA-碳青霉烯类灭活试验(eCIM)阳性,毒力表型试验阳性,且同时存在耐药基因KPC-2及毒力基因rmpA或Areo的CRKP菌株。排除标准:mCIM试验、eCIM试验和毒力表型试验阴性,PCR方法检测不到耐药或毒力基因。
1.2菌株筛选方法 通过Whonet5.6软件筛选研究菌株,菌株的分离培养步骤按照《全国临床检验操作规程(第4版)》进行操作,使用基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)仪(德国布鲁克公司)进行细菌鉴定,采用Vitek 2 Compact细菌药物敏感分析系统进行药敏试验,药敏试验结果判断参照美国临床和实验室标准协会(CLSI)相关标准执行。本研究符合《赫尔辛基宣言》的原则和本院临床研究相关规定,研究方案通过本院医学伦理委员会批准(批件号:临研审2020052号)。
1.3二代测序方法 参考文献[6],首先将留存菌株接种于血平板(英国Oxoid公司)进行复苏,35 ℃过夜培养后挑取单菌落进行液体培养。使用DNA试剂盒(美国Qiagen公司)提取细菌总DNA。采用Hisep 2500型Illumina高通量测序仪(美国Illumina公司)进行二代测序。使用SOAP、Spades、Abyss软件对测序结果进行数据拼接组装,采用CISA软件进行整合,对结果进行最终优化处理,得到的基因组序列用于后期分析。
1.4耐药、毒力基因和荚膜血清型的分子生物信息学分析 基因组序列首先使用GeneMarkS软件进行细菌的编码基因预测。使用综合抗菌药物耐药基因数据库(ARDB)进行耐药基因分析。通过RGI软件与ARDB数据库中已知耐药基因进行比对,得到耐药性相关基因的名称及耐受的抗菌药物种类等信息。使用毒力因子数据库(VFDB)分析毒力基因、功能和致病机制。通过Diamond软件与VFDB数据库已知毒力基因进行比对,得到毒力基因的名称、基本特征描述、毒力基因功能和致病机制信息;将得到的基因组数据提交到NCBI数据库,与已知的荚膜血清型(K1-K82、KL103-KL125、KN1和KN2)序列进行比对[7],得到检测菌株的血清型数据。耐药和毒力基因选择鉴定率≥90%基因进行分析统计。
1.5多位点序列分型(MLST)和分子克隆(CC) 将组装后的基因组数据提交NCBI数据库,利用7个管家基因(rpoB、gapA、mdh、pgi、phoE、infB和tonB)序列结果进行在线比对(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html),将比对的等位基因编码组合与MLST库中已经提交的KP等位基因编码组合进行对比,获得MLST分型。将本研究获得的等位基因序列与eBURST网站(http://eburst.mlst.net)中的数据库进行比对可得到CC鉴定结果(7个等位基因有6个相同定义为同一克隆系)。
1.6统计学处理 采用Whonet5.6软件和SPSS 23.0统计学软件进行数据分析,计数资料以例数或百分率表示,组间比较采用Fisher确切概率法。以P<0.05有统计学意义。
2 结 果
2.1菌株标本来源及耐药情况 非重复的17株CR-hvKP中,16株(94.1%)分离自痰液标本,1株(5.9%)分离自尿液标本,复苏后均经MALDI-TOF MS二次鉴定。17株CR-hvKP均为多重耐药菌株,对β-内酰胺类(第一、二、三代头孢菌素,碳青霉烯类,复合酶抑制剂类)、喹诺酮类(环丙沙星和左氧氟沙星)、头霉素类(头孢西丁)抗菌药物均表现为100.0%耐药,对复方磺胺甲噁唑耐药率最低,为23.5%;对阿米卡星和庆大霉素耐药率为76.5%,未发现对替加环素和多黏菌素耐药的菌株。
2.2CR-hvKP的分子分型和克隆型别 17株CR-hvKP菌株中10株为国际流行的CC258型克隆复合群ST11型,7株为国际上未分型的MLST新序列型别(新ST型),CR-hvKP的MLST分型结果和克隆型别见表1。新ST型与ST11型的phoE等位基因不同,由phoE的1号等位基因点突变为419号等位基因,见图1。

表1 CR-hvKP的MLST分型结果和克隆型别
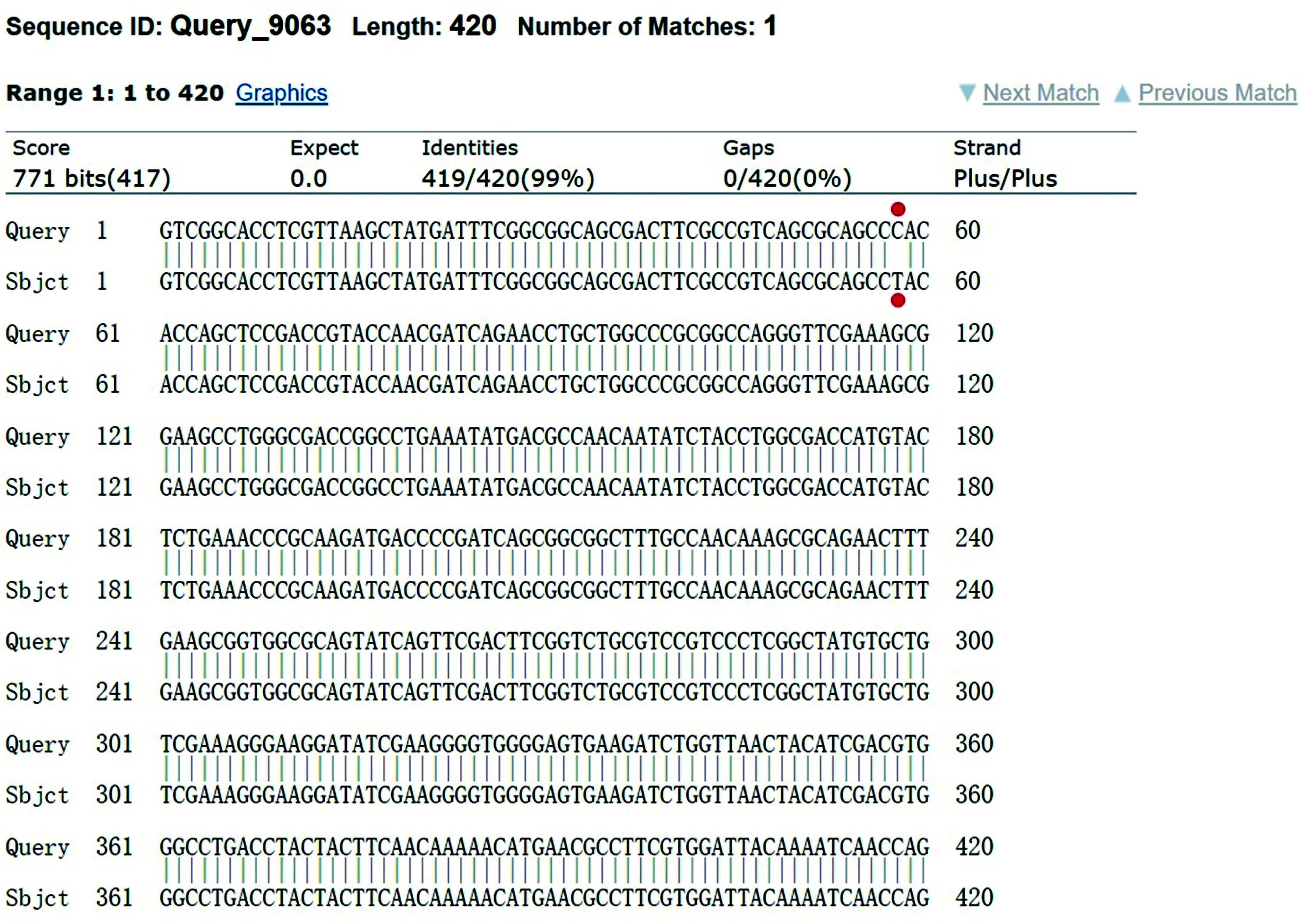
注:ST11型第58个碱基为C,新ST型变为T。
2.3CR-hvKP的耐药基因分析 对基因组测序结果进行耐药基因分析,共检出29种耐药基因,涉及8类抗菌药物耐药表型,见图2。17株CR-hvKP各自携带18~25个耐药基因,见图2。新ST型与ST11型相比所携带的耐药基因存在较多差异:7株新ST型菌株均携带两种及以上blaCTX-M基因,而ST11型仅1株(10%,1/10)携带两种blaCTX-M基因(blaCTX-M-65和blaCTX-M-27);新ST型中blaTEM-1基因占14%(1/7),ST11型为70%(7/10);blaTEM-2基因仅存在于新ST型菌株,而blaOXA-1基因仅在ST11型中出现,见图2。CR-hvKP基因组中存在多种耐药基因,包括5种氨基糖苷类的基因(aph6id、aac6ib、ant2ia、acrb、acra),3种甲氧嘧啶耐药基因(dfra14、dfra12、dfra1),2种大环内酯类的耐药基因(mpha、macb),2种磷霉素耐药基因(mdth、mdtg),2种四环素耐药基因(tetc、teta),磺胺类耐药基因(sul1)、喹诺酮类耐药基因(mdtk)和氯霉素类耐药基因(catb3)各1种。ST11型菌株携带的耐药基因较新ST型菌株更加复杂多元化。见图2。
2.4CR-hvKP毒力基因分析 17株CR-hvKP 菌株共检测到两种荚膜血清型,包括14株(82.4%,14/17)KL64和3株KL47(17.6%,3/17)。10株ST11型菌中有7株(70.0%,7/10)为KL64,3株(30%,3/10)为KL47,7株新ST型菌株均为KL64型(100.0%,7/7)。CR-hvKP菌株毒力基因数据分析共获得60多种相关毒力基因,包括铁载体编码基因气杆菌素(iutA、iucA、iucB、iucC、iucD等)、耶尔森菌素(ybtA、ybtD、ybtE、ybtP、ybtQ、ybtS、ybtT、ybtU、irp1、irp2等)、沙门菌素(iroN)、肠杆菌素(ydbA、SenB/TieB、fepC),荚膜多糖编码基因Capsule(galF、wza等)、脂多糖编码基因LPS(wbb0和wzm)、高黏液表型调节因子(rmpA、rmpA2)、菌毛相关编码基因(mrkA、fimH等)、转录调控因子(RcsAB、fur),以及Ⅳ型分泌系统相关编码基因等。有12株CR-hvKP菌株同时检测出iucA、rmpA、rmpA2和iroN基因。见图3。
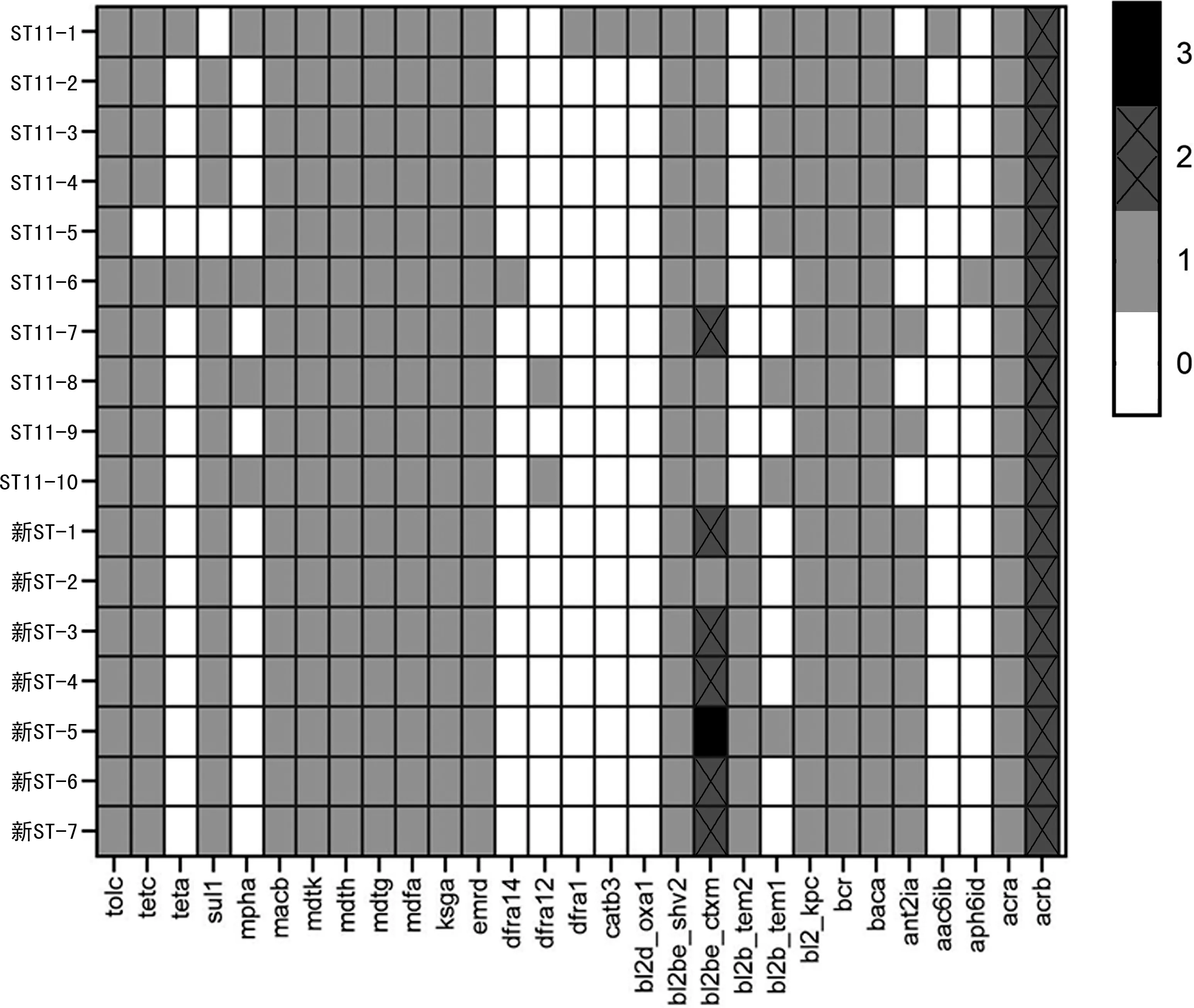
注:0为未携带该基因;1为携带1种亚型基因;2为携带2种亚型基因;3为携带3种亚型基因。
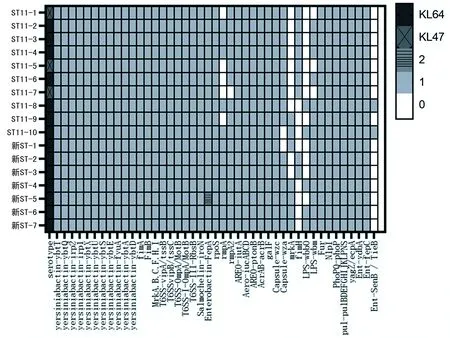
注:0为未携带该基因;1为携带1种亚型基因;2为携带2种亚型基因。
2.5耐药与毒力基因差异分析 ST11型流行株与新ST型菌株中,耐药基因blaCTX-M-27、blaTEM-1、blaTEM-2、ant2ia、sul1和毒力基因rmpA分布比较,差异均有统计学意义(P<0.05)。见表2。
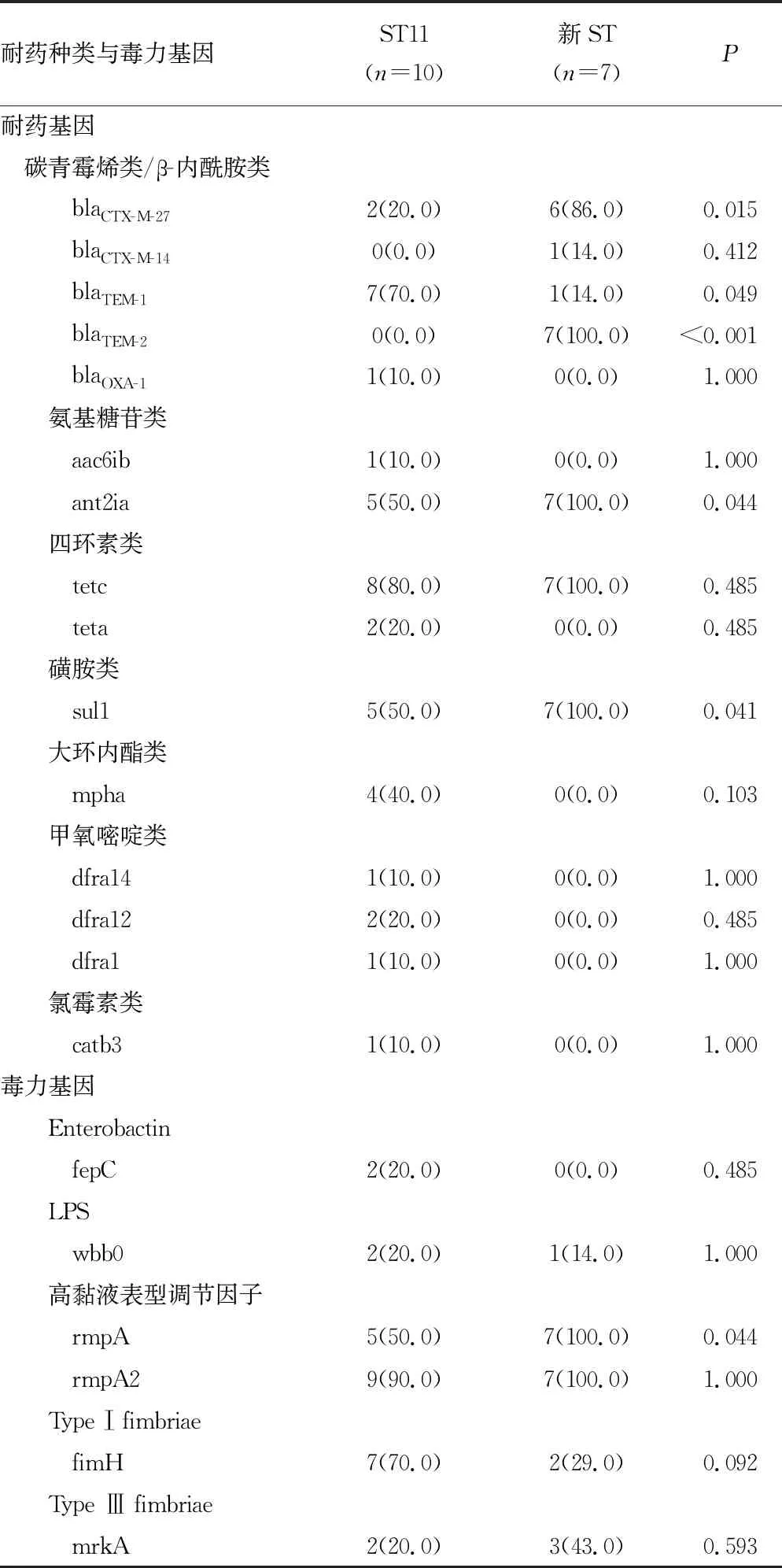
表2 CR-hvKP分离株不同ST型菌株的主要差异耐药基因和毒力基因分布[n(%)]
3 讨 论
既往临床认为hvKP除对氨苄西林天然耐药外,对临床常用抗菌药物保持高敏感性,随着CRKP的分离率日益增加,目前已有hvKP耐药性增加的报道[8-10],尤其CR-hvKP的报道逐渐增多,使得临床上最为广泛使用的碳青霉烯类药物无法有效控制KP感染,临床治疗难度增加,甚至引起了医院内感染暴发流行[11]。本研究通过对临床分离自痰液和尿液标本的17株CR-hvKP菌株的基因序列进行分析,描绘了其携带的耐药基因、毒力基因、分子型别等相关分子生物信息学的分布情况,以期为临床制订治疗策略提供相应的理论依据。
CR-hvKP二代测序结果显示,17株菌株均为国际流行的CC258克隆复合群,其中ST11型为主要流行株,与全国细菌耐药检测网(CHINET)报道结果一致[12]。17株CR-hvKP携带多种与抗菌药物耐药相关的基因,包括β-内酰胺类基因(blaTEM、blaCTX-M和blaSHV)和碳青霉烯酶基因(blaKPC和blaOXA)[13-14],其中编码丝氨酸酶KPC基因(blaKPC-2)存在于全部CR-hvKP菌株中,是本院KP最常见的耐碳青霉烯类抗菌药物的决定性基因[15]。临床应重视位于质粒上的blaKPC-2、blaCTX-M和blaTEM基因[16],以防止这些基因在细菌间水平转移产生更多耐药菌,甚至引起医院内感染的暴发流行。β-内酰胺类耐药基因方面,所有CR-hvKP均检测出blaCTX-M基因,ST11型菌株主要为blaTEM-1基因,但新ST型菌株携带了更多的blaCTX-M亚型(两种以上),如blaTEM-2[17],TEM-2含有赖氨酸,识别水解抗菌药物的能力强于TEM-1,ST11型流行株与新ST型菌株耐药基因blaTEM-1、blaTEM-2检测结果有明显差异;blaCTX-M-65是ST11型和新ST型菌株中检测出最多的β-内酰胺类亚型,但新ST型中存在更多的blaCTX亚型,可能与其存在更复杂的耐药机制及存在耐药进化有关,表明新ST型菌株在耐药方面情况更复杂,更严峻。另外,本研究的CR-hvKP基因组中还检测到了除上述基因外的其他类型的耐药基因,这些基因有可能导致产生耐药谱更为广泛的超级耐药菌,对我国乃至国际公共卫生安全产生巨大威胁[18]。值得注意的是,新ST型与ST11型菌株相比,虽然体外药敏实验结果显示ST11型对阿米卡星多为敏感,但是实际上新ST型基因组中氨基糖苷类耐药基因ant2ia携带率明显高于ST11型,造成体外药敏实验与耐药基因携带情况相悖的原因仍需要进一步研究。由于体外实验无法完全代表体内情况,此类药物具体临床疗效仍需进一步确认。新ST型磺胺类药物耐药基因sul1的携带率高于ST11型,但体外药敏实验结果表现为新ST型与ST11型无明显差异,所以复方磺胺类药物是否可用于治疗新ST型感染需进一步深入研究。体外药敏实验未发现对替加环素和多黏菌素耐药的CR-hvKP菌株,但检测到tet耐药基因,因此,临床治疗CR-hvKP感染时替加环素是否达到疗效,有待进一步观察研究。
毒力基因结果发现研究的菌株携带60多种毒力相关基因,包括荚膜多糖、与侵袭相关的基因、与黏附相关的基因、与荚膜形成相关的基因、与高毒力相关的rmpA/rmpA2基因、与宿主多部位散播感染和细胞内生长相关的铁载体编码基因、与生物膜相关的编码基因和与宿主不同部位免疫防御相关的编码基因。既往研究显示,hvKP菌株中最常见的荚膜血清型为K1、K2、K5、K20、K54和K57,其中K1和K2最多见,而CR-hvKP菌株的血清荚膜分型目前文献报道的有K1、K2、K20、KL64和KL47,中国的CR-hvKP菌株的荚膜血清分型以KL64型为主[19-20]。本研究中CR-hvKP菌株中14株(82.4%)为KL64,3株为KL47(17.6%),与以往研究结果一致[21]。无论是ST11型还是新ST型的CR-hvKP中都包含上述所有类别的毒力基因,毒力基因总体分布无差异。但不同菌株毒力基因的数目有所不同,说明CR-hvKP在毒力方面仍呈进化趋势。与ST11型相比,新ST型rmpA基因的携带率明显较高,可能与新ST型形成时的点突变相关。既往研究发现,hvKP菌株常携带pLVPK质粒或pLVPK-like质粒,并可通过检测iucA、rmpA、rmpA2和iroN基因初步判定是否携带两种质粒[22]。本研究结果还显示有12株菌均检测出4种相关毒力基因,推测本院的CR-hvKP菌株可能为产KPC-2酶的ST11型CRKP菌株获得相关毒力质粒进化而来,与国内报道一致[23]。毒力质粒相关研究及新ST型形成和进化机制将在未来试验中进一步阐述。
综上所述,本院CR-hvKP菌株全部是由CC258克隆系组成,主要为ST11型和新ST型流行株,ST11型仍是目前本院和国内临床最常见的类型。CR-hvKP菌基因组存在多种碳青霉烯类耐药基因及大量其他类型耐药基因,携带多种毒力基因和两种荚膜血清型(KL64和KL47),不同MLST分型菌株的部分耐药基因与毒力基因分布有差异。本研究为单中心回顾性观察研究,样本量较少,仅对研究菌株进行基因序列分析,未结合临床特点和治疗用药等。因此,在未来研究中急需选取有代表性的CR-hvKP菌株进行全基因组筛查,结合患者临床资料进行综合分析,进一步揭示新ST型形成及CR-hvKP进化的具体机制,帮助临床精准诊断,并为治疗患者提供针对性的方案。

