血清脂肪酸结合蛋白1、正五聚蛋白3水平与2型糖尿病合并非酒精性脂肪性肝病的关系*
王丽娟,关晓燕,余梦思,秦文沛,李 蕾
新疆医科大学第一附属医院:1.医学检验中心;2.内分泌科,新疆乌鲁木齐 830000
非酒精性脂肪性肝病(NAFLD)是全球范围内最常见的肝病类型,多由肥胖和胰岛素抵抗介导的三酰甘油(TG)和游离脂肪酸在肝脏中积累导致,NAFLD常与2型糖尿病(T2DM)共同存在,T2DM患者中NAFLD患病率高达59.67%[1]。合并NAFLD可增加T2DM患者血糖控制难度及其他慢性并发症的发生,同时T2DM也增加了非酒精性脂肪性肝炎、肝纤维化、肝细胞癌等其他肝脏相关疾病的发病率和病死率[2]。T2DM合并NAFLD的发生机制尚不清楚,但肝脏对脂肪调节机制异常、炎性反应与其发生关系密切[3-4]。脂肪酸结合蛋白1(FABP1)是一种主要表达于肝脏的14-KDA蛋白,参与细胞质中的脂肪酸代谢和转运,在急慢性肝细胞损伤中表达升高,血清FABP1有望成为检测肝损伤的生物学标志物[5]。正五聚蛋白3(PTX3)是近年来新发现的与超敏-C反应蛋白同源的炎症因子,主要来源于心脏和血管的损伤组织,参与血管炎性反应[6],现有研究显示PTX3在NAFLD血清中呈高表达,且与肝纤维化程度呈正相关[7]。目前,关于FABP1、PTX3在T2DM合并NAFLD患者中的价值报道十分少见,鉴于FABP1、PTX3在肝损伤相关疾病中的差异性表达,推测二者可能成为T2DM合并NAFLD诊断的潜在指标,为此本研究探讨了FABP1、PTX3与T2DM合并NAFLD的关系及其诊断价值。
1 资料与方法
1.1一般资料 选择2018年5月至2020年5月本院收治的132例T2DM患者为研究对象,纳入标准:(1)符合《中国2型糖尿病防治指南(2017年版)》诊断标准[8];(2)既往无肝病病史;(3)无酮症酸中毒、高渗高血糖状态等急性并发症。排除标准:(1)1型糖尿病或妊娠期糖尿病;(2)病毒性肝炎、药物性肝损伤、自身免疫性肝病等其他肝脏疾病;(3)合并急慢性感染、自身免疫性疾病、恶性肿瘤;(4)近期服用过抗感染、调脂药物、免疫抑制剂。132例T2DM患者中,79例合并NAFLD患者纳入NAFLD组,NAFLD诊断参考《非酒精性脂肪性肝病防治指南(2018年更新版)》[9],53例未合并NAFLD患者纳入无NAFLD组。另选择61例门诊体检健康志愿者纳入对照组。本研究获得本院医学伦理委员会批准,所有受试者均自愿参与,并签署同意书。
1.2方法
1.2.1检测指标 所有受试者均采集清晨空腹静脉血3~5 mL,待血液凝固后取上清液于4 ℃以3 000 r/min离心15 min(离心半径10 cm)保存于—70 ℃低温冰箱,48 h内完成检测。采用瑞士Hamilton FAME全自动酶联免疫分析仪(酶联免疫吸附试验)检测血清FABP1、PTX3水平,试剂盒购自北京北方生物技术研究所。罗氏 Modular全自动生化分析仪检测总胆固醇(TC)、TG、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、γ-谷氨酰转移酶(GGT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)水平。强生稳步倍加血糖仪检测空腹血糖(FPG),采用美国雅培I2000全自动化学发光免疫分析仪及配套试剂检测空腹胰岛素(FINS),采用稳态模型法计算胰岛素抵抗指数(HOMA-IR)=(FPG×FINS)/22.5。Bio-Rad D-10糖化血红蛋白分析仪检测糖化血红蛋白(HbA1c)水平。上述试验均由本院医学检验中心完成,试剂盒批内差异<5%,批间差异<10%,操作均遵循标准化规程,符合国际标准化组织(ISO)颁布的《医学实验室-质量和能力专用要求》。
1.2.2临床资料收集 收集受试者年龄、性别、体质量指数(BMI)、T2DM病程、基础疾病(高血压、高脂血症)、临床生化指标。

2 结 果
2.13组基线资料、糖脂代谢、胰岛素抵抗及肝酶水平比较 NAFLD组、无NAFLD组BMI、TC、TG、LDL-C、FPG、FINS、HOMA-IR、HbA1c高于对照组,HDL-C低于对照组,差异有统计学意义(P<0.05)。NAFLD组高脂血症比例、T2DM病程、BMI、TC、HOMA-IR、ALT、AST、GGT、ALP高于无NAFLD组,差异有统计学意义(P<0.05)。见表1。
表1 3组基线资料、糖脂代谢、胰岛素抵抗、肝酶水平比较[n/n或n(%)或或M(P25,P75)]
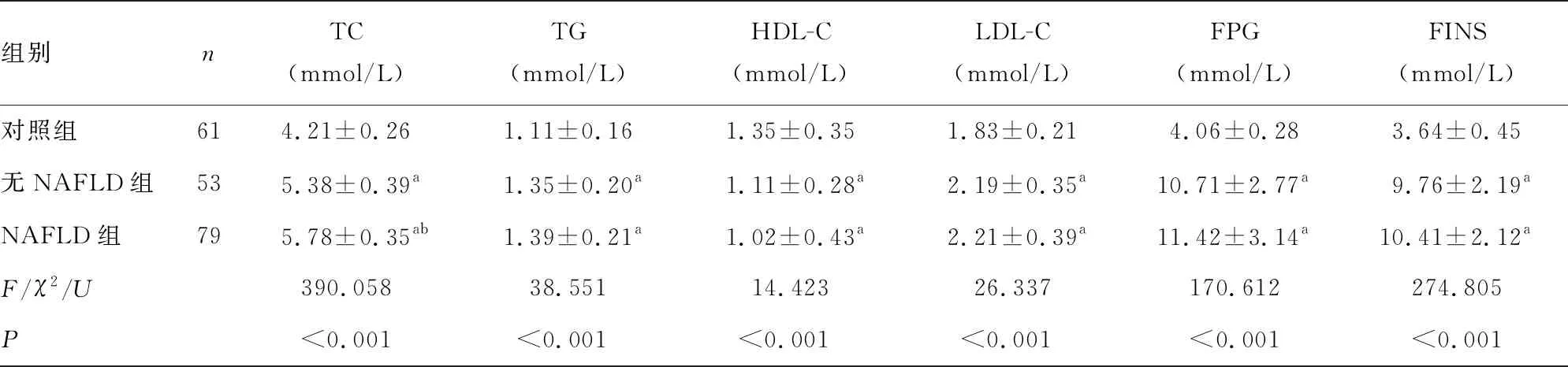
组别nTC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C (mmol/L)FPG(mmol/L)FINS(mmol/L)对照组614.21±0.261.11±0.161.35±0.351.83±0.214.06±0.283.64±0.45无NAFLD组535.38±0.39a1.35±0.20a1.11±0.28a2.19±0.35a10.71±2.77a9.76±2.19aNAFLD组795.78±0.35ab1.39±0.21a1.02±0.43a2.21±0.39a11.42±3.14a10.41±2.12aF/χ2/U390.05838.55114.42326.337170.612274.805P<0.001<0.001<0.001<0.001<0.001<0.001

组别nHOMA-IRHbA1c(%)ALT(U/L)AST(U/L)GGT(U/L)ALP(U/L)对照组610.66±0.114.04±0.7621.09±4.0221.01±4.6325.09±5.7870.58±5.53无NAFLD组534.69±1.09a7.95±1.55a21.97±4.1022.07±4.2726.61±6.4871.01±6.29NAFLD组795.32±1.15ab8.39±1.83a29.68±5.64ab26.94±5.07ab39.38±6.52ab73.88±5.33abF/χ2/U470.441165.38369.09531.611109.7997.018P<0.001<0.001<0.001<0.001<0.0010.001
2.23组血清FABP1、PTX3水平比较 NAFLD组血清FABP1、PTX3水平高于无NAFLD组和对照组,无NAFLD组血清FABP1、PTX3水平高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 3组血清FABP1、PTX3水平比较
2.3血清FABP1、PTX3水平与其他指标相关性 FABP1、PTX3水平与BMI、TC、HOMA-IR、ALT、AST均呈正相关(P<0.05),与其他指标不相关(P>0.05)。见表3。

表3 血清FABP1、PTX3水平与其他指标相关性
2.4T2DM合并NAFLD的危险因素分析 以T2DM是否合并NAFLD为因变量(赋值:0=否,1=是),以高脂血症(赋值:0=否,1=是)、T2DM病程、BMI、TC、HOMA-IR、ALT、AST、GGT、ALP、FABP1、PTX3为自变量纳入Logistic回归方程,连续性变量直接代入方程未进行赋值,采用逐步后退法排除无关变量进行回归分析,结果显示高脂血症、高BMI、HOMA-IR及高FABP1、PTX3水平是T2DM合并NAFLD的独立危险因素(P<0.05)。见表4。

表4 T2DM合并NAFLD的危险因素分析
2.5FABP1、PTX3单独及联合检测诊断T2DM合并NAFLD的价值 ROC曲线分析结果显示,血清FABP1、PTX3诊断T2DM合并NAFLD的曲线下面积(AUC,95%CI)分别为0.693(0.598~0.789)、0.700(0.607~0.793)。FABP1、PTX3联合检测诊断T2DM合并NAFLD的AUC(95%CI)为0.894(0.828~0.959),高于各项指标单独检测。见表5、图1。

表5 FABP1、PTX3单独及联合检测诊断T2DM合并NAFLD的效能分析

注:A为FABP1、PTX3单独检测的ROC曲线分析;B为FABP1、PTX3联合检测的ROC曲线分析。
3 讨 论
NAFLD指单纯性脂肪肝向非酒精性脂肪性肝炎、肝纤维化、肝硬化演变的过程,肥胖、T2DM、胰岛素抵抗、血脂异常等是NAFLD的危险因素,随着肥胖、T2DM人群不断增加,NAFLD的患病率正逐年升高[10]。肝脏在葡萄糖稳态调节中发挥核心作用,肝功能异常可能增加T2DM风险,加剧胰岛素抵抗,同时胰岛素抵抗可促进肝脏脂肪堆积,影响肝功能,促使肝硬化,增加肝硬化向肝细胞癌演变的风险[11],T2DM与NAFLD两病共存相互影响,可加剧病情进展,导致患者不良结局。因此,早期诊断NAFLD十分必要,目前缺乏诊断T2DM合并NAFLD的灵敏生物学指标,常规生化指标ALT、AST、GGT在正常水平并不能排除NAFLD,诊断NAFLD灵敏度较低[12],有必要探讨更灵敏的生物学指标。
FABP1是一种丰富的结合长链脂肪酸的细胞内蛋白,也称肝型脂肪酸结合蛋白,主要在肝脏表达,少量在肾脏近端小管细胞和小肠表达,FABP1通过促进脂肪酸及其酰基辅酶A衍生物的运输、储存和利用,调节肝脏脂肪酸吸收和转运[13],FABP1过表达通过抑制溶酶体功能(包括溶酶体蛋白分解和溶酶体酸化维持)降低自噬功能和自噬清除,促使肝脏脂肪变性[14]。本研究结果表明,NAFLD组血清FABP1水平明显高于无NAFLD组和对照组,FABP1水平与BMI、TC、HOMA-IR呈正相关,说明FABP1可能通过诱导T2DM患者高脂血症、肥胖和胰岛素抵抗参与NAFLD的发病过程。SCHROEDER等[15]报道,FABP1表达升高可导致肝脏脂质聚集,促使肝脏脂肪变性,导致肥胖、血脂异常、NAFLD。动物研究显示,沉默FABP1可抑制炎性反应和氧化应激,降低肝脏重量,抑制肝脏TG积聚[16]。PETRESCU等[17]指出高糖水平下,FABP1通过与过氧化物酶体增殖物激活受体α结合诱导肝PPARα 长链脂肪酸β-氧化基因表达,促使肝纤维化进程。本研究中回归分析显示,FABP1水平升高是T2DM合并NAFLD的独立危险因素之一,提示FABP1与T2DM患者NAFLD发病关系密切,FABP1可作为T2DM患者合并NAFLD的潜在生物学指标。ROC曲线分析结果显示,FABP1诊断T2DM合并NAFLD的AUC为0.693,提示FABP1在T2DM合并NAFLD诊断方面具有一定价值,可为临床鉴别T2DM患者合并NAFLD提供参考。
PTX3是一种典型的炎性反应急性期反应蛋白,定位于第3号染色体q25区内,参与免疫、炎性反应、细胞凋亡、血管重塑等多种生理、病理过程[18]。PTX3在炎性反应初级信号诱导下由固有免疫细胞、血管内皮细胞、平滑肌细胞等合成分泌,改变动脉内已经形成粥样硬化斑块的稳定性,导致血栓形成[19]。PTX3同样参与糖尿病发病机制,有研究报道,PTX3在T2DM中表达升高,其水平与TC、LDL-C水平相关[20],在妊娠期糖尿病患者中PTX3水平也明显升高,与BMI、FPG、HOMA-IR呈正相关[21]。本研究发现,无NAFLD组、NAFLD组血清PTX3水平均高于对照组,且在NAFLD组中水平最高,PTX3水平与BMI、TC、HOMA-IR呈正相关。回归分析结果显示PTX3水平升高是T2DM患者合并NAFLD的独立危险因素之一,提示PTX3与T2DM患者糖脂代谢紊乱和胰岛素抵抗有关,高脂血症、高血糖和胰岛素抵抗可能加剧肝脏脂质聚集和肝纤维化进程,诱导NAFLD发病。邓银芝等[22]报道,NAFLD患者血清PTX3水平高于健康体检者,且在合并胰岛素抵抗的NAFLD患者中PTX3水平更高,以上结果提示PTX3水平升高一方面加剧T2DM患者肝脏组织脂质堆积和肝硬化,另一方面诱导NAFLD患者胰岛素抵抗,PTX3可能是T2DM和NAFLD共病的关联因子。本研究ROC曲线分析结果显示,PTX3诊断T2DM合并NAFLD的AUC为0.700,与谭莉莉等[23]研究一致,表明血清PTX3水平诊断NAFLD具有较高价值。AUC可直接体现指标的诊断应用价值,本研究中PTX3诊断T2DM合并NAFLD的AUC、灵敏度、特异度均高于或接近于0.7,提示其有较好的应用价值。此外,本研究ROC曲线结果显示,联合检测FABP1和PTX3诊断T2DM合并NAFLD的AUC为0.894,高于FABP1和PTX3单独检测的诊断效能。
综上所述,T2DM合并NAFLD患者血清FABP1、PTX3水平均升高,FABP1、PTX3与T2DM合并NAFLD患者的BMI、糖脂代谢紊乱和胰岛素抵抗均有关,高水平FABP1、PTX3是T2DM合并NAFLD的独立危险因素,可作为诊断T2DM合并NAFLD的潜在指标,联合检测两项指标可提高诊断效能。

