JDP2、SGK1、GSK-3β在非小细胞肺癌组织中的表达及意义*
余 凤,李 良,赵 静
东南大学附属中大医院江北院区/南京市大厂医院病理科,江苏南京 210044
非小细胞肺癌(NSCLC)在肺癌中是一种常见的类型,其病死率和发病率呈现逐年上升的趋势,临床症状主要有咯血、气促、咳嗽、发热等[1-2]。有研究表明,二聚化蛋白(JDP2)是一种转录活化因子1的抑制物,参与肿瘤细胞迁移、分化、增殖等过程。糖皮质激素调节激酶1(SGK1)具有参与调控多种生理机制的功能,SGK1的活性增加和异常表达与恶性肿瘤的发生、发展密切相关[3-4]。糖原合成酶激酶-3β(GSK-3β)具有磷酸化代谢因子、信号蛋白、细胞结构蛋白及转录因子等多种底物的功能,并且在肿瘤发生及细胞的生长、发育等过程中具有重要的作用[5]。本研究回顾性分析了本院收治的76例NSCLC患者的临床资料,探讨JDP2、SGK1、GSK-3β在NSCLC组织中的表达情况,以及三者的相关性,为临床NSCLC治疗方案提供数据参考。
1 资料与方法
1.1一般资料 选择2018年6月至2020年6月本院收治的76例NSCLC患者纳入肺癌组,病理科均保存有NSCLC组织标本,组织类型包括腺癌42例,鳞癌34例;病程1~2年,平均(1.43±0.40)年。纳入标准:所有患者均符合《NCCN非小细胞肺癌临床实践指南》中关于NSCLC的诊断标准[6];均经组织病理检查确诊为NSCLC;临床病理资料完整。排除标准:合并支气管炎、肺炎等疾病;合并免疫系统功能缺陷疾病;合并结肠癌、乳腺癌、胃癌等疾病;有沟通障碍或者严重精神病;近期内未接受过抗肿瘤治疗。选择同期76例在本院接受过肺组织活检,并保留有正常肺组织(距肿瘤边缘>5 cm)的患者纳入对照组。所有研究对象中男83例,女69例;年龄46~78岁;体质量指数(BMI)为24~29 kg/m2;有吸烟史91例,嗜酒史81例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经过本院医学伦理委员会批准,批准文号:(2018)伦审第(58)号。
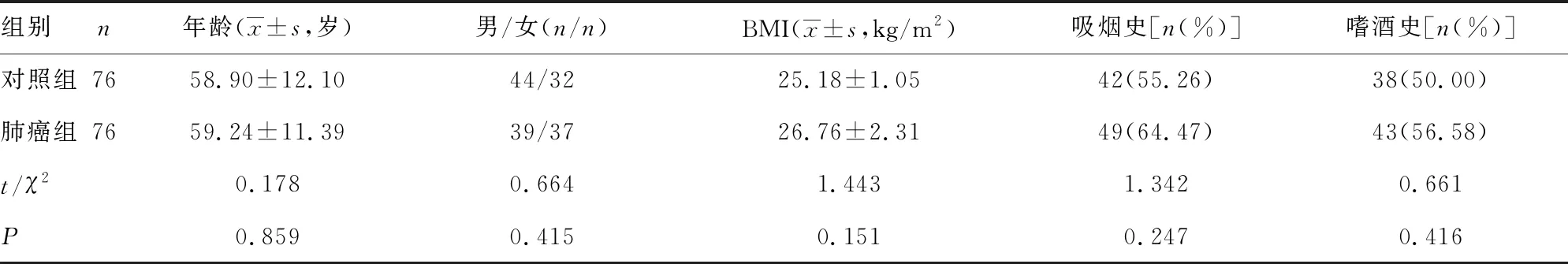
表1 两组一般资料比较
1.2方法
1.2.1免疫组化法检测JDP2、SGK1、GSK-3β 采用免疫组化法对NSCLC及正常肺组织中的JDP2、SGK1、GSK-3β进行检测,具体步骤:采用4%的甲醛溶液对组织标本进行固定,采用石蜡进行包埋切片,将组织切片采用二甲苯脱蜡,梯度乙醇水化后采用蒸馏水冲洗3次,每次3 min。随后将切片浸入枸橼酸缓冲液(pH值为6)中,对其加热到100 ℃,3 min后,冷却至37 ℃,使用PBS缓冲液将其洗涤3次,每次3 min。将3%过氧化氢灭活内源性过氧化物酶滴至切片上,PBS缓冲液洗涤3次,每次3 min。将小鼠抗人PAX-2、Galectin-1多克隆抗体(浓度为1∶100,购自Abbkine公司)滴至切片上,在4 ℃的温度条件下储存过夜;PBS缓冲液洗涤3次,在各切片中加入即用型生物素化二抗,在37 ℃的温度条件下静置30 min;PBS缓冲液洗涤,将辣根酶标记链霉卵白素工作液滴至切片上,于37 ℃的温度下静置20 min;DAB显色且苏木素复染后,用自来水冲洗3次,乙醇梯度水化,晾干后采用中性树脂进行封片;采用DM-440倒置显微镜观察JDP2、SGK1、GSK-3β表达。
1.2.2阳性结果判定 由两位临床经验>5年的医师对阳性细胞的染色情况进行统计:在显微镜下随机选取5个高倍视野(×400)的切片,医师需检测每个视野下JDP2、SGK1、GSK-3β吸光度和阳性面积,计算其平均吸光度和阳性面积的平均值。细胞核染色程度判断:0分为未见染色,1分为浅黄色,2分为棕黄色,3分为棕褐色。阳性细胞百分率判断分为4个等级:0分为<5%;1分为5%~<25%;2分为25%~<50%;3分为≥50%。最终将细胞核染色程度结果与阳性细胞百分率结果相乘计算总分,阴性为<2分,阳性为≥2分,观察并记录JDP2、SGK1、GSK-3β阳性表达率。

2 结 果
2.1两组NSCLC组织中JDP2、SGK1、GSK-3β阳性表达情况比较 与对照组比较,肺癌组JDP2、GSK-3β阳性表达率较低,SGK1阳性表达率较高,差异有统计学意义(P<0.05),见表2。JDP2、SGK1、GSK-3β在两组组织中的免疫组化染色情况见图1~3。
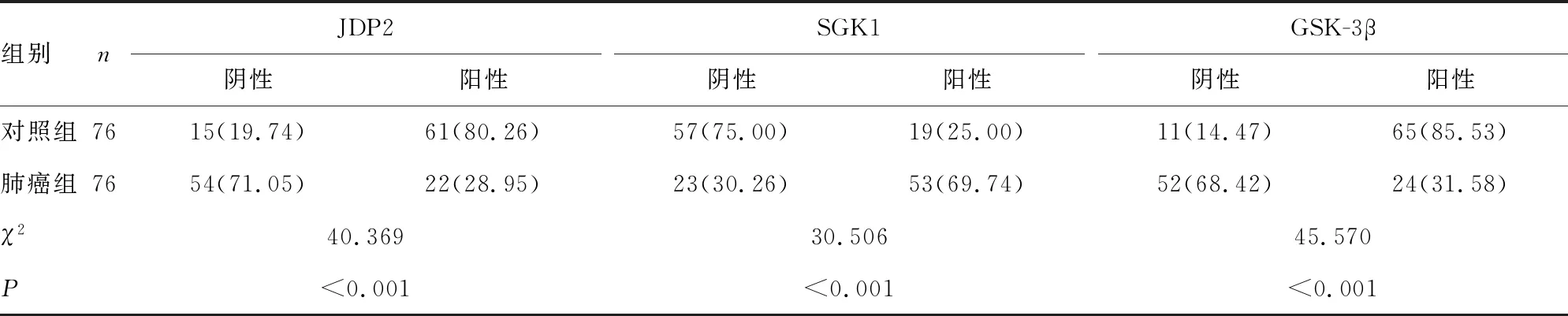
表2 两组NSCLC组织中JDP2、SGK1、GSK-3β阳性表达情况比较[n(%)]
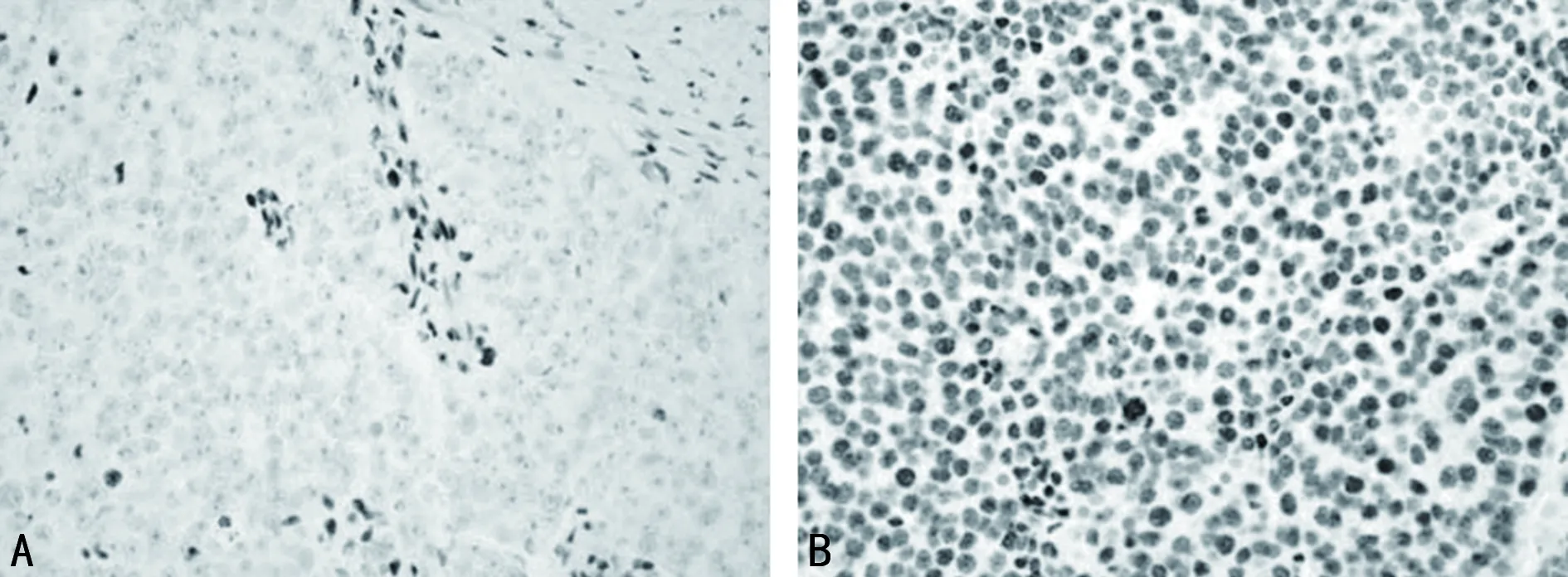
注:A为NSCLC组织;B为正常肺组织。
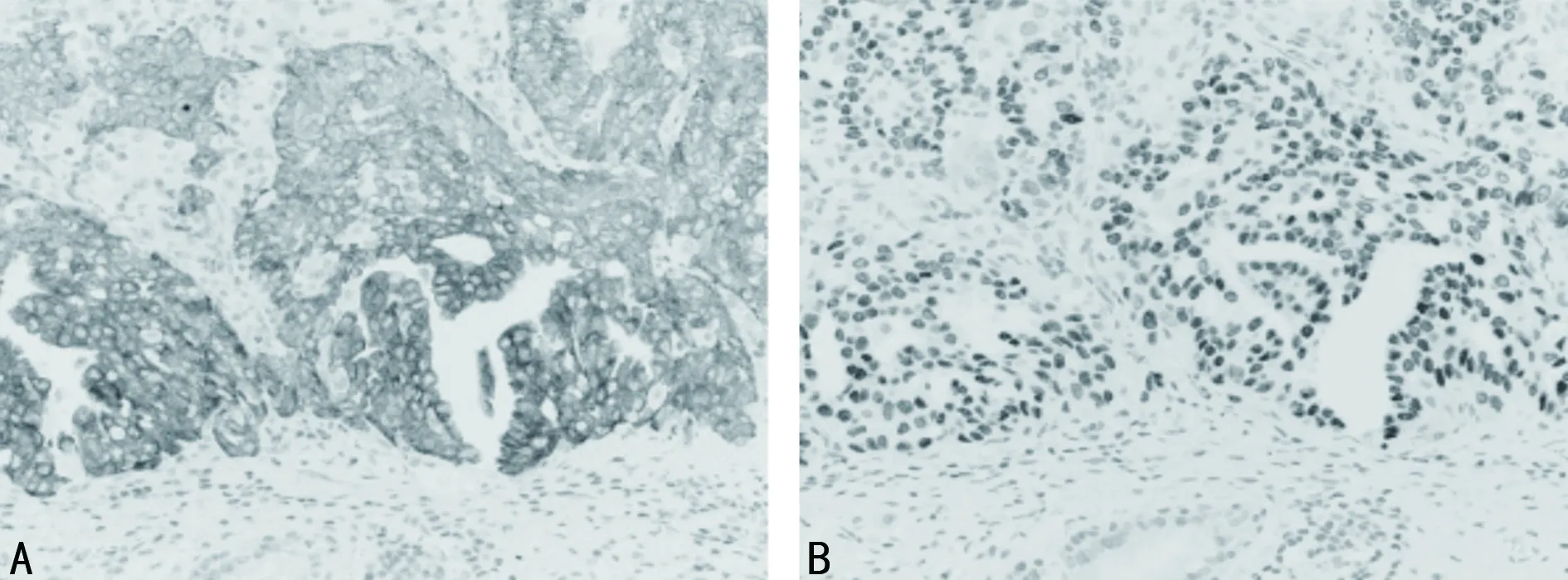
注:A为NSCLC组织;B为正常肺组织。
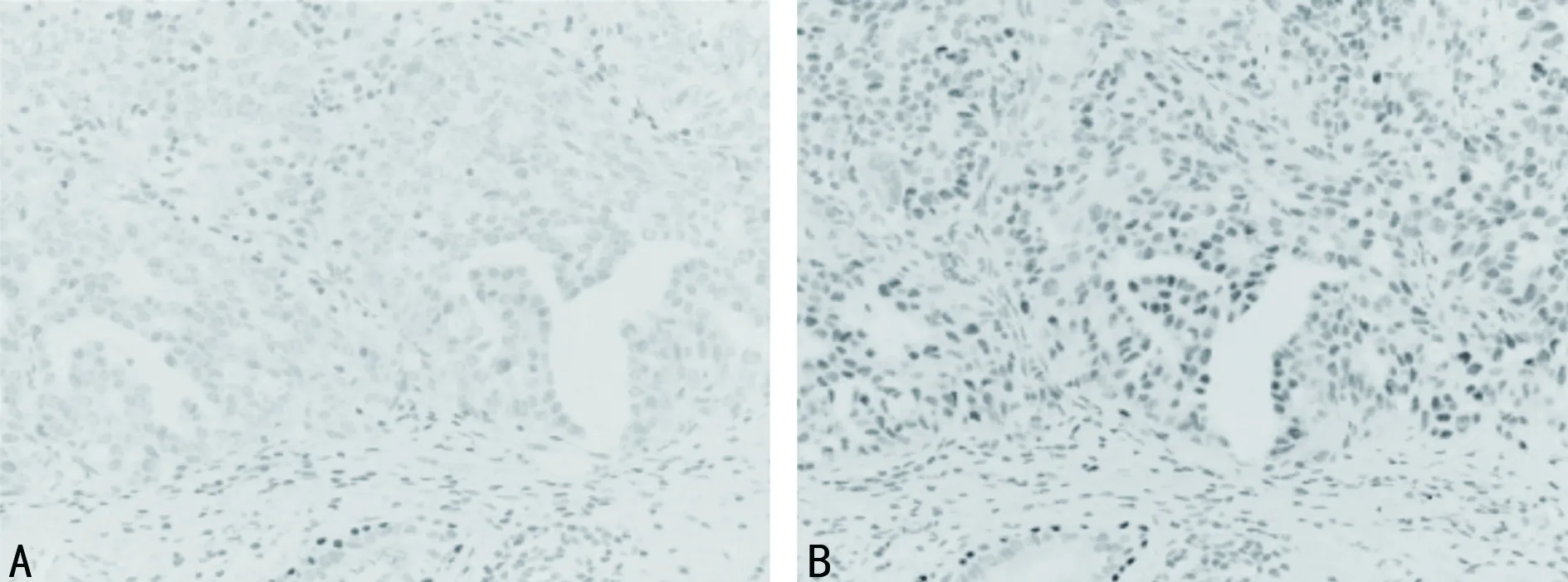
注:A为NSCLC组织;B为正常肺组织。
2.2不同特征NSCLC患者JDP2、SGK1、GSK-3β阳性表达情况比较 与肿瘤最大径<3 cm、无淋巴结转移、TNM分期Ⅰ~Ⅱ期、高分化程度患者比较,肿瘤最大径≥3 cm、有淋巴结转移、TNM分期Ⅲ期、低中分化程度患者JDP2、GSK-3β阳性表达率较低,SGK1阳性表达率较高,差异有统计学意义(P<0.05)。腺癌患者JDP2、SGK1、GSK-3β阳性表达率与鳞癌患者比较,差异无统计学意义(P>0.05)。见表3。
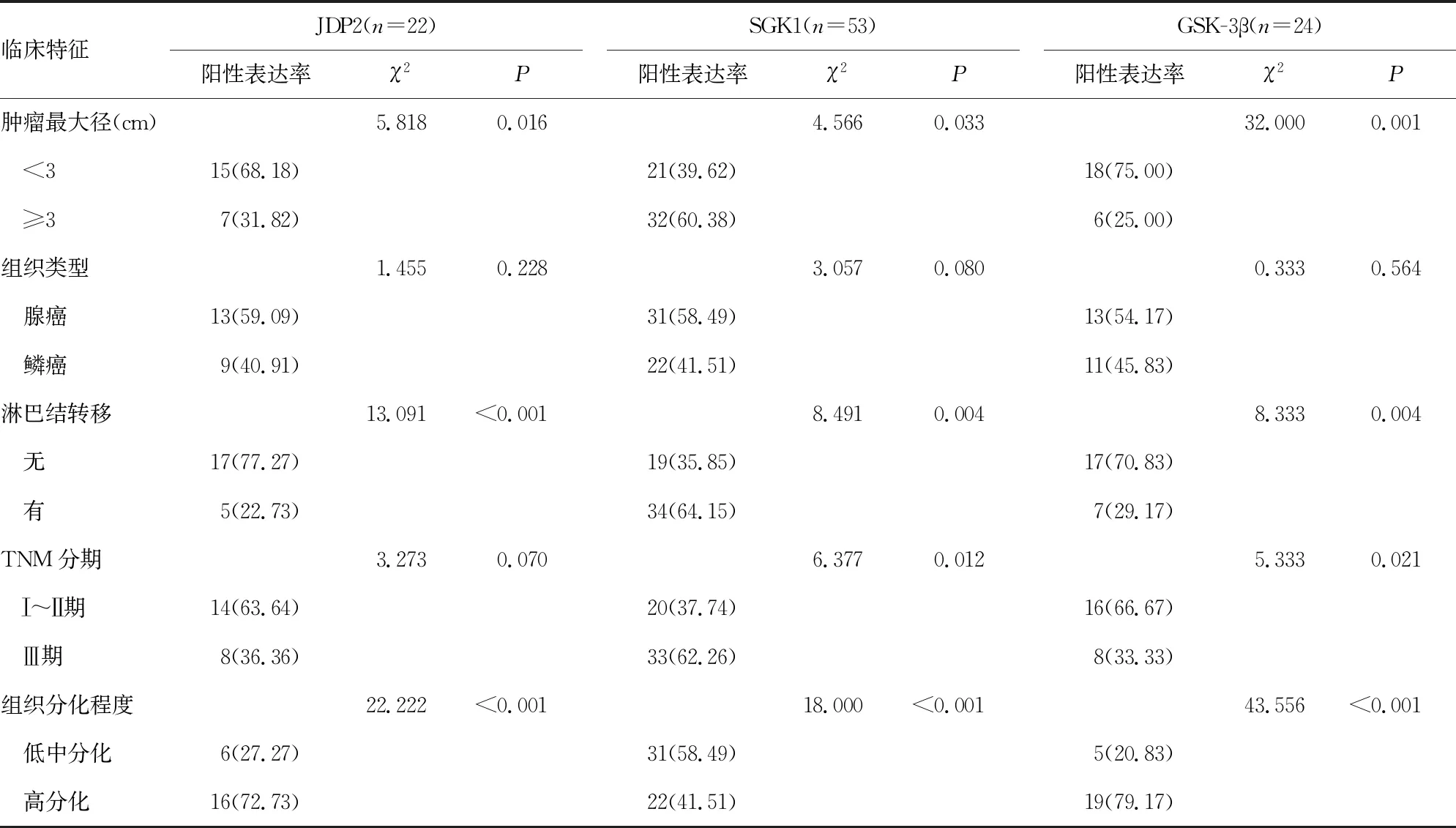
表3 不同特征NSCLC患者JDP2、SGK1、GSK-3β阳性表达情况比较 [n(%)]
2.3JDP2、SGK1、GSK-3β对NSCLC的预测价值 ROC曲线分析结果显示,JDP2、SGK1、GSK-3β预测NSCLC发生的ROC曲线下面积(AUC)分别为0.657(95%CI:0.571~0.742,P<0.001)、0.695(95%CI:0.613~0.777,P<0.001)、0.704(95%CI:0.622~0.786,P<0.001),灵敏度、特异度、阳性预测值、阴性预测值见表4。

表4 JDP2、SGK1、GSK-3β对NSCLC的预测价值(%)
2.4JDP2、SGK1、GSK-3β之间的相关性 JDP2与SGK1呈负相关(r=—0.516,P=0.004);JDP2与GSK-3β呈正相关(r=0.991,P=0.001);SGK1与GSK-3β呈负相关(r= —0.230,P=0.045)。
3 讨 论
近年来,肺癌的发病率和病死率逐渐升高,为严重威胁人类身体健康的主要癌症之一,而NSCLC在肺癌中占86%左右,并且其治愈率较低[7]。目前,治疗NSCLC的主要手段是手术切除,若患者早期被发现,治愈率较高;若患者发现患病时已发生转移,病死率较高。因此,积极寻找NSCLC发病机制中的调控因素,对其治疗有至关重要的作用[8-9]。
JDP2可对相应区域组蛋白进行激活、结合、修饰、转录,其具有抑制特异性癌基因活性的作用[10]。YU等[11]的研究显示,当NSCLC组织中JDP2蛋白表达减少时,肿瘤细胞的增殖加快,肿瘤组织生长速度及恶性程度增加,分化程度降低,临床分期较高。此外,一方面JDP2能够激活肿瘤细胞上皮间质转化过程,使肿瘤细胞生长周期加快,从而增加肿瘤组织的恶性程度;另一方面,羧基末端延伸部分与JDP2蛋白进行结合,JDP2具有促进肿瘤细胞基因分化及转录的作用,进而促进肿瘤恶性发展[12]。临床研究发现,JDP2参与恶性肿瘤发生、发展的机制可能为组蛋白乙酰基转移酶与JDP2结合,从而抑制肿瘤基因的转录及组蛋白的乙酰化,同时对肿瘤细胞的分化、增殖及生长周期停滞也具有抑制作用,进一步对肿瘤细胞的临床分期进行抑制[13]。目前已有研究发现,JDP2在NSCLC组织中表达异常,且与患者病理特征相关[14]。本研究也发现,在NSCLC组织中JDP2阳性表达率低,且与肿瘤最大径<3 cm、无淋巴结转移、TNM分期Ⅰ~Ⅱ期、高分化程度患者比较,肿瘤最大径≥3 cm、有淋巴结转移、TNM分期Ⅲ期、低中分化程度患者JDP2阳性表达率较低,差异有统计学意义(P<0.05)。提示JDP2表达水平降低可能是导致NSCLC发生的危险因素,进一步证实了JDP2参与NSCLC的发生、进展。ROC曲线分析显示,JDP2预测NSCLC发生的AUC为0.657,灵敏度和特异度分别为60.31%、76.06%。
SGK1属于糖皮质激素调节蛋白激酶家族成员之一,其对机体内的细胞增殖和凋亡、神经元运动活力、激素的释放等多种生理功能具有调节作用[15]。有研究证实,SGKl在恶性肿瘤组织中呈高表达,并且其对肿瘤细胞的耐药、自噬、转移及生长具有促进作用[16-17],但是其在NSCLC中的作用机制尚不清楚。本研究结果显示,在NSCLC组织中SGKl阳性表达率较高。与肿瘤最大径<3 cm、无淋巴结转移、TNM分期Ⅰ~Ⅱ期、高分化程度患者比较,肿瘤最大径≥3 cm、有淋巴结转移、TNM分期Ⅲ期、低中分化程度患者SGK1阳性表达率较高,差异有统计学意义(P<0.05)。提示SGKl表达水平异常可能参与NSCLC患者发病的过程。本研究ROC曲线分析显示,SGKl预测NSCLC发生的AUC为0.695,提示SGKl可能是NSCLC发生肿瘤转移及分化的警示指标,分析其原因可能为SGKl可导致集落刺激因子l或者糖皮质激素诱导细胞运动性、黏附能力、细胞侵袭性增强,若抑制SGKl表达,可减缓肿瘤细胞增殖及其肿瘤组织的恶性程度,但目前临床鲜有研究分析SGKl与NSCLC的关系,因此,上述结果还需后续研究进一步分析验证。
GSK-3β在Wnt信号通路中是一种重要的糖原合成酶激酶,其能够阻断Wnt信号通路,在抑制肿瘤发生、发展中是一个较为关键的因子,在β-连环蛋白氨基末端的4个位点中加入其磷酸根,能够抑制Wnt信号的传导[18-19]。GSK-3β被认为是肿瘤潜在的调控因子,而GSK-3β在Wnt/β-catenin信号通路中的调节功能已被广泛认可,细胞增殖活化异常及肿瘤形成与异常激活的Wnt信号靶基因之间关系密切,而GSK-3β磷酸化细胞核β-catenin后可抑制其过程[20]。本研究发现,NSCLC组织中GSK-3β阳性表达率低于正常肺组织,GSK-3β阳性表达率与NSCLC淋巴结转移、TNM分期、肿瘤分化程度、肿瘤最大径有密切的关系,在有淋巴结转移、肿瘤最大径≥3 cm、TNM分期Ⅲ期、低中分化程度的NSCLC组织中阳性表达率较低。分析原因:GSK-3β能够促进线粒体介导死亡内源性细胞凋亡,使死亡受体介导的外源性细胞凋亡受到抑制,进而调节细胞分裂周期、基因转录及细胞骨架的完整性[21]。黄曌等[22]研究发现,GSK-3β在NSCLC中表达降低,认为其参与此病的发生及进展。本研究ROC曲线分析显示,GSK-3β预测NSCLC发生的AUC为0.704,是预测NSCLC发生的高能预警指标。另外,本研究还发现,JDP2、SGK1、GSK-3β三者间具有相关性。
综上所述,NSCLC患者在分化程度较低、有淋巴结转移、肿瘤最大径≥3 cm、TNM分期Ⅲ期时JDP2、GSK-3β阳性表达率明显降低,SGK1阳性表达率明显升高,说明JDP2、SGK1、GSK-3β与NSCLC发生关系密切。

