马西替坦联合维利西呱治疗缺氧性肺高压大鼠的作用机制
李 晨,李 鑫,刘春蕾,杨明会解放军总医院研究生院,北京 0085;解放军总医院第六医学中心 中医科,北京 0085;解放军总医院医学创新研究部 转化医学研究中心,北京 0085
缺氧性肺高压(hypoxic pulmonary hypertension,HPH)是由于暴露于低压缺氧环境中而引起的平均肺动脉压力(mean pulmonary artery pressure,mPAP)≥30 mmHg (1 mmHg=0.133 kPa)的一种生存率极低的慢性进展性疾病[1],属于肺性高血压(pulmonary hypertension,PH)的第三种类型[2]。世界上大约有1.4亿居民永久生活在海拔高于2 500 m的环境中,每年超过4 000万的游客去往高原地区,这些人群均有可能发展为HPH[3],成为世界重大公共卫生问题,临床上没有特定的治疗HPH的有效疗法,因此寻找可靠有效的靶点药物是临床研究的重点。治疗PH的药物主要靶向缩血管分子或扩血管分子,代表药物包括马西替坦(Macitentan)、赛乐西帕(Selexipag)和维利西呱(Vericiguat)。内皮素1(endothelin-1,ET-1)作为一种对缺氧高度敏感的血管活性分子[4],其激活导致肺血管收缩和平滑肌细胞增殖,马西替坦作为ET-1拮抗剂,可显著降低PH患者的发病率和死亡率[5]。PH患者内皮一氧化氮(NO)生成显著减少,NO作为一种关键血管扩张剂,可通过激活可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC),最终促进小动脉的血管舒张,抑制细胞增殖。维利西呱作为sGC刺激剂,可在不依赖NO的情况下促进血管重塑和舒张[6]。目前单一药物治疗PH往往效果不佳,多靶点药物联合是未来抗PH药物研究的重要方向,本课题组既往曾报道马西替坦用于治疗HPH的作用[7],而目前尚缺乏药物联合治疗HPH的报道,鉴于此,本研究探讨马西替坦联用维利西呱治疗HPH的作用机制,为进一步研发应用提供理论支持。
材料与方法
1 实验动物 SPF级雄性SD大鼠60只,体质量(220±20) g,购自维通利华实验动物有限公司,所有动物实验程序均通过解放军总医院动物伦理委员会(IACUC)批准(2017-X13-05)。动物置于动物饲养笼,随后置入低压氧实验动物仓中,保持室 内温度18℃~22℃。
2 药品、试剂和主要仪器 马西替坦、维利西呱(上海药明康德新药开发有限公司;0.9%氯化钠注射液溶解); 戊巴比妥钠(Sigma,美国);4%多聚甲醛(北京索莱宝科技有限公司),EDTA抗原修复液、BSA封闭液(Thermo Fisher);二甲苯、中性树胶(国药集团化学试剂有限公司),HE染色试剂盒(武汉赛维尔生物科技有限公司);蛋白酶和磷酸酶抑制剂、RIPA裂解缓冲液(碧云天生物技术研究所)。小动物低压氧舱(烟台冰轮高压氧舱有限公司);小动物超声(Visualsonic,加拿大);小动物呼吸机(Kent Scientific,美国);多导生理信号采集处理系统、压力容积导管(AD Instruments,美国);正置荧光显微镜(Nikon,日本);高通量扫描电子显微镜(北京聚束科技有限公司);扫描仪( Innopsys,法国)。
3 分组及给药 60只健康雄性SD大鼠随机分为5组:空白组、模型组、Macitentan组(10 mg/kg)、Vericiguat组(10 mg/kg)、Maci&Veri组(10 mg/kg+10 mg/kg),每组12只。空白组常氧饲养,其余各组在同一环境下低氧舱中饲养2周,氧浓度为10%,二氧化碳浓度为2%,模拟5 500 m高原环境。造模结束后各组灌胃相应剂量的药物,1次/d,连续2周,空白组和模型组进行等量的0.9%氯化钠注射液灌胃,饲养过程保持12 h的明暗交替,垫 料每周更换2次。
4 肺血流及右心功能检测 给药结束后,将大鼠在无菌条件下应用3%戊巴比妥钠(30 mg/kg)给予腹腔麻醉,脱毛后将大鼠固定于操作台上,运用小动物超声30 MHz探头获取右心长轴、短轴以及四腔心切面,分别测量并记录肺加速时间/肺射血时间(pulmonary blood flow acceleration time/pulmonary ejection time,PAT/PET)、右心室缩短率(right ventricular fractional shortening,RVFS)、右心室射血分数(right ventricular ejection fraction,R VEF)。
5 肺动脉压力测定 超声心动图测量完成后,将大鼠仰卧位固定于手术平台上,逐层切开颈部皮肤后行气管插管接小动物呼吸机。于胸骨左缘第4肋间切开,暴露肺和心脏,用无菌湿棉球垫压左肺,镊子撕开心包充分暴露心脏,用1 mL注射器针头在右心室流出道处扎一个小孔,沿小孔送入压力-容积导管测压,并向前延伸顺势进入肺动脉测压。采用多导生理信号采集处理系统测量压力,分别记录并计算出平均肺动脉压力(mean p ulmonary artery pressure,mPAP)。
6 右心室肥厚指数(right ventricular hypertrophy index,RVHI)测量 血流动力学检测完成后,处死大鼠,取下心脏,去除心耳和心房,准确裁剪并称量右心室、左心室、室间隔的重量,计算R VHI。RVHI=RV/(LV+IVS)。
7 肺小血管免疫荧光观察 将肺组织切片二甲苯脱蜡,各级乙醇脱水后置于EDTA抗原修复液中。PBS脱色,甩干后滴加5% BSA封闭30 min,加入一定浓度的一抗:α-平滑肌肌动蛋白、增殖细胞核抗原湿盒内4℃过夜。PBS脱色后滴加二抗避光室温孵育60 min,PBS脱色洗涤后甩干、封片,于荧光显微镜下观察并采集图像,中膜厚度百分比(WT%) = (外弹力膜直径-内弹力膜直径 )/外弹力膜直径×100%。
8 心肌组织病理检测 将右心组织放入4%多聚甲醛中固定、包埋,用于观察。心肌纤维化:HE染色将心脏组织切片二甲苯脱蜡,各级乙醇脱水后苏木素染色,1%盐酸-乙醇分化液分化,1%稀氨水促蓝液返蓝,冲洗后0.5%伊红液染色,各级乙醇脱水,二甲苯浸泡,中性树胶封固。心肌细胞超微结构:心脏组织切片用1%四氧化锇在4 ℃条件下固定2 h,用二甲砷酸钠洗涤液清洗2次,各级乙醇脱水后用纯乙醇和醋酸正戊酯混合液置换,纯醋酸正戊酯置换3次,在干燥仪中干燥2 h后固定于样品台上,放入离子溅射仪中 喷金3 min,用扫描电镜观察并照相记录。
9 蛋白芯片检测超氧化物歧化酶(superoxide dismutase,SOD)、重组人骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)、Rho卷曲蛋白激酶 2(Rho-associated coiled-coil containing protein kinase 2,ROCK2)、过氧化物酶体增殖剂激活受体α(peroxisome proliferator activated receptor alpha,PPAR-α)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 使用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液裂解大鼠右心组织,使用基于生物素标记的定制抗体阵列对样品进行分析。即对每个样品中的30 µg总蛋白进行生物素化处理,然后添加到预先用捕获抗体预印的重复玻片上,将结合的蛋白与链霉亲和素缀合的荧光染料一起孵育,在532 nm的激发波长下扫描阵列,并 使用InnoScan300微阵列扫描仪测量荧光。
10 统计学分析 采用SPSS 23.0统计学软件进行数据处理,结果以±s 表示,组间差异采用单因素方差分析(One-Way ANOVA),两两比较用L SD检验,P<0.05为差异有统计学意义。
结 果
1 各组大鼠mPAP、RVHI、右心室功能指标比较 与空白组大鼠相比,模型组大鼠的mPAP和RVHI显著升高,RVEF、RVFS、PAT/PET显著下降(P<0.01);与模型组比较,马西替坦组mPAP和RVHI降低(P<0.01),RVEF、RVFS、PAT/PET升高(P<0.05);维利西呱组mPAP和 RVHI有降低趋势(P>0.05),RVEF、RVFS、PAT/PET升高(P<0.05);联合用药组mPAP、RVHI降低,RVEF、RVFS、PAT/PET升高(P<0.01);与马西替坦和维利西呱单独用药组比较,联合用药组mPAP和RVHI显著降低,RVEF、RVFS、PAT/P ET明显升高(P<0.05)(表1)。
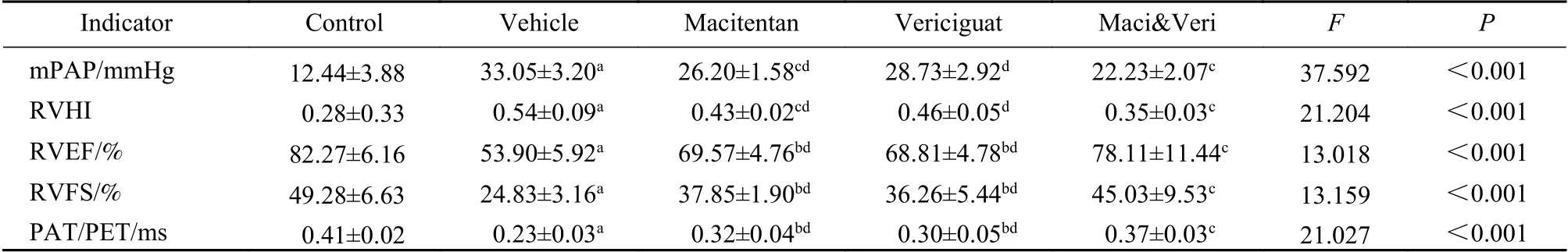
表1 各组大鼠平均肺动脉压、右心室肥厚指数、右心功能指标比较(n=5)Tab. 1 Comparison of mPAP, RVHI, and right ventricular function indexes of rats in each group (n=5)
2 各组大鼠肺小血管免疫荧光观察 与空白组相比,模型组大鼠的肺小动脉血管壁逐渐增厚,管腔逐渐狭窄,WT%值(P<0.001)增加;与模型组相比,马西替坦组血管壁厚度、WT%值(P=0.057)降低,维利西呱组血管壁厚度、WT%值有降低的趋势但无统计学差异,联合用药组血管壁厚度、WT%值(P=0.002)明显降低;与马西替坦和维利西呱单独用药组比较,联合用药组WT%值(P=0.048、0.000 7)均显著降低(图1)。

图1 各组大鼠肺小血管病理学改变(免疫荧光,400×)和WT%比较免疫荧光染色用于标记肺小血管中PCNA(红色)和α-SMA(绿色)的表达,细胞核用DAPI染色(蓝色)。aP <0.05,vs空白组;bP <0.05,vs模型组;cP <0.05,vs Maci&Veri组Fig.1 Pathological changes of pulmonary small vessels of rats in each group (IF, 400×) and comparison of WT%Immunofluorescence staining of small pulmonary blood vessels is used to mark the expression of PCNA (red) and α-SMA (green), and the nucleus is stained with DAPI (blue);Comparison of WT% of rats in each group (aP <0.05, vs control; bP <0.05, vs vehicle; cP <0.05, vs Maci&Veri)
3 各组大鼠心肌组织病理形态改变 空白组大鼠心肌细胞正常,模型组大鼠心肌细胞排列紊乱且心肌细胞肥大,用药后各组大鼠心肌组织损伤改善,联合用药组心肌组织损伤改善最明显(图2)。空白组大鼠心肌细胞超微结构正常,模型组大鼠心肌细胞中线粒体排列紊乱、固缩色加深,用药后心肌细胞损伤减轻,联合用药组心肌组织损伤减 轻程度最明显(图3)。

图2 各组大鼠心肌组织纤维化病理学改变(HE染色,400×)Fig.2 Pathological changes of myocardial fibrosis of rats in each group (HE staining, 400×)

图3 各组大鼠心肌细胞超微结构改变(扫描电镜,10 000×)Fig.3 Cardiomyocytes ultrastructural changes of rats in each group (SEM, 10 000×)
4 各组大鼠右心组织相关蛋白表达水平比较 与空白组相比,模型组iNOS(P=0.031)、ROCK2(P=0.019)表达增加,SOD(P<0.001)、BMP2(P<0.001)、PPAR-α(P<0.001)表达降低。与模型组比较,马西替坦组iNOS(P=0.018)、SOD(P=0.000 3)、BMP2(P<0.001)、PPAR-α(P=0.001)表达升高,ROCK2(P=0.048)表达降低;维利西呱组PPAR-α(P=0.006)表达升高,iNOS、SOD、BMP2、ROCK2表达无统计学差异;联合用药组iNOS(P=0.016)、SOD(P<0.001)、BMP2(P<0.001)、PPAR-α(P<0.001)表达进一步增加,ROCK2(P=0.039)表达降低。与马西替坦单独给药组比较,联合用药组BMP2(P=0.016)表达明显升高;与维利西呱单独给药组比较,联合用药组iNOS(P=0.011)、PPAR-α(P=0.016)、BMP2(P=0.016)表达显著升高,ROCK2( P=0.028)表达降低(图4)。
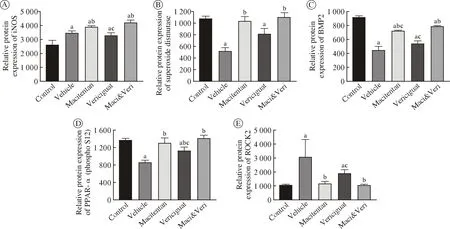
图4 各组大鼠右心组织iNOS、SOD、BMP2、PPAR-α、ROCK2的表达水平 (aP <0.05,vs空白组;bP <0.05,vs模型组;cP <0.05,vs Maci&Veri组)Fig.4 Expression of iNOS, SOD, BMP2, ROCK2, PPAR-α protein in right ventricle tissues of rats in each group (aP <0.05, vs control; bP <0.05,vs vehicle; cP <0.05, vs Maci&Veri)
讨 论
缺氧刺激引起肺血管收缩和阻力增加,持续缺氧还会引起肺小动脉和静脉水平的血管重塑,以及成纤维细胞和平滑肌细胞的增殖,导致不可逆的肺血管增厚狭窄,这些基础病理改变在肺动脉压力持续升高过程中发挥着重要作用。马西替坦作为治疗PH的有效药物,具有较高的组织渗透性和较低的肝毒性风险[8],临床报道维利西呱作为sGC刺激剂可增加内源性NO的敏感度,刺激环状鸟苷单磷酸的产生,促进血管舒张,从而降低患者的心血管风险[9]。单一靶向药物的治疗多通过舒血管作用维持正常血流供应缓解病情进展,而其源头内皮功能障碍和其终点右心衰竭均未得到有效改善,成为抗PH药物在临床应用中受限的重要原因[10]。据报道多靶点药物联合与单药治疗相比,可通过协同作用提高疗效,降低临床恶化率,成为未来的治疗方向[11]。本研究通过构建HPH大鼠模型,发现模型组大鼠血流动力学异常、右心肥厚,右心功能指标如RVEF、RVFS、PAT/PET明显降低,伴有肺小血管壁增厚、心肌损伤等症状,显示HPH大鼠模型构建成功。
本实验显示,马西替坦组可有效缓解缺氧引起的mPAP、RVHI升高以及右心室功能损伤。维利西呱组对mPAP、RVHI升高的影响不大,但可有效降低缺氧引起的右心室功能改变,维利西呱的治疗作用以左心疾病引起的PH为主,其是否适用于其他类型的PH仍有待研究[6]。虽然维利西呱在单独使用时治疗效果不佳,但联合用药后可明显降低肺动脉压力并改善右心功能,且效果优于马西替坦组。病理检测结果也显示联合用药后可明显抑制心肌肥厚、肺小血管重构及心肌线粒体损伤,效果优于马西替坦、维利西呱单独给药组,以上均表明了马西替坦与维利西呱联用具有协同作用。
NO是体内发现的第一个气体信息分子,是细胞间信息传递的重要调节因子,广泛参与体内多个系统的生理和病理过程[12]。一氧化氮合酶(nitric oxide synthase,NOS)是NO合成的关键酶,其活性变化直接调节NO的生成量及其生物学效应,NOS又分为结构型和诱导型两种亚型,iNOS在病理条件下由炎症、肿瘤等诱生[13]。本研究结果表明,在缺氧环境中,模型组iNOS合成增加,是机体一种代偿性的保护机制。与模型组相比,马西替坦组iNOS表达量进一步增加,维利西呱组iNOS表达量增加不明显,联合用药组可进一步增加iNOS表达量。这可能与Macitentan联用Vericiguat协同增加iNOS的表达,导致体内NO合成增加相关。
PPAR-α是调节脂肪酸的关键基因,在右心室肥大过程中表达量减少,PPAR-α缺失会引起心肌肥大[14-15]。SOD是反映人体内自由基代谢状态的重要指标之一,对机体的氧化与抗氧化平衡起着至关重要的作用,其水平高低可间接反映机体内清除自由基的能力,检测SOD水平可了解机体损伤情况。心肌缺血缺氧时机体自由基代谢紊乱,SOD水平下降,治疗后SOD水平可明显升高[16-17]。骨形态发生蛋白(bone morphogenetic protein,BMP)属于转化生长因子-β超家族,其在骨的再生和修复中起重要作用。研究还发现BMP参与调节多种细胞增殖、分化和凋亡的生物学过程。缺氧会引起BMP2表达量下降,即缺氧可抑制BMP2的表达[18]。ROCK具有丝氨酸苏氨酸蛋白激酶活性,是一种与细胞凋亡相关的结合蛋白,ROCK2是活化的Caspase3、Casepase2等的裂解产物,与Caspase介导的凋亡相关[19]。本研究检测结果显示,持续缺氧引起右心室组织中iNOS、SOD、BMP2、PPAR-α的表达明显降低,ROCK2增加。马西替坦可提高iNOS、SOD、BMP2、PPAR-α的表达,降低ROCK的表达,维利西呱作用不显著,联合用药后可进一步增加iNOS、SOD、BMP2、PPAR-α的表达,并降低ROCK2的表达,提示马西替坦联用维利西呱对右心室肥厚的保护作用更佳。
综上所述,本研究证实马西替坦联用维利西呱具有协同作用,能更好地发挥药物的舒血管作用,可降低肺动脉压力、减少右心肥厚、改善肺小血管重构和心肌损伤,这可能与两者联用能减少体内自由基、脂肪酸代谢,并缓解细胞增殖及凋亡等损伤相关,为今后抗HPH的联合药物应用和进一步研究提供重要的依据和参考。

