菌株Citrobacter sp. ZY630铁(Ⅱ)氧化硝酸盐还原生物学和化学途径
王 娟,张 玉,赵 睿 智,苏 志 强,高 嘉 欣,赵 紫 荆,周 集 体
(大连理工大学 环境学院 工业生态与环境工程教育部重点实验室, 辽宁 大连 116024 )
0 引 言
铁在地壳中占比约为4.75%,是地壳中含量第四丰富的元素,其在环境中主要以离子态和Fe(Ⅱ)或Fe(Ⅲ)的矿物形式存在[1],探究 Fe(Ⅱ)和Fe(Ⅲ)之间转换对生物地球化学循环具有重要作用[2].铁在生物地球化学循环过程中能耦合C、N、S、O等元素的循环[3-4],特别是在微生物充当媒介下.1996年,Straub等在溪流、城市沟渠等水体沉积物中观察到以硝酸盐为电子受体的铁氧化现象,首次报道了硝酸盐依赖型厌氧亚铁氧化(nitrate-dependent anaerobic ferrous oxidation,NAFO)菌的分离和纯化[5].在此后20多年,NAFO微生物被研究者广泛关注.这类微生物被发现在自然界许多生境中,如淡水底泥[6]、稻田土[7]、海洋沉积物[8]及地下水沉积物[9]等缺氧环境,其是环境中Fe-N元素循环的重要纽带[1].

实验室分离纯化了一株具有反硝化功能的兼性厌氧菌株,分子生物学鉴定为柠檬酸杆菌属,命名为Citrobactersp. ZY630.在自养条件下,探究菌株ZY630硝酸盐还原和Fe(Ⅱ)氧化动力学特性,从生物转化和化学反应的角度,对硝酸盐还原与Fe(Ⅱ)/Fe(Ⅲ)转化进行研究.同时分析亚硝酸盐与Fe(Ⅱ)的化学反应对Fe(Ⅱ)-硝酸盐-微生物体系反硝化过程的影响,以阐明Fe(Ⅱ)氧化与硝酸盐还原在微生物介导下的作用机制.
1 实验材料与方法
1.1 菌株来源
菌株来自于实验室周围的环境中.
1.2 实验培养基
(1)无机盐培养基
除特殊标明外,实验所用药品均为分析纯,且并未进一步纯化处理.实验所用的无机盐培养基是对脱氮硫杆菌ATCC25259专用培养基(T2)进行部分修改而来,具体配制方法如下:
溶液A:5 g Na2S2O3·5H2O,1 g NH4Cl,2 g KNO3(优级纯),450 mL超纯水.
溶液B:2 g K2HPO4,250 mL超纯水.
溶液C:1 mL FeSO4·7H2O溶液(0.02 g FeSO4·7H2O溶于20%盐酸),0.8 g MgSO4·7H2O,1 mL微量元素溶液,250 mL超纯水.
溶液D:2 g NaHCO3,50 mL超纯水.
微量元素溶液(g/L):EDTA 50、ZnSO422、CaCl25.54、MnCl25.06、(NH4)2MoO41.1、CuSO41.57、CoCl21.61.微量元素溶液pH为6.0.
配好的溶液用纯度大于99%的氮气曝气20 min,密封后进行灭菌.其中溶液A、B、C在121 ℃高压灭菌20 min,溶液D采用0.22 μm的滤膜进行过滤除菌.溶液经过灭菌后立即转移到厌氧箱中,防止氧干扰.在厌氧箱中将溶液进行混合,并控制pH在7.0±0.2.
固体培养基是该无机盐培养基加入2%的琼脂粉配制而成.
(2)LB固体培养基
LB固体培养基成分为酵母浸粉5 g/L、NaCl 10 g/L、蛋白胨10 g/L,用8%的NaOH将pH调节至7.0,加入2%的琼脂粉.
(3)铁自养反硝化培养基
铁自养反硝化培养基:K2HPO40.1 g/L、NaHCO31 g/L、MgCl2·6H2O 0.1 g/L、CaCl20.1 g/L、NaNO31 mmol/L、微量元素溶液1 mL/L,Fe2+以FeCl2·4H2O的形式提供,根据实验要求进行配制.其中NaHCO3和FeCl2·4H2O在接种前通过过滤除菌的方式加入(现用现配).最终pH控制在7.0±0.2.各组分均曝氦气20 min.
1.3 菌株的分离纯化与菌种鉴定
利用无机盐培养基从本实验室保藏的受污染的菌液样品中分离纯化出一株菌,并用30%的甘油进行保存.将纯化后的微生物分别在LB和无机盐固体培养基上进行培养,发现其在相同的培养基上菌落大小、形态一致,初步判定为纯菌.
之后将纯化菌种委托生工生物工程(上海)股份有限公司进行菌株16S rDNA的PCR扩增和序列测定.基因组DNA的提取按Ezup柱式细菌基因组DNA抽提试剂盒SK8255(生工)操作说明进行实验.PCR扩增使用的引物序列为27F 1492R(5′-AGAGTTTGATCCTGGCTCAG,GGTTACCTTGTTACGACTT-3′).
1.4 菌株的序列分析
将测序结果输入NCBI进行Blast检索,得出与该序列最相近的100个菌属序列.从这些序列中选取几株同源性较高菌属的16S rDNA基因序列做内群,并通过查阅文献找到与该菌属最相近的其他菌属做外群,利用Mega7进行分子系统发育分析[17-18].
1.5 菌株的培养和脱氮功能探究
1.5.1 菌株形貌分析
(1)菌落特征
将菌液稀释并涂布于LB固体培养基上,放置在30 ℃的恒温培养箱静置培养,观察其菌落形态.
(2)菌的微观形貌
在无菌环境中将盖玻片放置于培养皿中,在盖玻片上滴2滴经过重新悬浮的细胞样液,待其自然风干后加入2.5%戊二醛,在4 ℃冰箱中放置12 h,用30%、50%、70%、85%、95%、100%乙醇依次脱水25 min,自然风干,之后用碳胶带将样品固定在样品台,喷金,SEM扫描测样,观察菌的微观形貌[19].
重新悬浮的细胞样液:取10 mL菌液,在10 000 r/min条件下离心5 min,倾掉上清液后,加入1 mL的无菌生理盐水进行重悬.
1.5.2 菌株的生长动力学特性 在厌氧环境下,取0.5 mL菌液接种于100 mL无机盐培养基中.密封后在30 ℃、150 r/min的摇床中进行培养.定期取样测定菌体浓度.
1.5.3 菌株的亚铁氧化硝酸盐还原能力探究
(1)实验方法
取在无机盐培养基中生长在对数期(OD660=0.550±0.050)的菌悬液,在10 000 r/min下离心5 min,并用无菌生理盐水清洗2次.最后在厌氧箱中用经过曝气的无菌生理盐水进行重悬.然后将重悬液以2%的体积比加入血清瓶中.
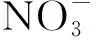
在整个实验过程,所有样品瓶均放置在厌氧箱中进行静置培养,保持温度在(30±2) ℃.
(2)沉淀产物表征
培养5 d后,收集加菌加6 mmol/L Fe2+体系的沉淀产物,对其进行XRD和SEM-EDX分析.SEM-EDX的样品制备与菌的微观形貌观察时一致.XRD的样品制备:将产物经10 000 r/min离心5 min,之后用曝气后的超纯水清洗3次,并先后使用75%乙醇、100%乙醇、丙酮各洗涤1次[20],最后在-60 ℃真空干燥[21],干燥后的产物立即分析.用X射线衍射仪(SmartLab 9 kW)表征,检测条件40 kV、100 mA,扫描角度10°~80°,扫描速度8°/min[20].数据处理软件HighScore Plus.

1.6 实验分析方法
菌体浓度使用OD660来表示,以纯水做参比液,取菌液测定其在波长为660 nm下的吸光度[22].
2 结果与讨论
2.1 纯化后菌的形态和种类
纯化后的菌株菌落呈圆形、乳白色,表面光滑、湿润、边缘整齐(图1(a)),不易挑起.该菌属革兰氏阴性菌,呈杆状(图1(b)、(c)),尺寸为0.5 μm×(1.5~3) μm.
用一对细菌16S rDNA的通用引物PCR扩增获得该菌株16S rDNA基因片段,对此片段进行回收、测序,得到1 477 bp的序列.将测序所得序列输入NCBI进行Blast检索,发现纯化菌株与柠檬酸杆菌属细菌的核苷酸序列自然聚类.在最相近的100个序列中,柠檬酸杆菌属细菌占96%,纯化菌株与其的同源性为98.50%~99.86%,因此确定其为柠檬酸杆菌,命名为Citrobactersp. ZY630(简称菌株ZY630).从中选择同源性较高的柠檬酸杆菌属的16S rDNA基因序列,并以大肠埃希氏菌(Escherichiacoli)和肠炎沙门氏菌(Salmonellaenteritidis)为外群[28]进行系统发育分析.结果如图2所示.

(a) 菌落照片

(b) 高分辨率SEM图

(c) 低分辨率SEM图
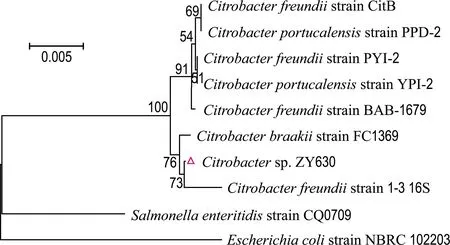
图2 菌株ZY630的系统发育树Fig.2 Phylogenetic tree of strain ZY630
2.2 菌株ZY630的生长动力学特性
图3反映了接入0.5 mL菌液后菌株在无机盐培养基中的生长曲线.从图中可以看出,初始菌液加入培养体系后,会出现约6 h的适应期,在这个时期菌株生长缓慢.在6 h之后,菌株快速生长,进入对数期,由图可以看出6~24 h为菌株的对数生长期.菌株在24 h附近进入稳定期,此时OD660为0.711.

图3 菌株ZY630的生长曲线Fig.3 Growth curve of strain ZY630
2.3 菌株的亚铁氧化硝酸盐还原功能探究

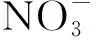

图6 Fe2+浓度随时间的变化Fig.6 Changes of Fe2+ concentration with time
对反应前后体系的pH和ORP进行测定,发现相比于化学对照组,加菌加Fe2+体系发生pH的降低和ORP的升高(图7).ORP意为体系中的氧化还原电位,代表反应过程中的氧化还原产物的变化,其值的升高表明体系中生成氧化产物,符合Fe2+-Fe3+的转化.对于体系中pH的降低,目前已有很多报道[33-35],其主要原因是生成的Fe3+以氢氧化物形式存在,消耗了体系中的OH-.
2.3.2 菌株ZY630亚铁氧化硝酸盐还原的产物表征 用扫描电镜分别对6 mmol/L Fe2++菌组48 h和120 h的沉淀产物进行分析.如图8所示,其中圈内标出的是菌,在菌表面和周围沉积偏白色小颗粒和絮状物代表含铁矿物.由图8可以看出,随着菌在含Fe2+体系中停留时间的延长,其表面沉积的含铁矿物增加,到120 h后,菌表面几乎被铁矿物覆盖.王茹等[36]提出胞外堆积的铁氧化物或氢氧化铁可阻碍细胞与外界的物质交流和细胞之间的信息交流,对微生物的生长繁殖产生不利影响.当Fe(Ⅲ)在细胞周质或表面结晶时会损坏细胞膜、蛋白和其他细胞结构,破坏细胞吸收营养物质的渗透压,阻碍微生物生长繁殖;当Fe(Ⅱ)进入细胞质,会占用蛋白质上其他金属的位点,进行具有破坏性的氧化还原反应[37-38].

(a) ORP

(b) pH
对6 mmol/L Fe2++菌组反应120 h后的沉淀产物进行表征.XRD数据显示,分离出的沉淀产物中有两种不同的晶体结构(图9).在2θ为21.223°、33.242°、36.650°、47.306°、53.283°、63.976°处,分别代表晶体在(1,1,0)、(1,3,0)、(1,1,1)、(0,4,1)、(2,2,1)、(0,6,1)晶面的衍射峰,这些衍射峰均表明这一晶体的化学式为FeO(OH),PDF卡片为ICOD File No. 00-029-0713.而在2θ=26.677°处的衍射峰则代表Fe3(PO4)2(H2O)8(ICOD File No. 01-079-1928)的(1,2,1)晶面.体系中FeO(OH)的生成证实了菌株ZY630能够以Fe2+为电子供体,发生亚铁氧化硝酸盐还原反应.结合体系中pH变化情况,推测反应方程式为式(1)~(3).产物中检出八水合磷酸亚铁,表明在120 h时6 mmol/L Fe2++菌组中的Fe2+未全部转化为Fe3+,其沉淀以磷酸水合物的形式存在,符合图6所示.

(a) 48 h

(b) 120 h

图9 菌株ZY630亚铁氧化硝酸盐还原产物的 XRD分析Fig.9 XRD analysis of nitrate reduction products from ferrous oxidation of strain ZY630

4H+
(1)
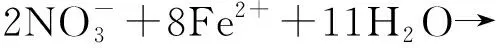
14H+
(2)

18H+
(3)


图10 亚硝酸盐体系浓度随时间的变化Fig.10 Variation of concentration in nitrite system with time


10H+
(4)

6H+
(5)

图11 亚硝酸盐体系Fe2+浓度随时间的变化Fig.11 Variation of Fe2+ concentration in nitrite system with time
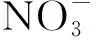
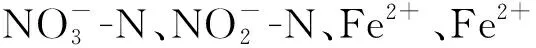
表1 加菌加Fe2+的硝酸盐还原体系各时间段氧化总量与还原总量的摩尔比及变化情况
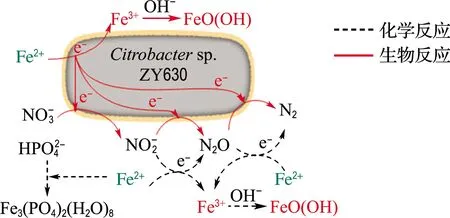
图12 主要反应机理图Fig.12 Main reaction mechanism diagram
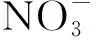

3 结论与展望
(1)从实验室中分离、纯化出一株反硝化细菌,从形态和16S rDNA分析,确定其为柠檬酸杆菌,命名为Citrobactersp. ZY630.对该菌株进行功能探究,发现其具有亚铁氧化硝酸盐还原的功能.



