NLRX1 对低氧诱导的小胶质细胞极化的影响
董 允,赵秀丽,黄登亮,张耀刚,邓 珺,张 轩,刘 吉,马艳艳
1 青海大学研究生院,青海西宁 810000;2 青海大学附属医院,青海西宁 810000;3 青海大学附属医院 中心实验室,青海西宁 810000
小胶质细胞是神经胶质细胞的一种,主要分布于大脑和脊髓。小胶质细胞具有巨噬细胞的功能,为大脑提供一个动态和高效的监测系统;生理条件下的小胶质细胞处于静息态,当机体受到创伤、感染等刺激时,静息状态的小胶质细胞被激活[1];目前认为活化后的小胶质细胞主要表现出两种不同的表型,即M1(经典激活)型和M2(替代激活)型[2]。M1型小胶质细胞分泌多种炎症介质和细胞毒物质,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-6,加重受损神经组织的损伤;而M2型小胶质细胞能吞噬细胞碎片,分泌神经营养因子和抗炎因子,如转化生长因子β(transforming growth factor-β,TGF-β)、IL-10,促进受损组织的修复。因此,探究M1型和M2型小胶质细胞之间的转化机制至关重要。NOD 样受体家族X1(NOD-like receptor family X1,NLRX1) 是NOD 样受体家族成员之一,由一个中心核苷酸结合和寡聚结构域、C-末端富含亮氨酸重复序列和一个线粒体定位序列的结构域组成,在线粒体中广泛表达[3]。NLRX1 作为一种炎症反应的负性调控因子,能够减少炎症因子的产生及激活[4]。先前的研究表明,基因敲除NLRX1 的创伤性脑损伤小鼠表现出损伤加速和脑组织病变体积扩大[5]。如前所述,小胶质细胞在刺激因素作用下会被激活并形成M1 和M2 两种主要表型,这个过程称为小胶质细胞极化。小胶质细胞极化在各种疾病导致的神经炎症中发挥着重要的作用[6-11]。NLRX1 的抗炎作用在炎症性肠炎、多发性硬化症等疾病中得到了证实;另有研究表明,线粒体自噬参与了巨噬细胞M1/M2 表型的调控[12]。NLRX1 即是线粒体自噬受体,又是炎症反应的负性调控因子,是否也影响着小胶质细胞的极化?本实验体外培养小胶质细胞,观察低氧对小胶质细胞极化和NLRX1 表达的影响,初步探索NLRX1 在其中的作用。
材料与方法
1 细胞株 小鼠小胶质细胞株BV-2(武汉普诺赛生命科技有限公司,CL-0493),293T 细胞(受赠于昆明理工大学生命科学院衰老与肿瘤分子遗传学实验室)。
2 药品试剂与仪器 DMEM 培养基(Gibco,12800-017);脂多糖(LPS)(Sigma,L2880;10 mg);CD11b(BD,560455;0.1 mg)、CD86(BD,561962;0.1 mg)、CD206(BD,141706;0.1 mg)荧光一抗;兔源抗NLRX1 抗体(Novus Biologicals,NBP1-76287);鼠源抗Actin 抗体(武汉博士德生物工程有限公司,BMO627);RNA 反转录试剂盒(Trans Gen,AT311-03);SYBR-Green(Roche,0491385001);CCK-8(武汉博士德生物工程有限公司,AR1199)。
3 激光12 色流式细胞仪(美国BD,BD FACSCelesta 0);细胞成像微孔板检测系统(美国Bio-TeK,Cytation5);生物倒置显微镜系统(日本奥林巴斯公司,CKX41+DP26);荧光实时定量PCR 仪(瑞士ROCHE 公司,ROCHE Light Cycler 480Ⅱ);化学发光凝胶成像系统(美国,AI600QC);生物安全柜(ESCO,LA2-5A1);三气细胞培养箱(美国Thermo,3131)。
3 细胞培养、干扰NLRX1 细胞系的构建及实验分组 BV-2 细胞培养于含10%胎牛血清的DMEM培养基中,于5% CO2、37℃、95%湿度的细胞培养箱中培养,2~ 3 d 更换培养基,细胞汇合度达到80%左右时用0.1%胰酶消化传代,取对数生长期的细胞接种于96 孔板或6 孔板。从北京米伽科技有限公司购买pLV[shRNA]-EGFP:T2A:Puro-U6>mNLRX1 慢病毒载体干扰质粒及对照质粒,同时获赠pLP1、pLP2 和pLP/VSVG 慢病毒包装辅助质粒。将mNLRX1 干扰质粒和对照质粒分别与pLP1、pLP2 和pLP/VSVG 包装质粒等量转染用于慢病毒包装的工具细胞293T 细胞,293T 细胞中包装好的慢病毒颗粒会分泌到培养基中;48 h后收集293T 细胞培养基并加入到BV-2 细胞培养基中,构建干扰NLRX1 的BV-2 稳定细胞系(用0.8 μg/mL 嘌呤霉素筛选慢病毒感染成功的细胞,慢病毒感染成功的细胞会表达绿色荧光蛋白GFP,可通过荧光显微镜观察绿色荧光判断细胞感染效率)。NLRX1 干扰位点序列为5’TCCCTACG CCAGCTCAATTTA3’。正常BV-2 细胞分3 组:对照组(21% O2,5% CO2,37℃),实验组(1% O2,5% CO2,37℃培养2 h、6 h、12 h、24 h、48 h),阳性对照组(LPS 1 μg/mL 处理24 h,LPS 是明确的能引起巨噬细胞向M1 极化的物质,在本研究中作为小胶质细胞M1型极化的阳性对照)。干扰NLRX1 基因的BV-2 细胞分为3 组:sh-Control 常氧组(21% O2,5% CO2,37℃),sh-Control 低氧组(1% O2,5% CO2,37℃处理6 h、24 h、48 h),sh-NLRX1 组(1% O2,5% CO2,37℃处理6 h、24 h、48 h)。
4 细胞活力测定 将BV-2 按照2 500/孔接种于96 孔板,按照细胞分组进行干预,每孔加入10 μL CCK-8,其中一组加入CCK-8 但没有细胞的孔(空白组),96 孔板置培养箱中孵育2 h,细胞成像微孔板检测系统测450 nm 处各孔的光密度(OD 值),计算细胞活力。细胞活力=(实验组-空白组)/(对照组-空白组)×100%。
5 流式细胞术检测BV2 细胞M1、M2 分型 收集各组细胞,计数,使每个流式管细胞数达1×106个,加入CD11b (5 μL)、CD206 (5 μL)和CD86 (2 μL)荧光素标记抗体,轻柔涡旋混匀后避光孵育20 min;各加入1 mL 预冷HBSS 溶液涡旋后450 g 离心5 min,重复HBSS 洗涤1 次,将细胞重新悬浮于400 μL 预冷HBSS 溶液中,涡旋后上机检测。CD11b+标记小鼠小胶质细胞,CD11b++CD86+标记M1型小胶质细胞,CD11b++CD206+标记M2型小胶质细胞,CD11b++CD86++CD206+标记M1 和M2 混合型小胶质细胞。
6 实时荧光定量PCR 检测细胞炎症因子 根据Trizol 说明书提取各组细胞RNA,检测浓度及纯度,根据Trans Gen 反转录试剂盒说明书反转cDNA。RT-PCR 反应条件:95℃预变性10 min;95℃ 15 s,60℃ 34 s 共40个循环进行扩增;扩增结束后,通过熔解曲线判断PCR 扩增的特异性。RT-PCR 结果 采用2-ΔΔCT分 析 法,使 用GraphPad Prism 8.3 作图。RT-PCR 引物由生工生物工程(上海) 股份有限公司合成,序列(5′-3′):TNF-α-F:CCCTCACACTCAGATCATCTTCT;TNF-α-R:G CTACGACGTGGGCTACAG;IL-1β-F:TCCTGTG TAATGAAAGACGGC;IL-1β-R:ACTCCACTTT GCTCTTGACTTC;IL-6-F:GATAAGCTGGAGTC ACAGAAGG;IL-6-R:GGAATGTCCACAAACTG ATATGC;IL-10-F:GCTACGACGTGGGCTACAG;IL-10-R:CGGTTAGCAGTATGTTGTCCAGC;TGFβ-F:CCTGAGTGGCTGTCTTTTGA;TGF-β-R:CG TGGAGTTTGTTATCTTTGCTG;18sRNA-F:GTA ACCCGTTGAACCCCATT;18sRNA-R:CCATCC AATCGGTAGTAGCG。
7 蛋白免疫印迹测定不同处理组NLRX1 蛋白表达 收集各处理组细胞,加入含蛋白酶抑制剂的裂解液RIPA 各150 μL 辅助超声波破碎仪对细胞进行裂解,12 000 r/min、4℃、20 min 提取总蛋白上清;用BCA 法检测各组蛋白浓度,各组蛋白以30 μg 进行变性,10% SDS-PAGE 凝胶电泳,孔径为0.45 μm 的聚偏二氟乙烯(PVDF) 膜进行电转,10%脱脂奶粉封闭1 h,NLRX1 和β-actin 的一抗适当稀释后4℃过夜,PBST 洗膜3 次,5 min/次;二抗室温孵育1 h,PBST 洗膜3 次,15 min/次;按ECL 试剂盒说明加入荧光底物,化学发光凝胶成像系统采集保存图像。
8 统计学方法 使用GraphPad Prism 8.3 进行统计分析及作图。结果以表示,两组间比较采用t检验,多组间比较采用单因素方差分析(Oneway ANOVA),P<0.05 为差异有统计学意义。
结 果
1 低氧引起BV2 小胶质细胞形态改变 倒置相差显微镜观察细胞形态,结果显示对照组细胞多呈类似“眼睛状”或圆形(图1A);而低氧(1%O2)培养6 h(图1B)、12 h(图1C)、24 h(图1D)、48 h(图1E)及阳性对照组(图1F)均使细胞突起变短、数量增多、胞体增大、阿米巴样激活态的细胞数量增多。

图1 常氧、低氧和LPS 处理后小胶质细胞形态变化(黄色箭头表示活化的小胶质细胞)Fig.1 Morphological changes of microglia after normoxic,hypoxic and LPS treatment (the yellow arrows indicate activated microglias)
2 低氧影响BV2 小胶质细胞活力 CCK-8 细胞活力检测结果显示,低氧培养2 h、6 h、12 h、24 h、48 h(图2A)及阳性对照组细胞(图2B)的相对活力分别为1.44±0.05、1.82±0.05、0.72±0.07、0.55±0.02、0.48±0.02、0.87±0.01;与对照组相比,低氧影响小胶质细胞活力(P均<0.05);低氧培养2 h、6 h 细胞活力显著加强,而随低氧培养时间延长,细胞活力逐渐降低,48 h 达到最低。
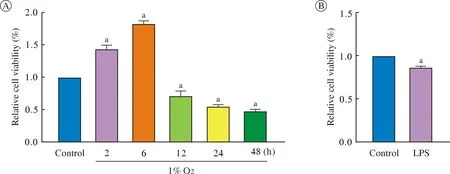
图2 不同低氧时间及LPS 处理对小胶质细胞活力的影响(aP<0.05,vs 对照组)A:不同低氧时间小胶质细胞活力;B:LPS 组小胶质细胞活力Fig.2 Effects of different hypoxia time and LPS on the viability of microglia (aP<0.05,vs control group)A:viability of microglia in different hypoxia time;B:viability of microglia in LPS group
3 低氧刺激减少M1型小胶质细胞 通过流式细胞术检测各组小胶质细胞M1、M2 分型。如图3A~图3E,P1门为所圈目的细胞群,P2门为小胶质细胞群,Q1为M1型小胶质细胞群,Q2为M1 和M2 混合型小胶质细胞群,Q4为M2型小胶质细胞群。低氧处理48 h M1型小胶质细胞百分比显著降低(图3F),M1 和M2 混合型小胶质细胞百分比显著升高(P<0.05)(图3G);低氧6 h 和12 h M1型小胶质细胞数量有降低趋势,但无统计学意义(图3F);各组M2型小胶质细胞百分比均较低,但无统计学意义;与M1型极化阳性对照组相比,低氧使M1型小胶质细胞减少(图3F、图3H),M1 和M2 混合型小胶质细胞增加(图3G、图3I)。
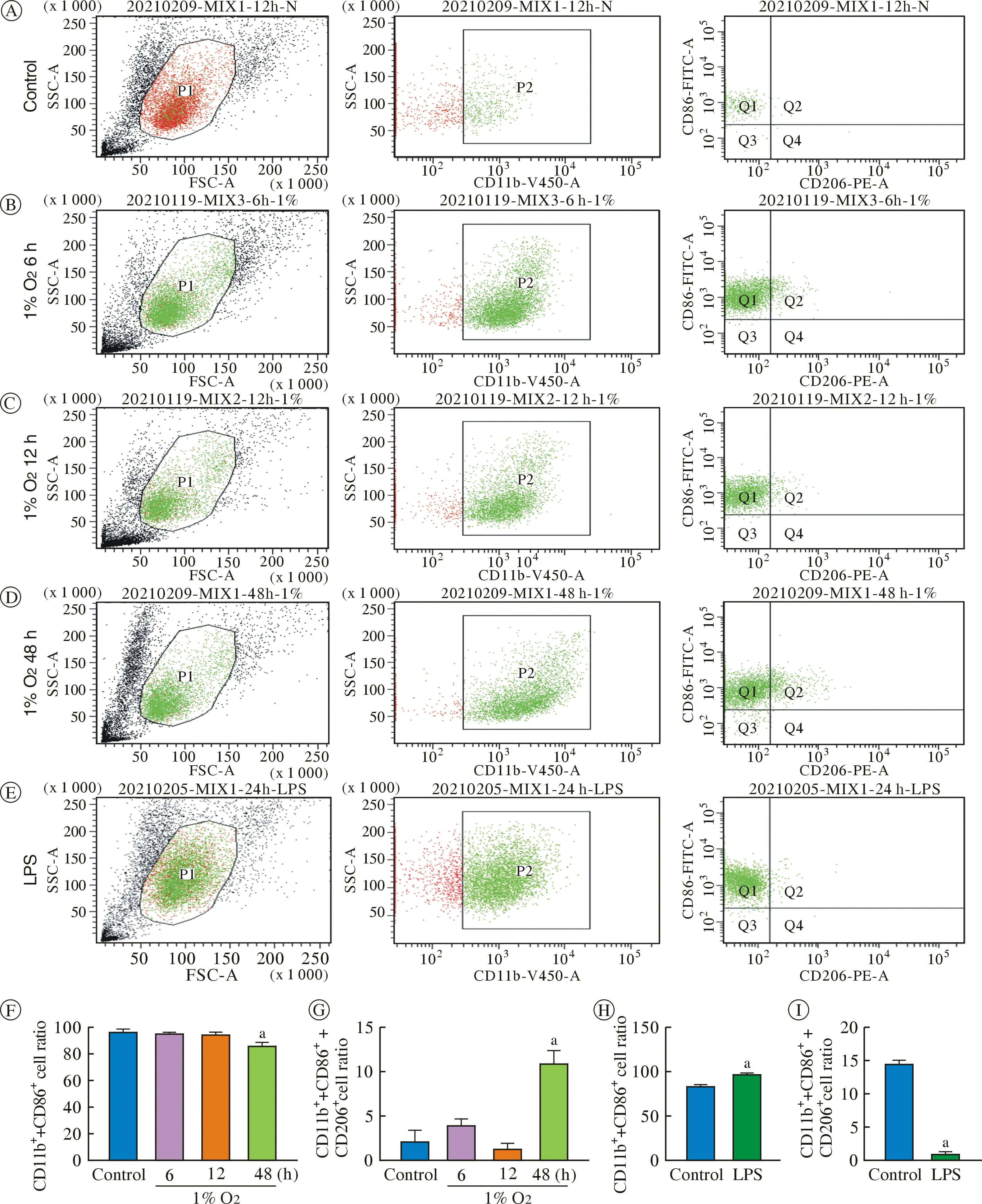
图3 不同低氧时间及LPS 处理对BV-2 小胶质细胞极化分型的影响(aP<0.05,vs 对照组)A~E:不同组BV-2 小胶质细胞M1 和M2型的流式细胞术检测结果;F:不同低氧时间M1型小胶质细胞比例;G:不同低氧时间M1 和M2 混合型小胶质细胞比例;H:LPS 处理M1型小胶质细胞比例;I:LPS 处理M1 和M2 混合型小胶质细胞比例Fig.3 Effects of different hypoxia time and LPS treatment on the polarization classification of BV2 microglia (aP<0.05,vs control group)A-E:flow cytometry results of M1 and M2 microglia in different treatment groups;F:proportion of M1 type microglia in different hypoxia time;G:proportion of M1 and M2 mixed microglia in different hypoxia time;H:proportion of M1 type microglia in LPS group;F:proportion of M1 and M2 mixed microglia in LPS group
4 低氧下调小胶质细胞中炎症因子基因的mRNA 水平 RT-PCR 结果显示,与对照组相比,炎症因子TNF-α(图4A)、IL-6(图4B) 和IL-1β(图4C)基因mRNA 水平在低氧培养细胞中显著下降,在低氧12 h 达到最低水平,24 h、48 h 逐渐上升但均低于对照组;随低氧培养时间延长,抗炎因子IL-10 基因的mRNA 水平逐渐增加(图4D),TGF-α 基因的mRNA 水平无明显变化(图4E);与LPS 处理组(M1型极化阳性对照组) 比较,低氧组TNF-α、IL-6 和IL-1β mRNA 显著降低(图4A、图4B、图4C 和图4F)。
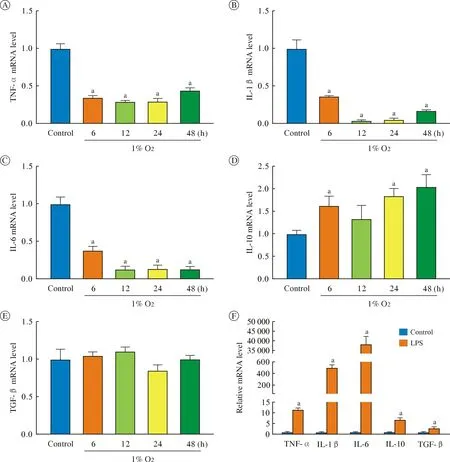
图4 不同低氧时间及LPS 处理对小胶质细胞炎症因子mRNA 水平的影响(aP<0.05,vs 对照组)A~E:TNF-α(A)、L-1β(B)、IL-6(C)、IL-10(D)和TGF-β(E) mRNA 水平;F:LPS 组炎症因子mRNA 水平Fig.4 Effect of different hypoxia time and LPS treatment on the level of inflammatory factor mRNA in microglia (aP<0.05,vs control group)A-E:TNF-α (A),IL-1β (B),IL-6 (C),IL-10 (D) and TGF-β (E) mRNA levels in BV-2 cells treated under hypoxia for different time;F:inflammatory factor mRNA levels in LPS group
5 低氧刺激增强NLRX1 蛋白表达及NLRX1 基因沉默 蛋白免疫印迹结果显示,与对照组相比,低氧各组NLRX1 蛋白表达均增强,且呈现出时间依赖性(图5A)。RT-PCR 及蛋白免疫印迹实验显示,与sh-Control组相比,sh-NLRX1组NLRX1基因mRNA 水平(图5B)及蛋白水平(图5C)均降低,实现NLRX1 表达水平下调。
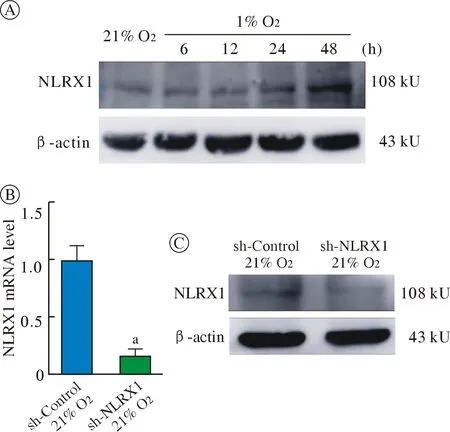
图5 不同处理时间对小胶质细胞NLRX1 蛋白表达水平的影响A:不同低氧时间NLRX1 蛋白水平;B 和C:NLRX1 基因干扰的小胶质细胞NLRX1 基因mRNA 水平(aP<0.05,vs sh-Control 组)和蛋白水平Fig.5 Effect of different treatment time on the expression level of NLRX1 protein in microgliaA:NLRX1 protein expression in BV-2 cells treated for different hypoxia time;B,C:NLRX1 mRNA level and NLRX1 protein level after NLRX1 was knocked down in microglia (aP<0.05,vs sh-Control)
6 低氧下调干扰NLRX1 的小胶质细胞IL-10 mRNA 水平 qPCR 结果显示,与sh-Control 常氧组相比,sh-Control 组低氧处理IL-1β mRNA 水平均下降(P<0.05),IL-10 mRNA 水平低氧处理6 h 和48 h 均上升,与小胶质细胞低氧处理一致;与sh-Control 组相比,sh-NLRX1 组低氧处理后IL-1β mRNA 水平在24 h 和48 h 下降(P<0.05),IL-10 mRNA 水平低氧处理后均下降(P<0.05)。见图6。
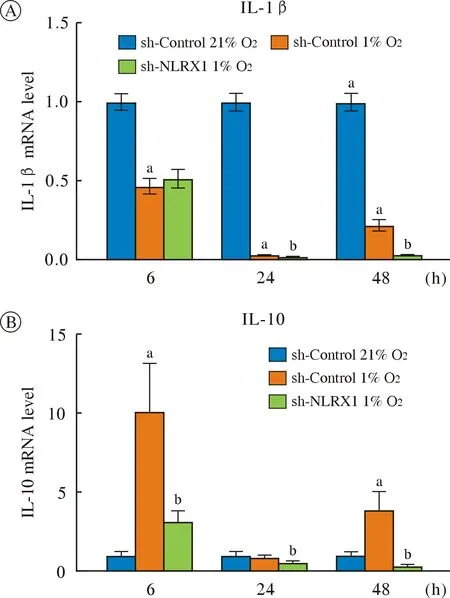
图6 低氧对NLRX1 干扰的小胶质细胞炎症因子mRNA 水平的影响A:低氧处理6 h、24 h、48 h 三组细胞IL-1β mRNA 水平(aP<0.05,vs sh-Control 21% O2;bP<0.05,vs sh-Control 1%O2);B:低氧处理6 h、24 h、48 h 三组细胞IL-10 mRNA 水平(aP<0.05,vs sh-Control 21% O2;bP<0.05,vs sh-Control 1% O2)Fig.6 Effect of hypoxia on the level of inflammatory factor mRNA in microglia interfered by NLRX1A:the level of IL-1β mRNA in the three groups of cells treated with hypoxia for 6 h,24 h and 48 h (aP<0.05,vs sh-Control 21% O2;bP<0.05,vs sh-Control 1% O2);B:the level of IL-10 mRNA in the three groups of cells treated with hypoxia for 6 h,24 h and 48 h (aP<0.05,vs sh-Control 21% O2;bP<0.05,vs sh-Control 1% O2)
讨 论
小胶质细胞不仅维持中枢神经系统的稳态,且在促进组织发育、调节细胞死亡、神经再生以及改善神经环路和连接中同样起着至关重要的作用[13]。研究表明,不同刺激可使小胶质细胞从类似“眼睛样”静息状态变为“阿米巴样”活化状态[14-16]。这与本实验中倒置相差显微镜观察的细胞形态一致。另外,本实验还观察到短时间(2 h、6 h)低氧明显增强细胞活力,继续延长缺氧时间细胞活力逐渐降低,呈现时间依赖性;这表明低氧影响小胶质细胞活力,但细胞活力降低是否影响极化的过程尚不清楚。
小胶质细胞表型的转变取决于环境的变化,但其表型动态转变机制尚不明确[17]。一方面,小胶质细胞表型的二分法被普遍接受,M1型小胶质细胞高表达CD16/CD32、CD86 等,可由脂多糖、病毒双链DNA、干扰素等诱导;M2型由IL-4或IL-13 激活,高表达 CD206、几丁质酶1/2 等[18]。另一方面,近年来小胶质细胞表型的重叠现象也被提及,有学者观察到M1型和M2型经典标志物高度共表达于同一小胶质细胞或巨噬细胞[19-20]。研究表明,小胶质细胞极化发生时间和转化分型受到刺激条件和刺激时间的影响[21-22]。本研究流式细胞术检测小胶质细胞极化分型结果显示,低氧处理后M1型小胶质细胞百分比逐渐下降,M1型和M2型混合物百分比升高;qPCR 结果示低氧使TNF-α、IL-6 和IL-1β mRNA 水平先降低后升高,但均低于常氧对照组,而IL-10 mRNA 水平均高于对照组。另有蛋白免疫印迹结果显示NLRX1 蛋白随低氧时间延长表达增强。以上结果提示低氧可上调NLRX1 蛋白水平并减少小胶质细胞M1型极化。
NLRX1 在许多方面发挥着重要的作用,如促进ROS 产生、线粒体损伤、细胞凋亡、细胞自噬及调节免疫应答等[23]。越来越多的证据表明,NLRX1 通过抑制凋亡及炎症反应从而保护软骨细胞、神经细胞及心肌等[24-26]。为进一步证明NLRX1 参与小胶质细胞极化,本实验干扰NLRX1表达并给予低氧处理,结果显示IL-10 mRNA 水平均下降,IL-1β 在低氧6 h 时升高,24 h 和48 h 时降低;提示NLRX1 可能通过调节抗炎因子IL-10 mRNA 的水平减少小胶质细胞向M1型极化。
综上所述,本研究结果表明低氧可刺激小胶质细胞极化,表现为M1型小胶质细胞减少,M1 和M2 混合型小胶质细胞增多;低氧刺激NLRX1 蛋白表达增强,其可能通过调节抗炎因子的水平减少低氧条件下小胶质细胞M1型极化,但其在低氧情况下调控极化的分子机制还需进一步探索。
致谢:感谢侯静、田美媛、李建华及张涛对本实验的技术支持。
利益冲突:所有作者均声明不存在利益冲突。

