国产猪小肠黏膜下层脱细胞基质用于兔硬脑膜修复的效果及安全性
孙立旦,杨飞霞,张 迪,陈泽良,张志慧,李英俊,史利军
(1.沈阳农业大学动物科学与医学学院,沈阳 110866;2.北京通和立泰生物科技有限公司,北京 102609;3.中国农业科学院北京畜牧兽医研究所,北京 100193)
猪小肠黏膜下层脱细胞基质补片是采用猪小肠黏膜下层组织为原料,经过病毒灭活、脱细胞、成型、冻干等工艺制备的天然衍生生物材料,是一种非交联型动物源性细胞外基质材料[1]。大量临床和基础研究显示,小肠黏膜下层含有胶原蛋白、弹性蛋白、黏多糖、蛋白多糖和生长因子,在损伤愈合中起着重要作用,可显著治愈难以愈合或慢性伤口[2]。小肠黏膜下层脱细胞基质材料具有天然特有的细胞外基质结构和组成,能够主动诱导组织再生,并具有良好的生物相容性、生物力学强度和低免疫原性,在体内可完全降解,有良好的抗感染能力,可用于多种软组织缺损的修复。
目前,非交联型小肠黏膜下层脱细胞基质补片材料产品已广泛用于烧伤、慢性伤口、肛瘘、腹壁疝修复、硬脑膜修复等临床领域[3],但是脱细胞不彻底会造成免疫排斥反应的发生,不同厂家生产的补片在工艺和材料成分上存在一定差异,故需要通过动物试验来验证和评价。本研究采用新西兰白兔模型,通过前瞻性随机对照动物实验评价国产猪小肠黏膜下层脱细胞基质材料在硬脑膜修复中的安全性和有效性。
1 材料与方法
1.1 材料
1.1.1 实验动物
48只普通级新西兰白兔,体质量(2.5±0.25)kg,购自北京隆安实验动物养殖中心[SCXK(京)2019-0006]。动物饲养于北京通和立泰生物科技有限公司[SYXK(京)2019-0016],用标准化兔笼单笼饲养,每只每天分两次饲喂其体质量5%的饲料(北京科奥协力饲料有限公司生产),自由饮水。所有动物实验操作均符合北京通和立泰生物科技有限公司动物实验伦理审查委员会审批要求(IACUC 2019021)。
1.1.2 主要材料与试剂
供试品名称为脱细胞猪小肠黏膜下层基质(供试品号为AN2019021),为北京博辉瑞进生物科技有限公司赠送,批号为20181202,规格为7 cm×10 cm。对照品名称为生物硬脑膜修补片购自美国Cook Biotech Incorporated公司,批号为LB838536,规格为4 cm×7 cm。3%戊巴比妥钠购自美国Sigma公司(批号P3761,规格25 g,CAS编号57-33-0);陆眠宁Ⅱ购自吉林省华牧动物保健品有限公司(批号P20150402);氯化钾购自黑龙江省北安市飞龙动物药厂(批号20181208);氨苄西林(批号180701)、庆大霉素(批号180605)和青霉素(批号180401)均购自华北制药集团动物保健品有限责任公司;苏木精染液(批号ZL-I9610)购自北京中衫金桥生物技术有限公司,伊红染液(水溶)(批号71014544)购自中国国药集团有限公司。
1.2 方法
1.2.1 动物分组与研究节点
48只新西兰白兔,随机分成2组,每组24只,分设供试品(脱细胞猪小肠黏膜下层基质)试验组和对照品(生物硬脑膜修补片)对照组。分组后每只动物指定一个单一的动物号,动物及笼卡上标明动物号;并且用不同颜色笼卡进行组别区分,并注明实验编号、供试品名称、剂量、组别、性别、动物数等指标。研究设4个时间节点,分别为植入术后7 d、30 d、60 d、90 d,每组每个时间点6只动物。
1.2.2 动物术前麻醉
动物术前12 h禁食但不禁水。动物称体质量后,先用3%戊巴比妥钠以0.5 mL∕kg剂量静脉注射,进行诱导麻醉。3 min后静脉注射陆眠宁Ⅱ,剂量为0.1 mL∕kg。手术过程中视动物麻醉深度,多次追加首次剂量1∕4的陆眠宁Ⅱ。术前于心脏采血2 mL,用于血细胞五分类分析(仪器购自深圳市普康电子有限公司,PE7600)和血清生化分析(仪器购自珠海森龙生物科技有限公司,SL300B)。术前一次性肌内注射氨苄西林2×105U和庆大霉素4×104U以抗感染。
1.2.3 补片植入
实验方法参照文献[4-7],并根据临床实际情况制定。兔头固定于头架上,严格执行备皮消毒等无菌准备后,于颅顶正中处取纵行切口,长约5 cm。依次切开皮肤及皮下组织,钳夹止血;用无菌记号笔在颅顶正中画一切口约2 cm的正方形;然后用超声骨刀沿切口外缘切开颅骨,尽可能保留颅骨完整;取下颅骨骨窗,充分暴露硬脑膜;用脑膜剪在骨窗内剪出1.0 cm×1.0 cm大小的圆形硬脑膜缺损,操作时切勿损伤脑组织。将试验组或对照组硬脑膜补片修剪为相应形状,贴附于脑表面,硬脑膜补片与缺损处边缘重叠约0.3 cm,用医用组织胶(购自北京康派特医疗器械有限公司)固定。植入完成后将颅骨骨窗放回原位固定,缝合皮肤及皮下组织,纱布包扎伤口。手术结束后普通饮食饲养,未给予止痛药物;术后1~3 d,肌内注射青霉素20×105U∕次,1次∕d,以抗感染。
1.2.4 术后动物情况观察
植入术后,观察动物基本情况,包括手术期死亡情况、伤口感染(手术部位有无脓肿,伤口愈合是否良好)、运动障碍(四肢行为是否正常,动作是否迟缓,是否有瘫痪)、精神异常(是否消瘦、呆立)、脑脊液渗漏(脑脊液有无渗出)。
1.2.5 血液学及血清生化指标检测
术前及术后7 d、30 d、60 d、90 d(安乐死之前),分别采集两组兔的耳静脉血,用全自动血细胞分析仪和全自动生化分析仪分别进行血细胞五分类分析和血清生化检测。
1.2.6 术后安乐死及大体解剖
术后分别在7 d、30 d、60 d、90 d时对2组动物各6只进行安乐死:按动物体质量,先肌内注射剂量为3 mg∕kg的速眠新,再耳缘静脉注射剂量为0.4 mL∕kg的10%氯化钾溶液。然后解剖手术部位:用超声骨刀沿手术部位外缘切开,取颅骨、硬脑膜和脑组织为一体的长约3 cm的正方形标本;获得标本后,观察标本横切面大体外观,包括手术部位创面愈合情况、补片降解情况、与脑组织粘连情况、是否发生脑水肿、是否发生脑出血、植入后补片位置稳定性、植入物吸收并被新生组织替代和组织长入情况等。
1.2.7 组织病理学观察
获取的颅骨、硬脑膜和脑组织标本通过苏木精-伊红染色,光学显微镜下观察比较两组的手术周围组织反应情况,评价内容包括粘连情况、纤维增生情况、血管密度和材料降解情况等。
1.2.8 统计学分析
2 结果
2.1 术后动物基本情况
实验期内2组动物均无意外死亡。供试品试验组未见切口感染;对照品对照组有1例发生切口感染,经换药治疗后转归。剩余动物均于术后1~3 d恢复正常采食和饮水。两组均未发生运动障碍、癫痫、脑脊液渗漏、精神异常及发热等现象。
2.2 术后局部愈合情况
术后7 d,试验组和对照组动物头皮均愈合良好,无脓肿、无皮下积液。解剖后发现:两组动物植入的硬脑膜补片均与周边硬脑膜形态连续,能完整封闭硬脑膜缺损,无脑脊液漏出,可辨认出补片边界;补片与脑组织可分离,与大脑表面无粘连;脑组织局部均无受压、充血和水肿,局部无脓肿及渗出(图1A1、1A2)。
术后30 d,两组动物解剖可见颅骨瓣与头骨之间的缝隙已经被纤维瘢痕组织所替代,两组补片均出现部分降解,与周边硬脑膜融合长入,补片与大脑表面均无粘连;各脑隙均无积液(图1B1、1B2)。
术后60 d,两组补片均大部分降解,补片边缘与周边硬脑膜不能辨别,创面无粘连;硬脑膜下各脑隙未见异常(图1C1、1C2)。
术后90 d,两组硬脑膜及脑组织的解剖形态已完全修复,均未发现明显异常(图1D1、1D2)。

图1 不同时间点的兔硬脑膜修复情况Figure 1 Rabbit dura mater repair process at the indicated time points
2.3 血液学指标
试验组和对照组相比,术前及术后7 d、30 d、60 d和90 d的白细胞、淋巴细胞、红细胞、血红蛋白和血小板数量差异均无统计学意义(P>0.05)(表1)。
表1 两组兔不同时间点血液学常规指标比较Table 1 Routine blood parameters in the two groups of rabbits at the indicated time point(±s,n=6)
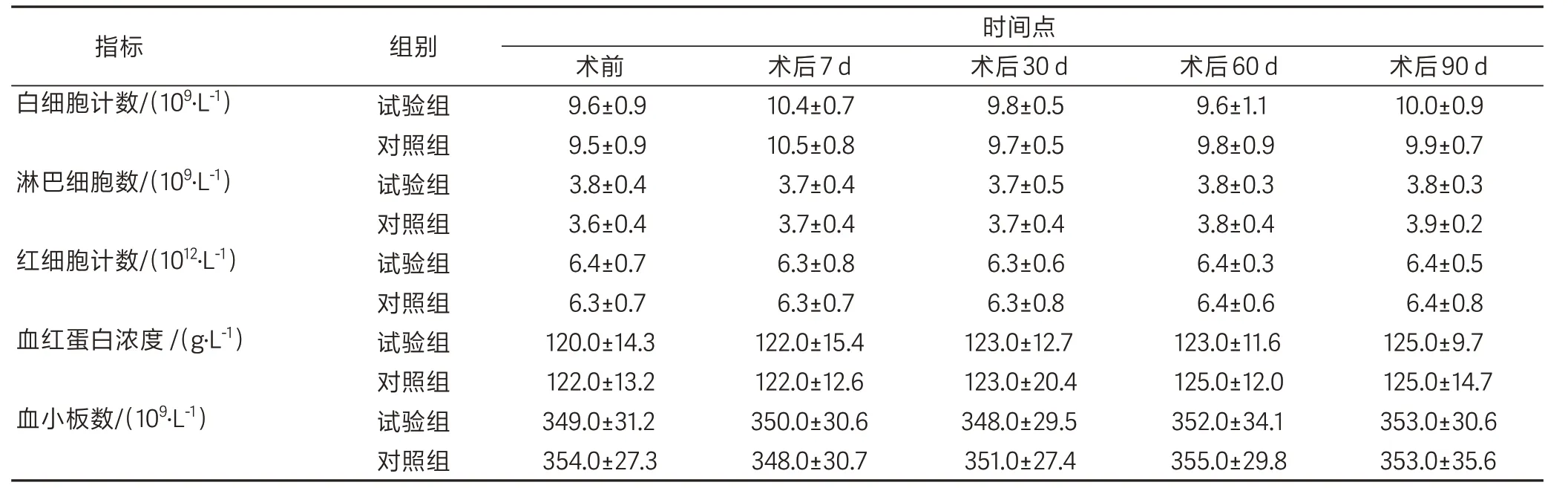
表1 两组兔不同时间点血液学常规指标比较Table 1 Routine blood parameters in the two groups of rabbits at the indicated time point(±s,n=6)
注:试验组植入供试品(国产的脱细胞猪小肠黏膜下层基质材料),对照组植入对照品(购自美国Cook Biotech Incorporated公司的生物硬脑膜修补片)。各时间点两组间比较均P〉0.05。
指标白细胞计数/(109·L-1)淋巴细胞数/(109·L-1)红细胞计数/(1012·L-1)血红蛋白浓度/(g·L-1)血小板数/(109·L-1)组别试验组对照组试验组对照组试验组对照组试验组对照组试验组对照组时间点术前9.6±0.9 9.5±0.9 3.8±0.4 3.6±0.4 6.4±0.7 6.3±0.7 120.0±14.3 122.0±13.2 349.0±31.2 354.0±27.3术后7 d 10.4±0.7 10.5±0.8 3.7±0.4 3.7±0.4 6.3±0.8 6.3±0.7 122.0±15.4 122.0±12.6 350.0±30.6 348.0±30.7术后30 d 9.8±0.5 9.7±0.5 3.7±0.5 3.7±0.4 6.3±0.6 6.3±0.8 123.0±12.7 123.0±20.4 348.0±29.5 351.0±27.4术后60 d 9.6±1.1 9.8±0.9 3.8±0.3 3.8±0.4 6.4±0.3 6.4±0.6 123.0±11.6 125.0±12.0 352.0±34.1 355.0±29.8术后90 d 10.0±0.9 9.9±0.7 3.8±0.3 3.9±0.2 6.4±0.5 6.4±0.8 125.0±9.7 125.0±14.7 353.0±30.6 353.0±35.6
2.4 血液生化指标
试验组和对照组相比,在术前、术后7 d、术后30 d、术后60 d和术后90 d的谷丙转氨酶、碱性磷酸酶、γ-谷氨酰基转移酶、血清球蛋白、血清白蛋白、尿素氮和肌酸激酶含量差异均无统计学意义(P>0.05)(表2)。
表2 两组兔不同时间点的血液生化指标Table 2 Blood biochemical indicators in the two groups of rabbits at the indicated time points(±s,n=6)

表2 两组兔不同时间点的血液生化指标Table 2 Blood biochemical indicators in the two groups of rabbits at the indicated time points(±s,n=6)
注:试验组植入供试品(国产的脱细胞猪小肠黏膜下层基质材料),对照组植入对照品(购自美国Cook Biotech Incorporated公司的生物硬脑膜修补片)。各时间点两组间比较均P〉0.05。
生化指标谷丙转氨酶ρ/(U·L-1)碱性磷酸酶ρ/(U·L-1)γ-谷氨酰基转移酶ρ/(U·L-1)血清白蛋白c/(g·L-1)血清球蛋白c/(g·L-1)尿素氮c/(mmol·L-1)肌酸激酶ρ/(U·L-1)组别试验组对照组试验组对照组试验组对照组试验组对照组试验组对照组试验组对照组试验组对照组时间点术前41.7±5.9 42.0±5.8 68.2±4.3 68.1±3.8 3.8±0.6 3.8±0.6 40.6±5.8 40.6±3.8 30.1±2.5 30.0±2.1 13.2±1.2 13.2±1.3 146.0±11.4 146.0±15.2术后7 d 41.7±2.7 41.9±4.2 68.8±4.0 69.0±4.2 69.2±3.2 3.8±0.3 40.8±4.4 40.7±3.8 30.1±1.8 30.3±1.6 13.2±0.9 13.2±1.5 145.0±11.2 144.0±11.3术后30 d 41.9±2.6 41.9±3.4 68.8±3.8 69.2±3.2 69.5±3.9 3.8±0.7 40.9±2.3 40.9±4.3 30.4±1.3 30.2±2.1 13.2±1.3 13.3±1.1 145.0±11.5 145.0±11.5术后60 d 41.7±3.0 41.7±3.9 69.3±3.4 69.5±3.9 69.7±3.5 3.8±0.9 40.6±4.4 40.8±6.1 30.2±2.6 30.1±3.1 13.2±1.0 13.2±1.0 145.0±9.6 144.0±11.7术后90 d 41.8±2.9 41.9±3.5 69.7±3.5 69.7±3.5 6.4±0.5 3.9±0.4 41.0±2.6 40.9±3.5 30.4±2.7 30.5±2.4 13.3±1.0 13.3±1.3 145.0±15.3 145.0±11.6
2.5 病理组织学检测
术后7 d,试验组和对照组兔脑组织在光学显微镜下尚可辨认出补片边缘,补片内部可见淋巴细胞和单核细胞浸润,表现出轻微的炎性反应;脑室区和脑实质内组织结构正常,均未见明显炎性细胞浸润,与补片均未见明显粘连;补片表层可见成纤维细胞增生,并可观察到新生血管(图2A1、2A2)。
术后30 d,试验组和对照组兔脑组织在镜下均不能辨认出补片边缘,补片与硬脑膜组织完全融合,偶见淋巴细胞,补片内部结构松散,可见纤维碎片,提示补片已被宿主细胞降解;“碎片”之间可见较多成纤维细胞,也可见新生血管;补片内侧面可见内皮细胞覆盖,局部脑组织正常,蛛网膜正常(图2B1、2B2)。
术后60 d,试验组和对照组补片内部均未见炎性细胞,补片内部成纤维细胞密度增高,新生胶原纤维排列规则,新生血管密度增加,未见明显瘢痕组织;硬膜内侧面内皮细胞密度增高,排列规则(图2C1、2C2)。
术后90 d,试验组和对照组硬膜内侧面均可观察到完整内皮,补片均完全降解,可观察到厚壁成熟血管,胶原纤维排列规则,蛛网膜边界清晰,脑实质结构正常(图2D1、2D2)。

图2 两组术后各时间点兔脑植入部位的HE染色组织学变化(×100)Figure 2 Histological changes in the implant region of rabbit brain following hematoxylin-eosin staining at the indicated time points after surgery(×100)
3 讨论
小肠黏膜下层基质是无细胞的来源于猪小肠的一种基质材料,可以为新生细胞和血管的生长提供附着和支撑功能[8]。研究表明,小肠黏膜下层基质材料在与宿主作用后可逐渐成为宿主组织的一部分[9]。本研究中采用的是具有自主知识产权的非交联型猪小肠黏膜下层脱细胞基质材料,该材料具有良好的生物相容性,DNA残留量和α-半乳糖基抗原(α-Gal抗原)残留低,并具有良好的力学性能。
研究结果显示,试验样品能够主动诱导成纤维细胞增生、分化,促进新生血管生成,形成排列规则、致密的纤维层,并诱导内皮细胞增殖,形成完整的内皮层,不影响蛛网膜下腔的完整性,在植入90 d时实现了硬脑膜的结构和功能修复。在上述修复过程中,国产试验样品与国外对照样品的效果之间无明显差异。组织病理学结果显示,两组样品植入后7 d可观察到补片内部存在炎性细胞浸润,以淋巴细胞为主,补片周围组织无明显炎性反应表现,植入后30 d炎性细胞浸润基本消失。
本研究表明,植入初期的炎性细胞浸润可趋化成纤维细胞、血管内皮细胞长入,并与材料降解密切相关。血常规及血液生化检测结果显示,植入后3 d出现轻度炎性反应,术后1周即明显减轻,考虑与手术创伤应激有关。小肠黏膜下层基质植入体内可能会引起以Th2淋巴细胞增加为主的一过性免疫反应,Th2淋巴细胞不激活巨噬细胞,产生的IgG不引起补体反应,因此不会引起显著免疫排斥反应[10]。本研究中HE染色病理组织学检测结果显示:两组样品植入后7 d即出现成纤维细胞增生,并可观察到补片纤维碎片,提示在植入早期即同时启动了降解过程和修复过程;植入后30 d,可观察到规则致密的纤维层和松散的补片纤维同时存在;术后90 d时可观察到补片完全降解,代之以完整连续的硬膜结构。总之,通过本研究试验结果可以证明,国产的猪小肠黏膜下层脱细胞基质材料是一种促进硬脑膜损伤愈合的理想补片材料,使用局部愈合良好,无红肿、渗出等炎性反应的发生,生物相容性良好,可逐渐降解,动物试验证明安全、有效,未来有望用于国内硬脑膜缺损的治疗。
[作者贡献]
孙立旦:设计实验,实施研究,采集并分析数据,撰写文章;
杨飞霞:实施研究,采集并分析数据,文章内容补充与整理;
张迪:实施研究,采集数据;
陈泽良:实验指导,技术支持;
张志慧:实施研究,数据统计分析;
李英俊:实验设计及指导;
史利军:实验指导,经费获取。
[利益声明]所有作者均声明本文不存在利益冲突。?

