运动疲劳状态下大鼠脑皮层单羧酸转运蛋白表达的变化及意义
高 晨,王 菀,李玉荣,裴文娟
(联勤保障部队第九四〇医院全科医学科,兰州 730050)
疲劳发生在外周肌肉和中枢神经两个部位,决定后者的关键因素是脑能量代谢失衡,从而难以维持中枢神经系统持续向外周发放神经冲动[1],其机制与运动缺氧导致静息状态下脑电活动减弱并反馈性抑制中枢神经系统和脊髓前角α运动神经元活动有关[2-4]。研究表明,极量运动或缺氧状态下,无氧代谢所产生的乳酸能够被大脑摄取并作为能量底物为神经元供能[5],且乳酸优先于葡萄糖被神经元利用氧化供能[6]。这一机制在剧烈活动时对于维持突触传递具有重要作用。然而,另有研究表明,缺血缺氧或脑损伤后乳酸堆积却通过降低pH值而引发一系列病理反应,从而损伤神经元[7-8]。机体乳酸代谢转运的载体是广泛分布于组织细胞膜上的单羧酸转运蛋白(monocarboxylate transporters,MCTs),其可分为14种亚型[9]。其中,MCT1主要在微血管内皮细胞、室管膜细胞、星形胶质细胞和少突胶质细胞中表达,MCT2主要在神经元中表达,而MCT4几乎只在星形胶质细胞中表达[10]。研究证实,血乳酸难以通过血脑屏障,星形胶质细胞是脑乳酸的主要来源[11]。广泛表达于星形胶质细胞和神经元的MCT1、MCT2和MCT4在中枢乳酸的产生和利用中起到至关重要的作用[12-13]。据此推测,运动疲劳过程中,正是由于MCTs的存在,脑乳酸在氧化供能和脑损伤之间维系了一种平衡状态。目前关于运动疲劳状态下脑内MCTs表达的变化尚无明确结论。本研究通过检测运动疲劳模型动物的运动力竭时间变化以及大脑皮层运动区MCT1、MCT2和MCT4的表达,初步探讨运动耐力变化与脑乳酸代谢转运之间的相关性,为运动疲劳的医学干预奠定理论基础。
1 材料与方法
1.1 实验动物及分组
8周龄清洁级雄性SD大鼠42只,体质量(280±10)g,由联勤保障部队第九四〇医院动物实验科提供[SCXK(军)2017-0023]。大鼠常规分笼饲养于屏障设施[SYXK(军)2017-0047],正常饮水、饮食。环境温度维持在18~24℃,相对湿度40%~60%。动物实验经联勤保障部队第九四〇医院伦理委员会审核同意(编号2020KYLL032)。大鼠随机分为7组,每组6只。对照组(Control)正常饲养,不运动;其余6组为疲劳1~6组(Fatigue 1-6)分别进行力竭运动1、3、5、7、9、14 d,以达到运动疲劳状态。
1.2 实验设备及试剂
ZH-PT型动物跑台为安徽淮北正华生物仪器设备有限公司产品。MCT1(货号PAB16059)和MCT4(货号PAB21410)多克隆抗体均购自亚诺法(Abnova)生技股份有限公司,MCT2(货号SC-50323)购自美国Santa公司,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(货号3670)单克隆抗体购自美国Cell Signaling Technology公司,神经元核抗原(neuronal nuclei antigen,NeuN)(货号MAB377)单克隆抗体购自美国Millipore公司。荧光单克隆抗体购自北京康为世纪生物科技有限公司。荧光显微镜(型号AX80)购自日本Olympus株式会社。
1.3 运动疲劳模型建立
采用Bedford等[14]的递增负荷运动方案建立大鼠运动疲劳模型。疲劳组大鼠先行在动物跑台上进行3 d适应性训练(速度为15 m∕min,时间为5 min∕d,坡度0°),之后分别进行为期1、3、5、7、9和14 d的递增负荷运动(速度为8.2 m∕min×15 min+15 m∕min×15 min+20 m∕min持续,直至力竭,1次∕日)。力竭标准:大鼠跑步姿态由蹬地式变为伏地式,滞留跑道后1∕3处达3次以上,各种刺激驱赶无效,且停跑后表现为呼吸急促、神情倦怠、反应迟钝[15]。分别记录各组大鼠负荷运动最后1 d达到力竭状态的运动时间,取平均值。
1.4 蛋白质印迹检测
不同时间疲劳模型建立后,各组分别取3只大鼠在异氟烷麻醉下断头处死。完整取出脑组织,嗅球至小脑蚓部前后冠状均分为5等份,第2和3等份最表层主要为运动区皮层。取运动区皮层组织,匀浆后裂解,提取总蛋白,BCA法测定浓度。然后行聚丙烯酰胺凝胶电泳,每孔上样蛋白总量为20μg,电泳时间约120 min。电泳结束后以350 mA恒流带电转膜(120 min),5%牛血清白蛋白室温振荡封闭1 h。5%脱脂奶粉稀释后,分别加入一抗(包括MCT1、MCT2、MCT4和αtubulin抗体,体积稀释比例分别为1∶500、1∶1 000、1∶500和1∶1 000),4℃孵育过夜;加入辣根过氧化物酶标记的二抗(体积稀释比例为1∶5 000),在室温下振荡孵育2 h[16]。滴加发光检测液,在凝胶成像系统中拍照,并采用Image J软件进行灰度量化分析。实验重复3次,取平均值。
1.5 大鼠脑切片制备及免疫荧光检测
各组剩余3只大鼠在异氟烷麻醉下经心脏灌流处死,断头完整取出脑组织。用质量分数4%的多聚甲醛溶液固定24 h,蔗糖PB溶液阶梯脱水48 h,包埋后自嗅球到小脑蚓部前后5等份连续冠状位冰冻切片(厚度25μm)。取第2和3等份切片进行免疫荧光双标法检测。
鼠脑切片用1%牛血清蛋白+0.3%Triton X-100在室温下封阻非特异性结合,并破膜1 h。PBS清洗后,加入一抗MCT1(1∶200)+GFAP(1∶500)、MCT2(1∶500)+NeuN(1∶500),或MCT4(1∶200)+GFAP(1∶500)稀释液,4℃缓慢振荡孵育过夜。PBS清洗后,加入1∶100稀释的荧光二抗异硫氰酸荧光素和异硫氰酸罗丹明,室温下缓慢振荡孵育2 h。PBS清洗后,加入1∶2 000稀释的DAPI,室温下避光孵育10 min。PBS清洗后,鼠脑切片转移至载玻片上,60%甘油PBS封固,荧光显微镜下观察并进行皮层定位图像采集。FITC激发∕发射波长为480 nm∕535 nm,TRITC激发∕发射波长为535 nm∕610 nm。用Images J软件进行图像分析。
1.6 统计学方法
采用SPSS 13.0统计软件包对本研究数据进行分析。计量资料采用±s表示。不同组样本均数间比较采用单因素方差分析,并根据各组总体方差齐同与否,选择Bonferroni法或Tamhane's T2法修正结果,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠力竭运动时间变化情况
如表1所示,疲劳1组大鼠平均运动力竭时间为(120.17±11.18)min。运动5 d后疲劳3组的平均运动力竭时间达到最短,为(67.00±7.07)min。此后,大鼠运动能力逐渐恢复,运动14 d后疲劳6组力竭时间恢复至(91.17±11.43)min。与疲劳1组相比,各组大鼠的平均运动力竭时间均明显缩短,差异均有统计学意义(P<0.05)。与力竭时间最短的疲劳3组相比,疲劳5组和疲劳6组的大鼠力竭时间明显延长,表明其运动能力的恢复具有统计学意义(P<0.05)。
表1 各疲劳组大鼠平均力竭时间对比Table 1 The exhaustive time of rats in fatigue groups(±s,n=6)

表1 各疲劳组大鼠平均力竭时间对比Table 1 The exhaustive time of rats in fatigue groups(±s,n=6)
注:Fatigue 1-6分别为疲劳1~6组。与Fatigue 1组比较,*P<0.05;与Fatigue 3组比较,#P<0.05;与Fatigue 5组比较,△P<0.05。单因素方差分析采信Tamhane’s T2修正值。
组别Fatigue 1 Fatigue 2 Fatigue 3 Fatigue 4 Fatigue 5 Fatigue 6递增负荷运动天数/d 135791 4平均运动力竭时间/min 120.17±11.18#△81.17±10.57*67.00±7.07*△75.67±4.97*89.17±9.45*#91.17±11.43*#
2 .2大鼠脑运动区皮层MCT1、MCT2及MCT4表达变化情况
用蛋白质印迹法检测各组大鼠运动区皮层MCT1、MCT2及MCT4表达的变化情况。如图1所示,Control组大鼠运动区皮层MCT1、MCT2及MCT4均少量正常表达。疲劳负荷运动5 d后,Fatigue 3组鼠脑运动区皮层中MCT2表达较Control组明显升高74.2%。疲劳负荷运动7 d后,Fatigue 4组鼠脑运动区皮层中MCT1和MCT4表达较Control组分别明显升高约89.5%和92.0%,差异均有统计学意义(P<0.05)。此后,Fatigue 5组和6组鼠脑运动区皮层中MCT1、MCT2和MCT4均维持高表达,与Control组相比差异均有统计学意义(P<0.05)。

图1 蛋白质印迹法检测各组大鼠脑运动区皮层中MCT1、MCT2和MCT4表达比较Figure1ExpressionofMCT1,MCT2andMCT4incerebralmotorcortexofratsindifferentgroupsdetectedby Westernblotting
进 一 步 分 别 利 用MCT1∕GFAP、MCT2∕NeuN或MCT4∕GFAP免疫荧光双标技术对比检测鼠脑运动区皮层胶质细胞中MCT1、MCT2和MCT4的表达变化情况。如图2所示,与Control组相比,疲劳负荷运动7 d后鼠脑运动区皮层胶质细胞中MCT1与MCT4表达均明显升高并维持稳定;MCT2的表达也呈现出逐渐增高的趋势,疲劳负荷运动5 d即维持于高表达状态。荧光检测结果与蛋白质印迹检测结果相一致。
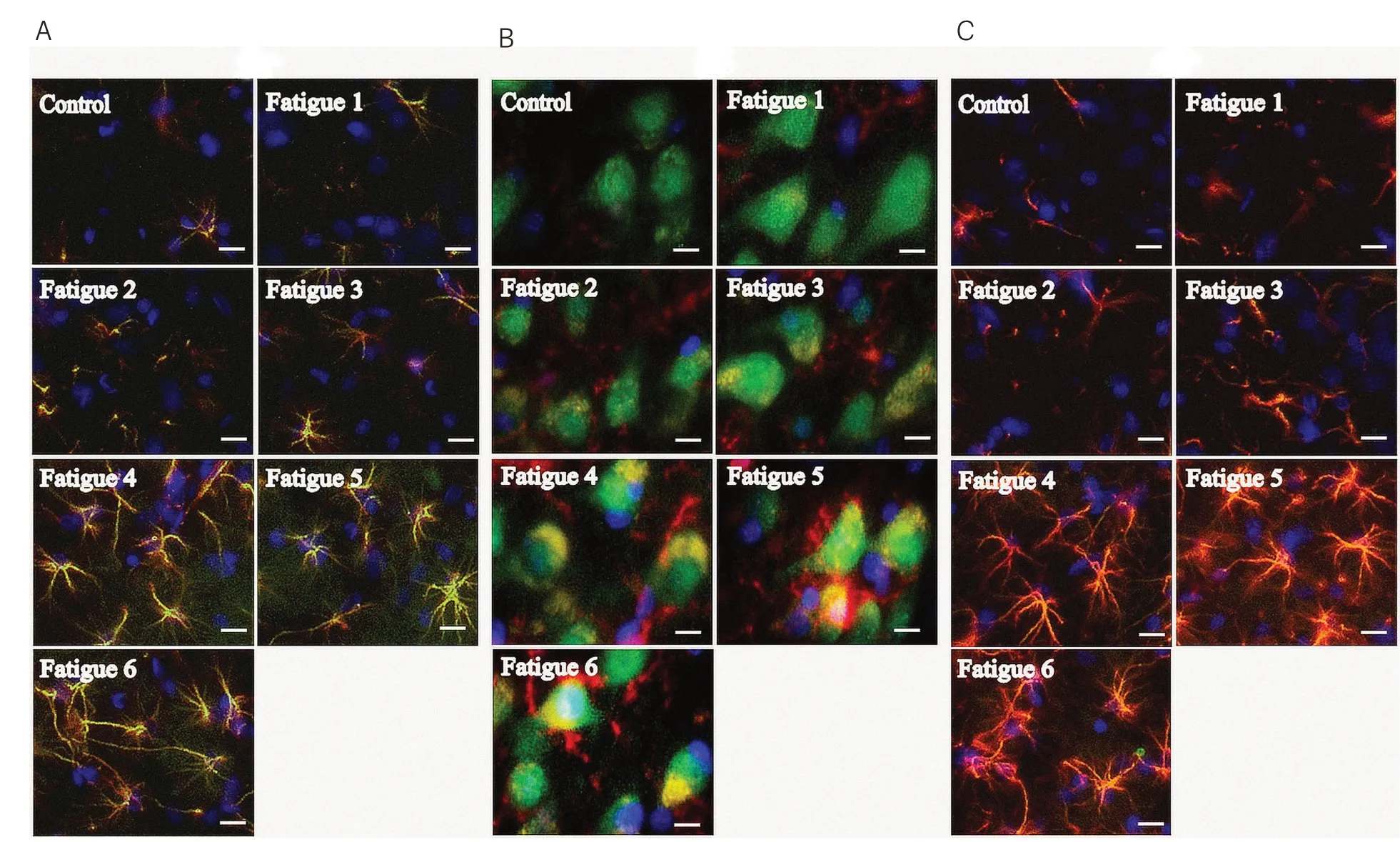
图2 免疫荧光法检测各组大鼠脑运动区皮层MCT1、MCT2和MCT4表达(×400)Figure2ExpressionofMCT1,MCT2andMCT4incerebralmotorcortexofratsindifferentgroupsdetectedby imunofluorescence(×400)
结果提示每日疲劳负荷运动后,大鼠运动能力迅速下降,在运动5 d后达到最低点。此后继续运动,大鼠脑内MCTs表达水平逐渐升高,脑乳酸转运及代谢被激活,大鼠运动能力在一定程度上恢复。这种由重复运动诱导的对运动疲劳的适应性,在运动1周后维持于相对平稳的状态。
3 讨论
乳酸(C3H6O3)是糖代谢过程的中间产物。与通常情况下机体对葡萄糖的有氧氧化过程不同,乳酸的产生来源于无氧状态下的糖酵解过程。虽然无氧糖酵解过程的能量供应效率低于糖的有氧氧化,但对于剧烈运动状态下的能量代谢维持至关重要。通常,运动过程中,肌肉是产生乳酸最多的部位[17]。大强度运动时,糖酵解生成的乳酸使细胞内H+浓度上升,pH值降低。机体对乳酸的代谢起始于细胞间乳酸的穿梭,而后进一步通过糖异生等途径供应能量。乳酸的穿梭过程依赖于MCTs。研究表明,运动强度的变化是MCTs含量改变的重要因素。拥有14种亚型的MCTs分布于不同的组织细胞膜表面,其中MCT1、MCT2和MCT4对运动状态下的乳酸转运至关重要[13]。由于乳酸穿过细胞膜进行转运是一个主动耗能的过程,因此较大强度的耐力运动后细胞膜上与MCTs共同起到协同转运作用的钠氢交换蛋白(sodium hydrogen exchanger 1,NHE1)的表达亦相应升高,从而利用Na+∕H+ATP酶产生的化学梯度能量完成整个转运过程,同时维持细胞内外pH值的相对稳定。研究表明,这种协同转运是乳酸与H+以1∶1的等摩尔方式相偶联的同向转运,其中NHE1和MCTs对细胞内外pH调节至关重要,特别是在代谢活跃的状态下。从这一意义上来讲,MCTs在机体乳酸循环、能量代谢以及内环境pH值的调节方面发挥着重要作用[18-19]。外周肌肉组织中,MCT1主要存在于氧化型慢肌细胞膜和细胞内部,调控乳酸的摄取与内流。MCT4主要在酵解型快肌中高表达,调控乳酸的排出与外流[20]。而携带MCT2的细胞表现出强烈的乳酸消耗倾向,这与该亚型在诸如神经元这类氧化高度活跃的细胞中高表达相一致[21]。因此,MCT1、MCT2和MCT4在不同细胞间对乳酸转运作用各有侧重,才得以协同完成乳酸穿梭的整个过程。Eydoux等[22]研究显示,短时间低强度运动对外周横纹肌中MCT1、MCT2和MCT4表达的影响不甚明显,而大强度力竭运动后三者的表达水平均明显升高。本研究则针对运动后中枢神经系统中MCTs表达的变化趋势进行了针对性探究。
乳酸在脑内的代谢与外周有所不同。实验表明,体外灌流乳酸钠使血液中乳酸浓度显著升高,但颈内静脉中乳酸浓度变化不大,表明血乳酸变化对脑乳酸变化影响较小,提示血脑屏障的存在使得外周乳酸很难进入脑中。脑内胞外乳酸是独立于血乳酸而存在的[8,11]。1998年,Pellerin等[11]研究发现神经元与神经胶质细胞间的乳酸存在一种特殊的分配状态,即脑内乳酸来源于星形胶质细胞,而神经元则成为吸收和利用乳酸的部位。其后,有关脑内乳酸作用的研究结果不尽相同。Chih等[23]综合了Pellerin等[24]、Wada等[25]和Takata等[26]的研究结果,提出葡萄糖仍然是神经胶质细胞和神经元的主要能量底物,但在低血糖等特殊情况下,或由于脑神经的多样性,机体中某些神经细胞也可能利用乳酸暂时供能。运动状态下,脑能量供应的特殊情况正符合上述研究结论。目前学术界公认的是,乳酸由神经胶质细胞无氧糖酵解葡萄糖产生,作为能量底物为神经元供能,尤其在剧烈活动时对维持突触传递具有重要作用。特别是在无氧或有氧条件下,哺乳动物中枢神经系统中兴奋性神经元优先利用胞外的乳酸,而不是葡萄糖,作为主要的能量底物[8,27]。以上研究多基于代谢水平的生物化学检测得出结论,而对于乳酸代谢转运主要媒介MCTs在分子水平的变化情况,尚缺乏系统的研究。因此,本研究重点关注了MCTs在剧烈运动的特殊条件下脑内表达的变化情况。研究结果表明,大鼠运动能力在疲劳负荷初期下降较为明显,此时MCTs表达变化不明显;随着运动时间延长,1周左右后大鼠运动能力逐渐恢复,相应地,鼠脑内运动区皮层MCT1、MCT2和MCT4的表达也在相应时间段内呈现出逐渐升高的趋势。相对于MCT1和MCT4,皮层运动神经元表达的MCT2在负荷运动后升高较早且趋势平缓;这就表明疲劳负荷运动后,鼠脑内乳酸排出与摄取利用的整个链路均表现出适应运动疲劳的积极变化。上述变化趋势正是对代谢水平乳酸生化检测结论的有力印证。同时,本研究结果也提示脑内MCTs的表达变化与大鼠对运动疲劳的适应性存在某种关联性,这种适应性在疲劳负荷运动1周后维持于相对平稳的状态。综合前述的相关研究,笔者认为脑内MCTs表达变化所代表的脑乳酸代谢调控可能是机体对运动疲劳(尤其是中枢性运动疲劳)产生适应性的机制之一。
当然,疲劳产生的原因是多方面的,外周肌肉及中枢神经系统都参与其中。仅就中枢疲劳而言,兴奋性与抑制性氨基酸平衡状态,脑内多巴胺能神经元、5-羟色胺等抑制性神经递质以及支链氨基酸等因素近年来均有相关研究[28]。本研究仅对运动疲劳状态下脑内MCTs变化进行了初步探索,进一步的研究将着重于MCTs分子表达水平干预后,运动疲劳电生理及动物行为学的变化,以期为相关研究结果提供进一步佐证。
[作者贡献]
高晨:负责实验总体设计,数据统计及课题论文撰写;
王菀:负责标准化大鼠运动疲劳模型构建及运动能力检测;
李玉荣:负责标鼠脑皮层蛋白提取及蛋白质印迹检测;
裴文娟:负责鼠脑切片制备及免疫荧光检测。
[利益声明]所有作者均声明本文不存在利益冲突。

