双氢睾酮逆转棕榈酸诱导的小鼠骨骼肌细胞胰岛素抵抗及其机制
齐睿,牛文彦
(天津医科大学基础医学院免疫学系,天津 300070)
2 型糖尿病是由于胰岛素作用及分泌障碍所致的以高血糖为主要特征的代谢性疾病[1]。胰岛素是体内重要的血糖负调节激素,由胰岛β 细胞分泌,通过结合胰岛素受体,诱导受体及随后一系列信号蛋白如蛋白激酶B(Akt)的磷酸化。Akt 通过磷酸化Akt 底物AS160,促进葡萄糖摄取[2]。胰岛素抵抗是指肝脏、肌肉和脂肪组织对胰岛素的反应降低,胰岛素信号通路受损,促进葡萄糖转运的作用减弱,被认为是2 型糖尿病的常见病因[3]。炎症是肥胖所致的2型糖尿病和胰岛素抵抗的原因之一,肥胖会增加循环中饱和脂肪酸含量,激活抑制蛋白(IκB)激酶(IKK)/核因子-κB(NF-κB)促炎途径,NF-κB 介导通路的激活会刺激促炎细胞因子的表达,如白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),它们会干扰胰岛素信号通路,在胰岛素抵抗和2 型糖尿病的发展中发挥重要作用[4]。骨骼肌是胰岛素作用的重要靶组织,是机体消耗利用葡萄糖的重要外周组织,摄取80%餐后血糖,对维持血糖稳态发挥重要作用,骨骼肌代谢失调严重影响全身葡萄糖代谢和胰岛素敏感性[5]。
雄激素由性腺和肾上腺产生,由类固醇转化为雄激素前体脱氢表雄酮,经过类固醇脱氢酶转化为睾酮,再经5α-还原酶转化为最有效的雄激素双氢睾酮(DHT)[6]。雄激素参与糖、脂和蛋白质代谢,在肥胖等代谢性疾病中发挥作用[7],1/3 的肥胖或糖尿病男性游离睾酮和生物可利用睾酮浓度低于正常水平[8]。骨骼肌是雄激素直接作用的靶组织,可以促进骨骼肌细胞的增殖和分化,提高肌肉质量、强度和骨密度[9-11]。而关于雄激素与骨骼肌胰岛素敏感性及炎症之间的关系仍不明确,本研究旨在探讨DHT在体外对PA 诱导的C2C12 细胞胰岛素抵抗及炎症分子的影响。
1 材料与方法
1.1 实验材料 小鼠骨骼肌细胞株C2C12(美国ATCC公司),DMEM 培养基(美国GIBO 公司),胎牛血清(以色列Bioind 公司),马血清(以色列Bioind 公司),牛血清白蛋白(中国鼎国生物技术公司),棕榈酸(美国Sigma 公司),双氢睾酮(中国Selleck 公司),Trizol 裂解液(美国Ambion),逆转录试剂盒(北京TransGen Biotech 有限公司),实时荧光定量RT-PCR Mix(北京TransGen Biotech 有限公司),罗氏96 实时荧光定量PCR 仪,磷酸化Akt 抗体、磷酸化AS160抗体、磷酸化IKK 抗体、磷酸化NF-κB 抗体(美国CST 公司),IL-6 抗体(Affinity 公司),TNF-α 抗体(万类生物公司),actinin1 抗体(美国Sigma 公司),β-actin 抗体(中国Abclonal 公司),耦联HRP 的山羊抗兔抗体和耦联HRP 的山羊抗鼠抗体(美国JacksonImmuno Research 公司),增强化学发光底物检测试剂盒(美国Millipore 公司),Tannon-5200 化学发光成像系统(北京原平皓生物技术有限公司)。
1.2 实验方法
1.2.1 细胞培养与处理 C2C12 细胞用含10%胎牛血清(FBS)的DMEM 高糖培养基接种于细胞培养板中,在37℃,5%CO2条件下培养,待细胞密度达90%时,换含5%马血清(HS)的DMEM 高糖培养基培养,待细胞融合分化为肌管后,分别用BSA、300 μmol/L PA 或300 μmol/L PA+1 μmol/LDHT孵育C2C12 细胞24 h,加或不加100 nmol/L 胰岛素刺激10 min。
1.2.2 RNA 的提取和实时荧光定量PCR 不同条件孵育C2C12 细胞的12 孔板弃去上清,冷1×PBS 清洗两遍,吸净,每孔加入500 μL Trizol 裂解细胞并收集到RNase free 管中,加入100 μL 氯仿,移液枪吹打并剧烈震荡15 s 充分混匀后室温静置5 min,12 000 r/min 4℃离心15 min,可见样品分为4 层,底层为红色有机相,中、上层为水相,中间层为白色DNA 层,上层为透明RNA 层,将上层透明RNA 吸至新的RNase free 管。加入与上清液等体积的异丙醇,充分混匀,室温静置10 min 后,12 000 r/min,4℃离心10 min,使RNA 从水相中沉淀。离心后可见沉淀于管底的白色胶样RNA,弃掉上清,加入75%乙醇(DEPC 水配置),8 000 r/min,4℃离心5 min,再弃去乙醇,重复两遍后,吸干乙醇。乙醇挥发后,加入25 μL 无酶水,金属浴58℃,2 min 助溶。使用分光光度计Nanodrop 2000 测RNA 浓度。根据逆转录试剂盒操作步骤逆转录合成cDNA 并进行5倍稀释,按照cDNA 4 μL,上下游引物各0.5 μL,2×TransStart Tip Green Qpcr SuperMix10 μL,无酶水补至20 μL 的体系加入八连排并置于罗氏96 实时荧光定量PCR 仪反应。具体的逆转录程序如下:预变性:95℃,300 s;设置45 个循环:变性:95℃,20 s,退火:60℃,20 s,延伸:72℃,20 s;溶解:95℃,10 s,65℃,60 s,97℃,1s;冷却:37℃,30 s。程序结束后拷贝数据,并用LightCycler 96 system 软件整理数据。根据qPCR 得出的荧光曲线的Ct 值,以β-actin 基因为内参,ΔCt=Ct-目的基因-Ct-β-actin,ΔΔCt=实验组ΔCt 值-对照组ΔCt 值,用2-ΔΔCt 计算结果。实验重复3 次。所用到的引物序列见表1。

表1 扩增反应所需引物序列Tab 1 Primer sequences for amplification reaction
1.2.3 Western 印迹 配置RIPA 裂解液(含蛋白酶抑制剂Na3VO41 mmol/L,NaF 0.5 mmol/L,PIC 11 μmol/L和PMSF 200 μmol/L)。弃去不同条件孵育C2C12细胞的12 孔板上清,用冷1×PBS 缓冲液清洗两遍,用细头吸管吸净,加入200 μL RIPA 裂解液,置于冰上20 min,并收集。预冷离心机至4℃,13 000 r/min,离心20 min,取上清。将5×LSB 与上清液按1∶4 的比例混匀,金属浴65℃加热15 min。制备7.5%的聚丙烯酰胺凝胶,待胶凝固后,正确安置在电泳槽中,每孔加入50 μg 的样品分离蛋白,根据目的蛋白的分子量确定电泳何时结束。按照“三明治”的模式将海绵-滤纸-凝胶-PVDF 膜-滤纸-海绵放置在转膜夹中,将凝胶上的蛋白转到PVDF 膜上。转膜结束后,用3%牛血清白蛋白室温封闭2 h,一抗(β-actin按1∶10 000 比例,actinin1 按1∶5 000 比例,Akt、AS160、IKK、NF-κB、IL-6 按1∶1 000 比例,TNF-α按1∶500 比例,用1%BSA 稀释配置)4℃过夜孵育,次日用TBST 缓冲液洗4 次,每次10 min,然后使用偶联辣根过氧化物酶标记二抗(按1∶5 000 比例,用1%BSA 稀释配置)室温孵育2 h,再用TBST 缓冲液洗4 次,每次10 min。最后ECL 显色后曝光,Image J 进行定量分析。
1.3 统计学处理 采用GraphPad Prism6 统计软件进行统计学分析,符合正态分布的计量资料均以±sx表示,多组间比较采用单因素方差分析(One-Way ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 DHT对C2C12细胞胰岛素信号蛋白的影响 Western 印迹检测DHT 对C2C12 细胞胰岛素信号通路的作用(图1),与BSA 孵育相比,PA 孵育后胰岛素刺激的Akt S473 和AS160 S318 均显著降低(均P<0.05)。PA 和DHT 混合孵育后胰岛素刺激的Akt S473和AS160 S318 磷酸化水平显著升高(F=59.29、7.829,均P<0.05)。

图1 C2C12 细胞中Akt 和AS160 磷酸化水平Fig1 The phosphorylation levels of Akt and AS160 in C2C12 cells
2.2 DHT 对C2C12 细胞炎症信号通路相关蛋白的影响 Western 印迹检测DHT 对C2C12 细胞IKK/NF-κB 信号通路的作用(图2),与BSA 孵育相比,PA 孵育后,IKKα/β pS176/177 和NF-κBp65 S536磷酸化水平显著升高(均P<0.05);而PA 和DHT 混合孵育后,IKKα/β pS176/177 和NF-κB p65 S536磷酸化水平相比于PA 孵育后显著降低(F=13.94、10.65,均P<0.05)。

图2 C2C12 细胞中IKKα/β pS176/177 和NF-κBp65S536磷酸化水平Fig 2 Phosphorylation levels of IKKα/β pS176/177 and NF-κB p65 S536 in C2C12 cells
2.3 DHT 对C2C12 细胞促炎细胞因子的影响qPCR 和Western 印迹分别检测PA 及DHT 对C2C12 细胞促炎细胞因子IL-6 和TNF-α mRNA和蛋白水平的影响,结果见图3,与BSA 孵育相比,PA 孵育后IL-6 和TNF-α mRNA 水平明显升高(均P<0.01);而PA 和DHT 混合孵育后显著降低了IL-6 和TNF-α mRNA 水平(F=13.71、12.77,均P<0.05)。同时,与BSA 孵育相比,PA 孵育后IL-6 和TNF-α 蛋白表达明显升高(均P<0.01);而PA 和DHT 混合孵育后IL-6 和TNF-α 蛋白表达降低(F=10.82、15.14,均P<0.05)。
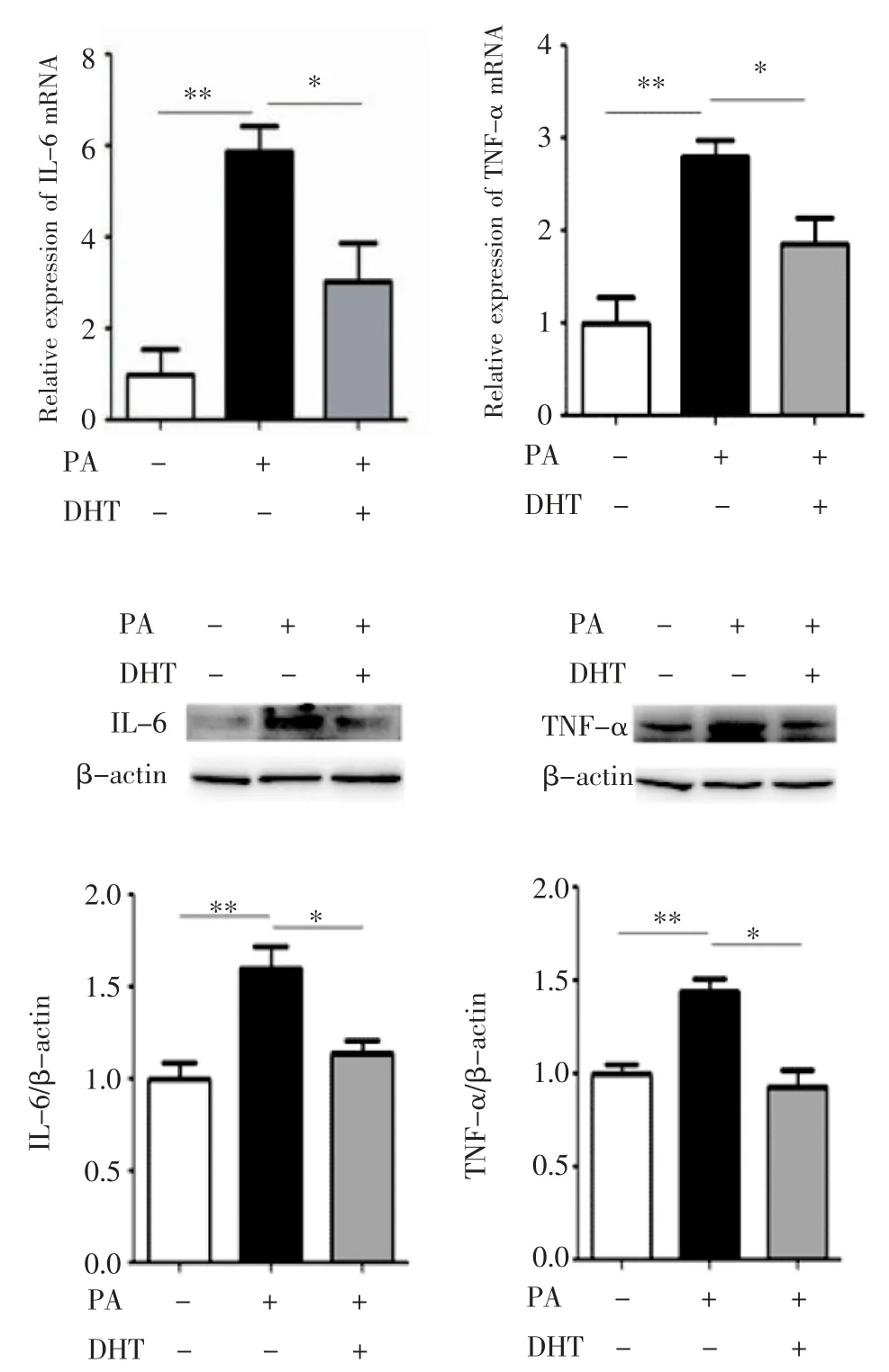
图3 C2C12 细胞中IL-6 和TNF-α 的表达Fig 3 The expression of IL-6 and TNF-α in C2C12 cells
3 讨论
越来越多的研究证明,雄激素缺乏与能量失衡、胰岛素敏感性降低和血脂异常有关。在肥胖模型db/db 小鼠中,血液中雄激素水平的降低会显著加重葡萄糖耐受不良,而外源性雄激素的补充可降低空腹胰岛素水平,改善胰岛素敏感性[12]。雄激素缺乏会使男性更易患代谢综合征,容易导致男性胰岛β细胞功能障碍和衰竭,而补充雄激素通过增强胰高血糖素样肽(GLP)-1 的促胰岛素作用,增强葡萄糖刺激的胰岛素分泌[13]。雄激素可以通过磷酸腺苷激活的蛋白激酶(AMPK)/过氧化物酶体增殖物激活受体γ 共激活因子(PGC)-1α/核呼吸因子(NRF)-1改善高脂诱导的线粒体功能障碍和能量代谢紊乱,并通过激活Akt 信号通路,缓解高脂诱导的大鼠肝脏胰岛素抵抗[14];通过肝激酶B1(LKB1)/AMPK 信号通路促进3T3-L1 脂肪细胞中葡萄糖摄取[15];而关于雄激素对骨骼肌胰岛素抵抗的影响尚不明确。因此,本研究选择C2C12 小鼠骨骼肌细胞体外探讨。
PA 在细胞内水平超过其线粒体氧化水平,会转化为有害的脂质如二酰甘油和神经酰胺。二酰甘油会激活蛋白激酶C(PKC),PKC 会直接或通过激活IKK/NF-κB 信号通路介导炎症,间接损害胰岛素信号通路,诱导胰岛素抵抗[16-18]。本研究用PA 孵育C2C12 细胞后,胰岛素作用下的Akt、AS160 磷酸化水平降低,胰岛素作用受损,表明细胞发生胰岛素抵抗。而在DHT 孵育后,胰岛素作用下的Akt 和AS160磷酸化水平升高,逆转了PA 对胰岛素作用下的Akt和AS160 的抑制作用,提示DHT 可以改善PA 诱导的C2C12 细胞胰岛素抵抗。
炎症与胰岛素抵抗和糖尿病密切相关。在高脂环境中,骨骼肌细胞也会发生炎症反应,主要表现为细胞的促炎信号通路激活,促炎细胞因子分泌增加等,进而影响胰岛素敏感性。研究报道,DHT 具有抗炎作用[19],可以抑制人睑板腺上皮细胞促炎基因的表达[20];缓解小鼠烧伤引起的炎症,减少伤口浸润巨噬细胞的数量,加速炎症的消退促进伤口愈合[21]。因此,本研究进一步检测了炎症相关分子的表达。PA 孵育后,IKK、NF-κB 磷酸化水平升高,促炎细胞因子IL-6、TNF-α 的表达增加,表明细胞发生炎症。而DHT 孵育后,C2C12 细胞中IKK、NF-κB 磷酸化明显降低,促炎细胞因子IL-6、TNF-α mRNA和蛋白表达降低,抑制了PA 对C2C12 细胞的促炎作用,提示DHT 可能通过抑制炎症信号逆转PA 诱导的骨骼肌细胞胰岛素抵抗。
综上所述,本研究证明了DHT 通过Akt/AS160途径可以改善PA 诱导的C2C12 细胞的胰岛素抵抗,其机制可能与DHT 抑制IKK/NF-κB 通路,减少促炎细胞因子的表达有关。

