术前全血炎症标志物预测喉鳞状细胞癌患者预后的价值△
张鑫婷 汪迪 曹萍 邓泽义
(1.南方医科大学珠江医院耳鼻咽喉头颈外科 广州 510282;2.南方医科大学珠江医院医疗质量管理科 广州 510282)
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是最常见的头颈部恶性肿瘤之一。其中,2015年我国新增病例26 300 例,死亡病例14 500 例[1];2020 年美国预计LSCC 新增病例12 370 例,死亡病例3 750 例[2]。手术治疗、放射化学治疗(简称放化疗)仍是主要的治疗手段[3-4]。然而,无论采用何种方法治疗,转移和复发依然是目前头颈外科医师需要关注和克服的问题[4]。因此,寻找基于解剖学基础的临床分期之外的预后指标,体现了对肿瘤免疫学特征及患者全身状况的关注。
有研究[5-7]表明,血小板淋巴细胞比值(plateletto-lymphocyte ratio,PLR)、中性粒细胞淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、淋巴细胞单核细胞比值(lymphocyte-to-monocyte ratio,LMR)等炎症相关预后指标可作为结直肠癌、卵巢癌、甲状腺癌和鼻咽癌等多种实体瘤的预后指标。但目前,国内关于PLR、NLR 和LMR 与LSCC 临床特征、总生存率(overall survival,OS)和无复发生存率(recurrentfree survival,RFS)等预后指标的关系,特别是评估3 个指标组合后预后价值的研究还较少。本文探讨了PLR、NLR和LMR炎症标志物与LSCC多项临床特征、预后的相关性,现报告如下。
1 资料与方法
1.1 研究对象 2013 年7 月18 日~2019 年1 月30日于南方医科大学珠江医院耳鼻咽喉头颈外科就诊的LSCC 患者116 例,其中男性108 例、女性8 例;年龄54~68 岁,中位年龄60 岁。根据病灶情况和相关指南[3],所有患者都接受了根治性治疗,包括单纯手术、手术加放射治疗(简称放疗)等。纳入标准:病理学确诊,术前1 周内有血液学检查,临床资料完整,初次治疗即临床缓解的患者。排除标准:在外院已进行治疗的患者和合并重症感染的患者。1.2 临床数据收集 录入患者临床资料:年龄、性别、身高、体重;术前1 周内血液学检查结果包括中性粒细胞计数、淋巴细胞计数、单核细胞计数、血红蛋白(hemoglobin,Hb)水平、血小板计数、白蛋白(albumin,Alb)水平、肿瘤原发部位、手术方式、TNM 分期(依据国际抗癌联盟制定的第8 版分期标准)。
随访截止日期为2020 年1 月16 日,采用门诊复查和电话联系的方式,记录患者肿瘤复发及生存情况。116 例患者的总生存期规定为从手术日到死亡日或随访截止日,计算参数包括PLR、NLR 和LMR 等炎症相关预后指标。
1.3 统计学处理 符合正态分布的计量资料以均值±标准差(x±s)表示,不符合者以中位数(上下四分位数)表示。应用SPSS 23.0 统计学软件,对各项炎症指标绘制受试者操作特征曲线(receiver operating characteristic curve,ROC 曲 线),界值,采用Kaplan-Meier 生存分析比较不同组间的生存率,以患者死亡为终点事件,进行单因素分析,应用Cox模型筛选有意义的变量。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本信息 116例患者中,声门型108例(93.1%)、声门上型7例(6.0%)、声门下型1例(0.9%)。T1、T2、T3、T4期的例数分别为49(42.2%)、28(24.2%)、20(17.3%)、19(16.3%)例。病理分化程度包括高分化45 例(38.7%)、中分化68 例(58.7%)、低分化3 例(2.6%)。颈部淋巴结转移25 例。116 例患者均按临床分期行肿瘤根治术,包括单纯手术89 例,手术加术后放疗17 例。
术前血常规显示,单核细胞0.52(0.40~0.72)×109/L,中性粒细胞4.49(3.26~5.46)×109/L,淋巴细胞1.98(1.55~2.50)×109/L,血小板233.00(199.00~282.00)×109/L。
2.2 炎症指标ROC 曲线的绘制和临界值的确定 以患者死亡为终点,使用ROC 曲线分析116 例患者资料,PLR 曲线下面积(area under the curve,AUC)值为0.683,P<0.001。根据约登指数=灵敏度+特异度-1,取最大值为最佳临界值,确定PLR、NLR和LMR 临界值分别131.24、2.68、4.88,并根据临界值将患者分为PLR 高值组(>131.24)和低值组(<131.24)、NLR 高值组(>2.68)和低值组(<2.68)、LMR 高值组(>4.88)和低值组(<4.88)。
将PLR、NLR、LMR 组合成PLR+LMR、PLR+NLR、LMR+NLR、PLR+NLR+LMR 进行回归分析后绘制ROC 曲线。联合指标的诊断效能优于单独指标,由高到低依次为PLR+LMR、PLR+NLR、PLR+NLR+LMR、PLR、NLR、LMR、LMR+NLR。其中,PLR+NLR、PLR+LMR、PLR+NLR+LMR 的诊断效能差异显著(P<0.001),AUC 值均>0.8,尤其是PLR+NLR,具有最佳的灵敏度和特异度。详见表1。
2.2 PLR、NLR、LMR 与LSCC 征的关系 治疗前PLR 与患者年龄、性别、T 分期、肿瘤原发部位均不相关,与淋巴结转移相关(P<0.05);治疗前NLR 与患者年龄、性别、肿瘤原发部位均不相关,与T 分期(P<0.05)、淋巴结转移(P<0.05)相关;治疗前LMR 与患者年龄、性别、淋巴结转移、肿瘤原发部位均不相关,与T 分期(P<0.01)相关(表2)。PLR、NLR、LMR 均与肿瘤分化程度无关(P>0.05)。
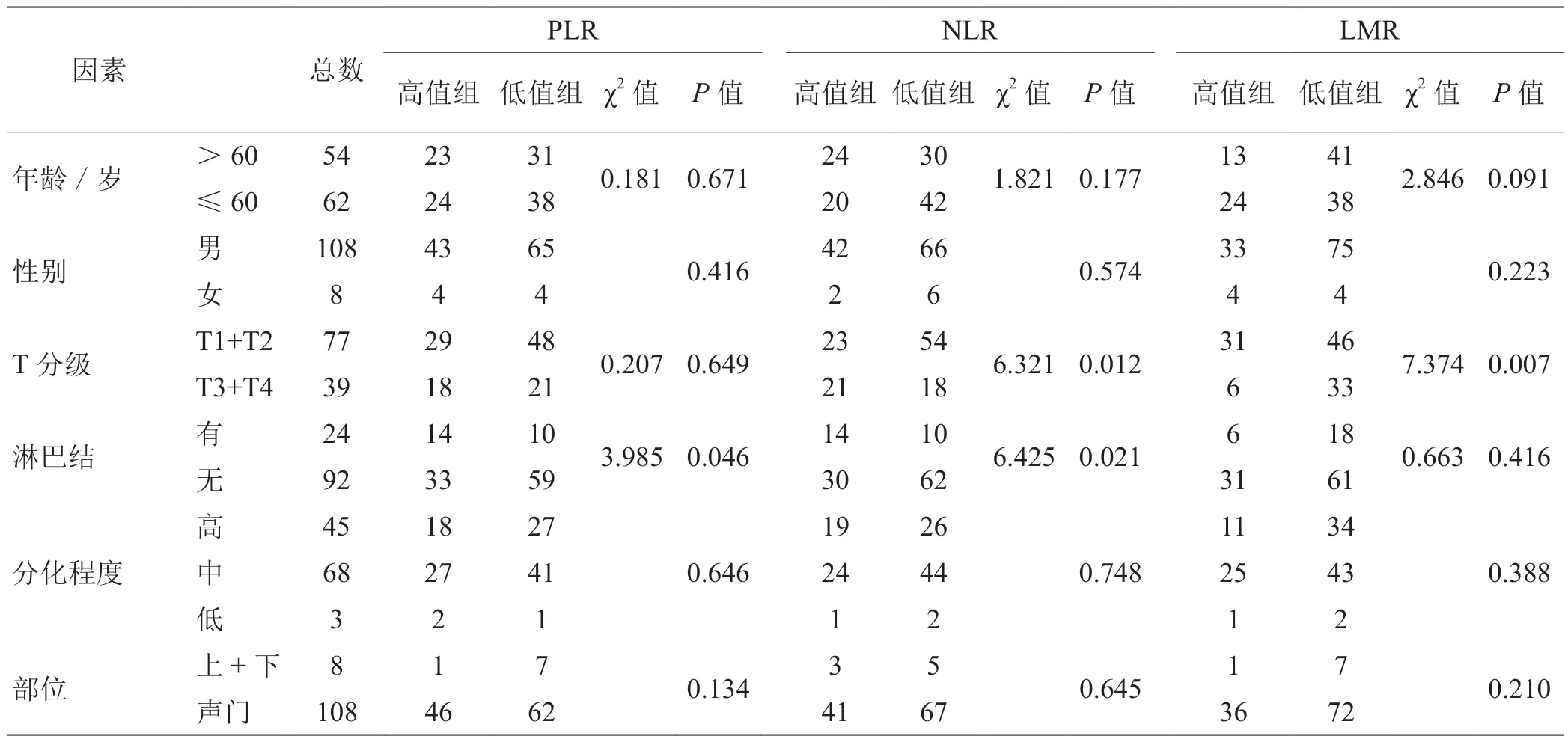
表2 术前PLR、NLR、LMR 与LSCC 临床特征的关系
2.3 治疗后RFS 的生存因素分析 116 例患者中复发30 例,包括死亡19 例,其中非本病死亡3 例。平均随访时间为(78.98 ± 4.20)个月。总生存率为83.62%,RFS 为74.13%。T 分期、颈淋巴结转移、PLR、NLR与喉癌术后5 年RFS 相关(表3)。
Durbin-Watson 检验值为2.034,数据间互相独立;方差膨胀系数(variance inflation factor,VIF)均<5,数据不存在共线性。对经单因素分析有意义的变量进行Cox多因素分析。T 分期(P<0.01)、PLR (P<0.05)和NLR (P<0.05)为影响喉癌术后RFS 的独立因素,模型检验总体有意义(P<0.001,图1)。
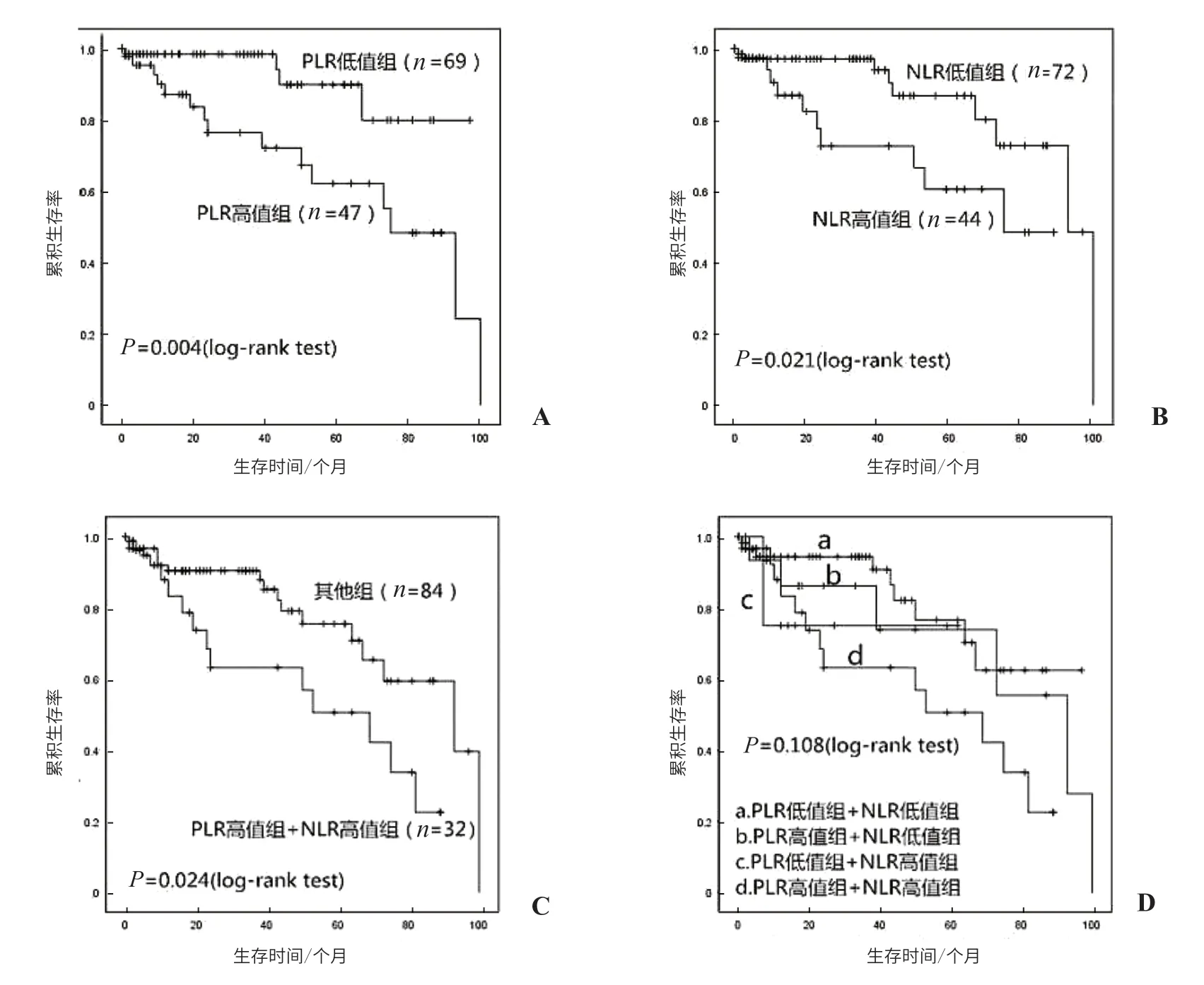
图1 不同组别LSCC患者的生存曲线 A.PLR高值组与PLR低值组患者生存曲线;B.NLR高值组与NLR低值组患者生存曲线;C.其他组与PLR高值组+NLR高值组患者生存曲线;D.PLR低值组+NLR低值组、PLR高值组+NLR低值组、PLR低值组/NLR高值组和PLR高值组/NLR高值组4个组别患者生存曲线。
3 讨论
以手术为主,结合放化疗和靶向治疗是LSCC 的主要治疗方式[3]。寻找能对预后进行有效预测的检测指标,是当前的探讨重点之一。关于炎症反应[8]在肿瘤发生、发展、侵袭等方面的作用得到了越来越广泛的认识。PLR、NLR、LMR、C 反应蛋白(C-reactive protein,CRP)等都是常见的反映机体整体和炎症反应的指标,且创伤小、经济、便捷[9],近几年得到越来越多的关注。
中性粒细胞和血小板均为肿瘤增殖的重要正向因子。中性粒细胞作为吞噬细胞的一种,能释放基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等具有强大促血管生成的活性因子[10]。而血小板源于骨髓巨核细胞,参与止血、细胞炎性反应、非特异性免疫、肿瘤侵袭增殖等多种重要的病理生理过程。血小板不仅能促进血管生成,而且能通过干扰免疫系统对肿瘤细胞的识别,建立对吞噬细胞的物理屏障[11],促进肿瘤细胞扩增,而肿瘤的生长又进一步活化血小板,从而形成恶性扩增循环。淋巴细胞降低是机体免疫力下降的重要信号[8]。因此,PLR、NLR 升高往往意味着肿瘤增殖、侵袭能力上升或机体免疫力下降[12]。与之相一致的是,本研究发现,PLR、NLR 升高与颈淋巴结转移相关,而NLR 升高更多出现在T 分期较晚的患者中。此外,PLR、NLR、LMR 均与肿瘤分化程度无关,这提示PLR 等炎性因子和肿瘤分化影响预后的机制不同。PLR 在很多实体瘤中作为炎症反应的标志物,其增高意味着血小板相对增多,淋巴细胞相对减少,是提示预后不良的独立因素[12]。与PLR 一样,NLR 升高意味着中性粒细胞相对增多,淋巴细胞相对减少,增加了肿瘤复发和转移的风险[13]。一项纳入549 例大肠癌患者的回顾性研究认为,NLR 是比PLR 更好的预测预后的血清标志物[14]。有研究[15]指出,KRAS突变与低NLR、高LMR 有关;PIK3CA突变与高LMR、高PLR 有关;TP53突变与低PLR、高LMR 有关;微卫星不稳定性(microsatellite instability,MSI) 与 高PLR、高NLR相关。KRAS、PIK3CA、TP53和MSI 都是与肿瘤预后、免疫治疗效果相关的因素[16]。前文提到的中性粒细胞释放的VEGF 亦受肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等多个因子的调控[17],为后续研究调控PLR、NLR 的分子生物学机制提供了方向。在我们的研究中,高PLR 和高NLR 的LSCC 患者均有着更差的预后。本研究与相关文献[12,18]报道一致,Cox单因素及多因素回归分析均显示,LSCC 患者在治疗前的PLR、NLR 和T 分期均与预后有关。
单核细胞可分泌多种炎性因子,促进肿瘤细胞的增殖、转移和侵袭。LMR 降低的原因常为单核细胞升高或淋巴细胞相对降低,降低常提示预后不良[18]。本研究中,LMR 降低且与LSCC 患者预后无相关性,这与一篇纳入285 例喉癌、下咽癌、口咽癌患者的回顾性分析[19]和一篇纳入979 例LSCC患者[18]的研究结果不太一致,可能是前者纳入患者并非全为LSCC,而后者纳入患者更多为晚期患者,具体有待进一步研究。
根据AUC 值,得出3 个炎症相关指标的诊断效能依次为PLR、NLR、LMR,前两者敏感度和特异度与其他有关LSCC 的研究一致[12,18,20]。联合诊断的效能优于单独指标诊断,由高到低依次为PLR+LMR、PLR+NLR、PLR+NLR+LMR、LMR+NLR,前三者的AUC 值均>0.8。尤其以联合PLR+NLR 值作为预后指标具有最佳的灵敏度和特异度。我们发现,PLR值和NLR 值均偏高的患者有着更差的预后,也提示PLR 值和NLR 值联合具有很好的预后价值。
总之,PLR、NLR 可用于预测LSCC 患者的预后,值越高提示预后越差;LMR 可用于预测LSCC 患者的分期,值越高提示分期越晚。随着近年LSCC 发病率逐年升高,通过检测血清标志物来预测LSCC具有方便、快捷、可重复性强的优点,在临床上,特别是在肿瘤的监控中占据重要地位。未来可通过多中心、大样本研究来减少误差,进一步提高诊断临界值的敏感度和特异度。

