Cu2+暴露下蛋白核小球藻的生理响应研究
智凯亭,成龙,阎瀚威,陈生熬,刘洁雅*
(1塔里木大学动物科学与技术学院,新疆 阿拉尔 843300)
(2新华水电发电公司阿尔塔什鱼类增殖站,新疆 莎车 844700)
重金属已成为环境中典型的污染物之一,近年来呈高发的态势。有相关报道,在2013年有2 0743 t的锌、3 703 t的铜、2 004 t的铅、1 38 t的镉、40 t的汞和2 976 t的砷通过陆地系统排入海洋[1]。其中,造成水体重金属污染的主要原因有两点:一是化工行业所排放的工业废水;二是含有大量重金属离子的生活废水和水产养殖所产生的废水。由于重金属进入水体环境后不能被生物所降解,只能进行形式和浓度的改变,如由高浓度转变为低浓度,不能从环境中彻底清除,而导致水体重金属污染。此外,李静静[2]研究指出重金属还会随着食物链在生物体内不断富集,当达到临界计量后就会破坏生物的生理代谢过程,严重影响水生生物的生长甚至生存,从而破坏水生生态系统,最终使人类健康受到严重威胁。SODANGO T H等[3]指出评价水环境中重金属对水生生物的毒性效应对于重金属的安全性评价以及开展如何减弱或祛除水体中重金属的污染物问题具有重大意义。
而蛋白核小球藻(C.pyrenoidosa)是绿藻门单细胞藻类,宋崇崇等[4]提到其具有分布均匀、不易下沉、光合自养、繁殖速度快等特点,且其特殊的网状细胞壁结构利于重金属分子吸附于其上,使其整个细胞能与重金属污染物紧密结合,同时蛋白核小球藻因其个体小、富含叶绿素、易于在室内培养且养殖周期短等特征,是一种理想的毒理学指示生物。此外,NONG Q Y等[5]及LIU B Y等[6]相关研究表明在有毒物质的作用下绿藻能够产生活性氧(ROS),ROS的存在则直接干扰或降低绿藻细胞的光合过程从而影响其叶绿素的代谢过程,最终干扰细胞的生长和增殖。同时,ROS的产生会激活细胞的抗氧化酶活性,如SOD和CAT,从而防止自由基在氧化应激过程中对细胞本身造成损伤[7]。目前国内外的研究较多集中在重金属对藻类的短期毒性效应上,对重金属毒性的长期效应与藻类耐受机制的研究还较少。
1 材料与方法
1.1 试验材料
本试验所用蛋白核小球藻(C.pyrenoidosa),2021年4月购买于中国科学院水生生物研究所。
1.2 试验方法
所用试验仪器预先消毒灭菌备用。选取BG11培养基,购置于海博生物技术有限公司。配制培养基,灭菌后接种蛋白核小球藻,接种量为1.5 mL/1 500 mL。在光照强度4 000 Lux,温度(24±2)℃,光暗比12 h:12 h条件下,置于光照培养箱中进行静置培养。培养过程中为防止细胞沉降,每日定期摇晃锥形瓶3~5次。为了保持稳定均衡光照强度,每日随机调换锥形瓶位置2~3次。
称取1 g CuSO4·5H2O,定容至 1 000 mL,配制成Cu2+浓度为1 g/L的母液,按预实验设计Cu2+浓度空白组、低浓度组(0.10 mg/L、0.50 mg/L)、中浓度组(1 mg/L)、高浓度组(2 mg/L)三个梯度制备母液和所需的反应液,并将制备好的培养液灭菌备用[8]。
将接种量为1.5 mL/1 500 mL的藻液于光照强度4 000 Lux,温度(24±2)℃,光暗比12 h:12 h条件下,置于光照培养箱中进行静置培养3 d后,测定其初始生理指标(生物量、叶绿素和蛋白质含量),之后将培养后的藻种培养液分装于250 mL锥形瓶中,每组设置3个平行,加入反应液开始毒理实验。暴露时长为14 d,采用浊度比色法、考马斯亮蓝法和叶绿素分析法,每隔48 h进行一次生理指标测定。连续暴露14 d后观察蛋白核小球藻形态有无变化。
1.3 试验指标测定
1.3.1 生物量测定
用721分光光度计测定样本光密度值(OD680nm),以确定藻的生长情况。接种后每2 d从培养瓶中取2 mL的藻液稀释至10 mL,测定其在波长680 nm处的OD值,根据藻液在680 nm处的OD值,由标准曲线或其直线回归方程公式Y=0.950 8X+0.012(r2=0.998 5)[9]可得出蛋白核小球藻在不同 Cu2+浓度培养条件下的生物量。
1.3.2 叶绿素含量的测定
取锥形瓶中藻液2 mL,离心(3 000 r/min,5 min),去上清,收集藻饼。置于2 mL 90%丙酮中重悬浮,之后用锡箔纸将离心管完全包裹,在4℃全黑暗条件下抽提24 h,离心(4 000 r/min,10 min),取上清液至10 mL刻度试管中,用90%丙酮定容至5 mL,利用公式:Ca(mg/L)=12.7 OD663nm-2.69 OD645nm;Cb(mg/L)=22.9 OD645nm-4.68 OD663nm;CT(mg/L)=OD652nm×1 000/34.5;测定663 nm、645 nm、652 nm处的样本吸光度值。
1.3.3 蛋白质含量测定
采用考马斯亮蓝法测定蛋白核小球藻蛋白质含量。
标准曲线绘制:采用考马斯亮蓝法以牛血清蛋白(bovine albumin,BSA)为标准品制作标准曲线。称取20.0 mg牛血清蛋白,用去离子水定容至体积200 mL。分别取 10 μL、20 μL、40 μL、60 μL、80 μL牛血清蛋白加入到1.5 mL离心管中,加双蒸水定容至100 μL,并设100 μL双蒸水作为对照。加入1 mL考马斯亮蓝G-250染料(Coomassie brilliant blue,CBB)后混匀,于室温静置5 min。取250 μL于酶标板中,在酶标仪中测定595 nm处OD值。以595 nm处吸光值为纵坐标,牛血清蛋白含量(μg/mL)为横坐标绘制标准曲线:Y=0.0024X+0.7364(r²=0.9972)。
样品测定:取锥形瓶中藻液3 mL,离心(5 000 r/min,10 min),去上清。藻饼用PBS缓冲液冲洗两次,加入2 mL 0.35 mol/L的NaOH溶液,震荡均匀,置于74.5℃水浴69 min。离心(5 000 r/min,10 min),吸取100 μL上清液,加入新的离心管中,加入1 mL CBB染料,室温静置5 min,取250 μL于酶标板中,测得595 nm处OD值。按照标准曲线回归方程计算得出蛋白核小球藻的蛋白质含量[10]。
2 结果
2.1 不同浓度Cu2+长期暴露下蛋白核小球藻生物量的变化
不同浓度Cu2+长期暴露下对蛋白核小球藻生长影响显著,结果表明,空白对照组中蛋白核小球藻生物量迅速增长在暴露0~4 d,与低浓度组(0.10 mg/L)差异不明显,同时低浓度组(0.50 mg/L)蛋白核小球藻生物量迅速增长期集中在0~6 d,之后增长速度减缓。这三组蛋白核小株藻生物量达到峰值的时间和生物量分别在第10 d为120.39 mg/L;第4d为118.45 mg/L;第6 d为115.03 mg/L。达到峰值后各组蛋白核小球藻生物量与暴露时间呈负相关(P<0.01)。而中高浓度组(1 mg/L、2 mg/L)的蛋白核小球藻生物量则在0~2 d内含量迅速降低,于第2 d减少至最低值,分别为95.16 mg/L、92.42 mg/L,之后蛋白核小球藻生物量则与暴露时间呈正相关(P>0.05),如图1所示。
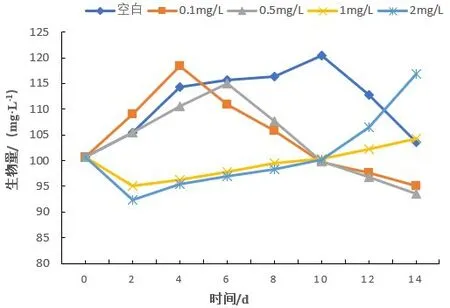
图1 蛋白核小球藻在不同浓度Cu2+长期暴露各阶段生物量
2.2 不同浓度Cu2+长期暴露下蛋白核小球藻叶绿素含量的变化
2.2.1 不同浓度Cu2+长期暴露下蛋白核小球藻叶绿素a、b含量的变化
蛋白核小球藻叶绿素a和叶绿素b的含量在7个暴露时间节点(2 d、4 d、6 d、8 d、10 d、12 d、14 d)下的变化情况。图2a的结果表明,不同浓度Cu2+长期暴露下对蛋白核小球藻叶绿素a含量影响较大,随着暴露时间增加,对照组、中浓度组(1 mg/L)和高浓度组(2 mg/L)叶绿素a含量都在8 d内完成了累积并达到峰值分别为1.66 mg/L、2.15 mg/L和1.80 mg/L。但与对照组不同的是中低浓度组中叶绿素a合成在2 d内受到抑制,在第4 d后快速积累至峰值。而低浓度组则都在Cu2+14 d暴露期间出现两个峰值是在第2 d和第8 d,含量分别为0.93 mg/L、1.22 mg/L和1.50 mg/L、1.71 mg/L。
图2b的结果表明,随着暴露时间增加,对照组、低浓度组(0.10 mg/L)和中高浓度组叶绿素b含量都于第8 d达到峰值,分别为2.92 mg/L、3.49 mg/L、4.37 mg/L、3.58 mg/L,后随暴露时间延长含量逐渐下降。而低浓度组(0.50 mg/L)在则在第10 d达到峰值2.87 mg/L。高浓度组2 d内叶绿素b合成也受抑制,于第2 d降低至最小值0.76 mg/L,之后逐渐升高至峰值且含量高于低浓度组峰值。综上,就累积速率而言在0~4 d内空白组和低浓度组优于中高浓度组,但在4 d后中高浓度组的叶绿素积累速率和峰值显著高于低浓度组和对照组(P<0.01),其中又以中浓度试验组的叶绿素a、b含量最高。
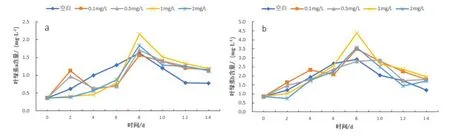
图2 蛋白核小球藻在不同浓度Cu2+长期暴露各阶段叶绿素a、b含量
2.2.2 不同浓度Cu2+长期暴露下蛋白核小球藻叶绿素总含量的变化
如图3所示,在暴露于Cu2+后的7个时间节点下(2 d、4 d、6 d、8 d、10 d、12 d、14 d),蛋白核小球藻总叶绿素含量的变化情况。结果表明,随着暴露时间增加对照组总叶绿素含量0~8 d增加迅速,并于第8 d达到峰值4.21 mg/L,后随暴露时间延长迅速减少。低浓度组(0.10 mg/L)在0~2 d含量迅速增加,2~6 d缓慢增加,后又迅速增加,在第8天达到峰值3.91 mg/L,后随暴露时间延长含量逐渐减少。低浓度组(0.50 mg/L)在0~2 d含量迅速增加,2~4 d含量降低,后迅速增加,在第8 d达到峰值5.16 mg/L,后随暴露时间延长含量迅速减少。中浓度组(1 mg/L)在0~4 d含量逐渐升高,4~8 d迅速升高,并于第8 d达到峰值5.83 mg/L,高于低浓度组峰值,之后叶绿素含量随暴露时间延长迅速减少。高浓度组(2 mg/L)在0~2 d内含量降低,于第2 d降低至最小值1.06 mg/L,2~8 d含量逐渐升高,并于第8 d达到峰值6.27 mg/L,高于中浓度组峰值,其中高浓度组(2 mg/L)在此处含量最高。
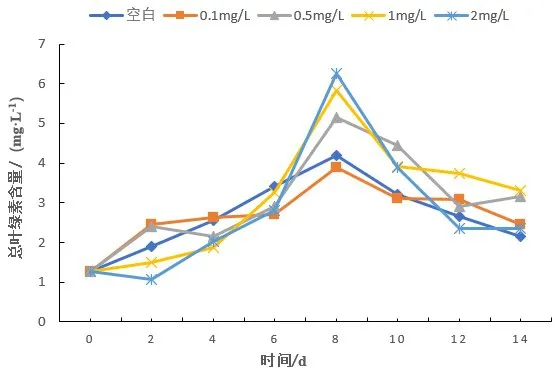
图3 蛋白核小球藻在不同浓度Cu2+长期暴露各阶段总叶绿素含量
2.3 不同浓度Cu2+长期暴露下对蛋白核小球藻蛋白质含量的影响
不同浓度Cu2+长期暴露下对蛋白核小球藻蛋白质含量影响较大。如图4所示,不同浓度组在7个暴露时间节点(2 d、4 d、6 d、8 d、10 d、12 d、14 d)下蛋白核小球藻蛋白质的含量变化。结果表明,空白对照组、低浓度组随着暴露时间增加蛋白质含量分别在0~4 d、0~4 d和0~2 d增加迅速,之后缓慢增加,分别在第10 d、4 d和6 d达到峰值64.56 mg/L、56.94 mg/L和56.64 mg/L,后随暴露时间延长迅速降低。中浓度组和高浓度组在0~2 d内蛋白质含量减少,于第2 d减少至最小值24.14 mg/L和20.81 mg/L,随暴露时间延长逐渐升高。且高浓度组中的蛋白质含量于第12 d达到峰值64.06 mg/L。
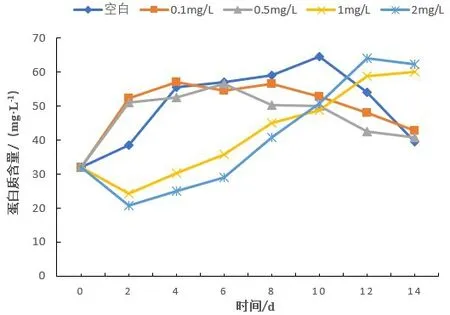
图4 蛋白核小球藻在不同浓度Cu2+长期暴露各阶段蛋白质含量
2.4 不同浓度Cu2+长期暴露对蛋白核小球藻形态的作用
图5为不同浓度Cu2+长期暴露14 d后,400×倍显微镜下蛋白核小球藻的细胞形态,从图中可看出空白组藻细胞大小形态均匀且饱满,而随着Cu2+浓度增加藻细胞大小出现差异,细胞体积和形态都有所变化。其中以高浓度组最为明显,藻细胞密度增大,但形态大小不一、细胞饱满度和圆润程度降低,出现椭圆和扁平的藻细胞。
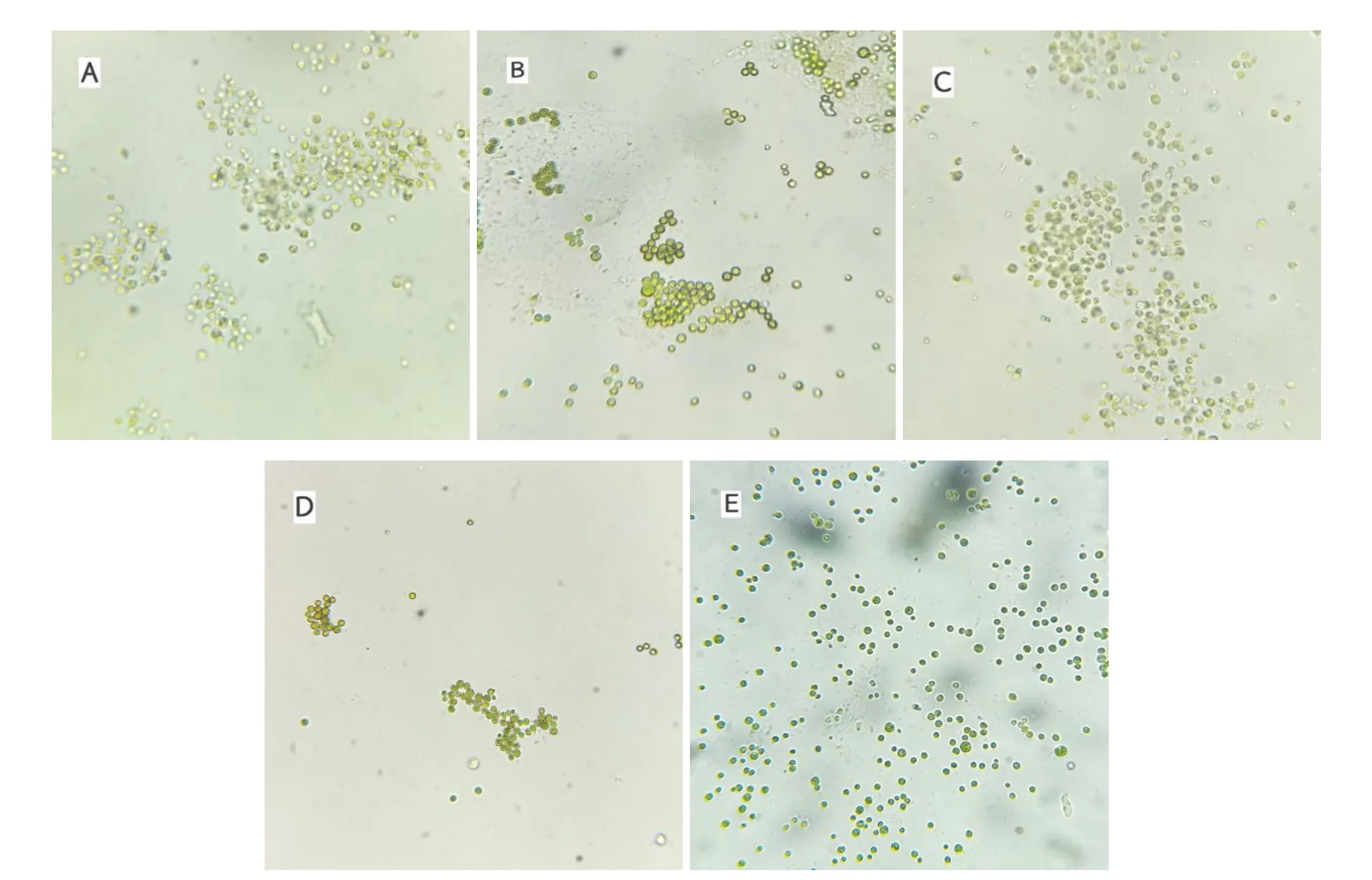
图5 蛋白核小球藻在不同浓度Cu2+长期暴露14 d后藻细胞形态
3 讨论
3.1 Cu2+长期暴露对蛋白核小球藻生物的影响
在自然界中Cu2+是生物生长的必需微量元素之一,故而Cu2+存在对生物的生长至关重要,蛋白核小球藻也不例外,即Cu2+的缺乏或者过量都会对细胞生长产生不利影响。该试验结果表明,蛋白核小球藻经Cu2+短期(0~48 h)暴露后,低浓度组促进生长,中高浓度组生长则受到抑制。最可能的原因是低浓度中的藻细胞将Cu2+作为微量营养物质进行吸收利用,从而促进其本身的生长,而这种低浓度促进而高浓度抑制的现象也早已被证实,被称为生物的自我平衡机制[11-12]。本研究中,Cu2+长期(1.5~15 d)暴露的作用下,空白对照组生物量于第10 d达到峰值120.39 mg/L,低浓度组Cu2+生物量于第4 d和第6 d达到峰值118.45 mg/L和115.03 mg/L,试验结果表明较低浓度的Cu2+能更快促进蛋白核小球藻生长,在短期内达到最大环境容纳量也验证了这一机制。相似地在沈国兴等[13]研究中也显示了类似的试验结果,其在藻液中加入少量苄嘧磺隆,藻细胞会将苄嘧磺隆作为营养物质吸收利用,以促进藻的生长。与之相对的中高浓度组中的蛋白核小球藻细胞在短期内受到强刺激,藻细胞结构受到一定程度的破坏,生理机能受到抑制,生物量迅速降低,于第2 d达到最小值,分别为95.16 mg/L、92.42 mg/L。后随Cu2+暴露时间延长蛋白核小球藻生物量又逐渐升高,试验结束前仍处于上升趋势,这种变化趋势的可能原因是48 h后藻细胞对Cu2+的耐受性增加,导致其抑制效果降低。而这种耐受性可能是因为多种因素的作用,例如:表面反应或者与金属复合物性质有关的胞外有机物质的产生等,影响了测试溶液中的金属化学性质,从而降低了Cu2+对蛋白核小球藻的毒性[14-16]。
3.2 Cu2+长期暴露对蛋白核小球藻中叶绿素含量的影响
叶绿素是藻类光合作用的重要组成。而藻类对重金属离子极为敏感,重金属通过抑制叶绿素合成有关酶的活性,来抑制叶绿素的合成,从而影响藻类进行光合作用[17]。史庆华等[18]研究表明适量 Cu2+能提高植物叶绿素含量,而Cu2+过量时对植物产生毒性从而显著降低其叶绿素含量。一方面,FERNANDES J C等[19]研究表明Cu2+对藻类生长的影响主要是归因于引起了许多细胞学过程的故障。另外,也有研究表明,藻类的生长离不开光合作用、细胞分裂等一系列过程,任何一环节受到破坏或干扰都会导致藻类生长受阻[20-22]。本研究结果表明,蛋白核小球藻经Cu2+长期暴露后,低浓度组在短时间内可较为明显地促进叶绿素含量生成,随后缓慢积累,产生耐受性后快速合成,于第8 d达到峰值,后随暴露延长含量逐渐下降。中高浓度组短期内受到较强抑制,待藻细胞产生耐受性后,叶绿素含量逐渐升高,于第8 d达到峰值,后随暴露延长迅速减少。其可能原因是低浓度Cu2+有助于蛋白核小球藻对于微量元素的吸收,从而促进了叶绿素a的合成,但过量的Cu2+会导致叶绿素a的分解[23]。另一方面,叶绿素a构成光合系统Ⅰ(PSⅠ)的主要反应中心,而叶绿素b构成光合系统Ⅱ(PSⅡ)的主要反应中心。因此,结果表明,在短期内低浓度Cu2+对PSⅠ的作用更明显,但经过长期暴露后Cu2+对叶绿素b的效应明显大于叶绿素a。因此,蛋白核小球藻对Cu2+毒性的耐受机制主要集中在PSⅡ。
3.3 Cu2+长期暴露与蛋白核小球藻蛋白质含量的关系
铜的毒性效应归因于活性氧自由基(包括超氧阴离子、羟自由基和过氧化氢等)的产生而引起的氧化胁迫。而氧化可使蛋清蛋白质羰基含量显著升高,平均粒径逐渐增大[24-25]。本试验结果得出,蛋白核小球藻经Cu2+暴露后,低浓度组(0.10 mg/L、0.50 mg/L)促进蛋白质合成,0.50 mg/L Cu2+的蛋白质含量在0~2 d迅速增加,后随着长期Cu2+暴露蛋白质含量缓慢增加,并于第6 d达到峰值56.64 mg/L;高浓度组(1 mg/L、2 mg/L)抑制蛋白质合成,2 mg/L Cu2+的蛋白质含量在0~2 d内减少,于第2 d减少至最小值20.81 mg/L,后随着长期Cu2+暴露蛋白质含量逐渐增长,并于第12 d达到峰值64.06 mg/L。有研究认为这是因为在低浓度Cu2+胁迫下,蛋白核小球藻为了合成更多的蛋白质来结合重金属离子以抵御Cu2+胁迫;高浓度Cu2+通过引起的氧化胁迫从而改变蛋白质的结构特性,造成蛋白质含量的降低[26-27]。
3.4 Cu2+长期暴露对蛋白核小球藻形态变化的影响
细胞外物质,包括营养物质和污染物质,都需要通过细胞膜进入细胞,而环境胁迫会造成细胞形态发生变化。MAZNAH W O W等[28]研究发现铜的毒性作用会使小球藻细胞出现溶解和破碎现象,石磊[27]研究表示,重金属对藻的毒性主要是使核酸组成发生变化,进而影响细胞生长,并缩小细胞体。本研究在试验期间观察发现,藻细胞在2 mg/L Cu2+浓度的长期(15 d)暴露后,出现形态变小、细胞饱满度低、圆润度低、出现椭圆和扁平等差异。这种藻细胞在重金属胁迫下出现干瘪的情况,可能是由于离子快速在藻细胞内部与外部交换所导致的细胞膜完整性受到损伤[29]。

