线栓法制备大鼠大脑中动脉闭塞脑缺血模型的体会
袁柳媚 卢小叶 夏云 戴雅婷 范宓 娄必丹


[摘要]线栓法制备大鼠大脑中动脉闭塞脑缺血模型因无需开颅,并且具有梗死体积相对稳定、可重复性高、可操作性强等特点,目前在国内应用广泛。该模型是公认的标准局灶性脑缺血动物模型最理想的模型之一。笔者结合实践经验和既往文献报道,从大鼠的选择、模型制备以及术后死亡、并发症的原因分析与处理等多个方面分享线栓法制备大鼠大脑中动脉闭塞脑缺血模型的体会。通过不断改进术中操作方法、及时有效地处理术后并发症引起的相关症状,提高了大鼠的术后存活率。
[关键词]线栓法;大脑中动脉闭塞;脑缺血;动物模型;大鼠
[中图分类号]R-332;R743 [文献标识码]A [文章编号]2095-0616(2022)02-0007-04
Experience of the establishment of cerebral ischemia model of middle cerebral artery occlusion in rats using suture-occluded method
YUAN Liumei1 LU Xiaoye1 XIA Yun2 DAI Yating1 FAN Mi1 LOU Bidan2
1. Hunan University of Traditional Chinese Medicine,Hunan,Changsha 410007,China;2. The First Affiliated Hospital of Hunan University of Traditional Chinese Medicine,Hunan,Changsha 410007,China
[Abstract]The cerebral ischemia model of middle cerebral artery occlusion in rats prepared by suture- occluded method is widely used in China because it does not require craniotomy and has the characteristics of relatively stable infarct volume,high repeatability and strong operability. This model is recognized as one of the most ideal models of the standard animal model of focal cerebral ischemia. Combining with practical experience and previous literature reports,the author shared the experience in preparing the cerebral ischemia model of middle cerebral artery occlusion in rats from the aspects of rat selection,model preparation,analysis and treatment of postoperative death and complications. The survival rate of rats after operation was improved by continuously improving the operation methods,timely and effectively treating the related symptoms caused by postoperative complications.
[Key words]Suture-occluded method;Middle cerebral artery occlusion;Cerebral ischemia;Animal model;Rat
腦卒中是一种致残率和病死率均较高的急性脑血管疾病,分为缺血性卒中和出血性卒中,前者的发病率显著高于后者,约占脑卒中的70%[1]。为更好地研究缺血性卒中的发病机制,评估各种干预手段和治疗方法的疗效,制作最接近于人类缺血性脑卒中的理想动物模型一直是研究者们密切关注的领域。目前,常用的局灶性脑缺血模型的制备方法主要包括电凝法、线栓法、血栓栓塞法、光化学栓塞法等[2],其中线栓法制备的大脑中动脉闭塞脑缺血(MCAO)模型使用最为广泛,已应用于40%以上的神经保护实验[3]。笔者实验过程中总共制备248只模型大鼠,结合实践经验,从以下几个方面分享线栓法制备MCAO模型的体会。
1 实验大鼠的选择
1.1 品种与性别
大鼠是脑缺血模型经常选用的实验品种,常见的品种包括Wistar大鼠、Fischer-344大鼠、Sprague-Dawley(SD)大鼠等。从血管解剖而言,Wistar大鼠由于大脑中动脉近侧大脑主动脉分支数量较多,因此其脑梗死面积变异性相对较大、脑血管变异发生率相对较高[4]。Fischer-344大鼠颈内动脉(ICA)扭曲不适宜线栓法制备大脑中动脉闭塞模型,且其蛛网膜下腔出血的发生率远高于Wistar大鼠和SD大鼠[5]。SD大鼠大脑中动脉的变异性较小,与人类的脑血管构成更为相似,梗死灶具有相对均一性[6]。
大鼠的性别对MCAO模型制备也存在一定影响,与雌激素对脑缺血的保护作用相关。研究发现雌激素可能通过抗氧化作用、增加脑血流量、阻滞兴奋性毒性损伤等机制发挥脑缺血保护作用[7]。因此笔者考虑血管解剖结构、雌激素影响,综合鼠源、价格等因素,选用SD雄性大鼠用以线栓法制备MCAO模型。
1.2 体重与月龄
SD大鼠的体重与血管的粗细相关,在体重<220 g时,血管相对较细,在制备模型过程中其对麻醉和手术创伤的耐受性较差,術中和术后的死亡率增高;体重>350 g时,其血管相对较粗,插入的线栓可能无法充分阻塞大脑中动脉,从而降低造模的成功率[8]。结合实践经验,笔者造模时选用的多为体重270~300 g的大鼠,造模效果较为满意。同时大鼠的鼠龄也是影响因素之一,当鼠龄过小或过大,其对麻醉药物和手术操作的耐受性会变差,从而影响造模的成功率[9]。因此,笔者选取2~3个月龄的大鼠用于线栓法制备该模型。
2 模型制备
2.1 手术操作与线栓的插入方式
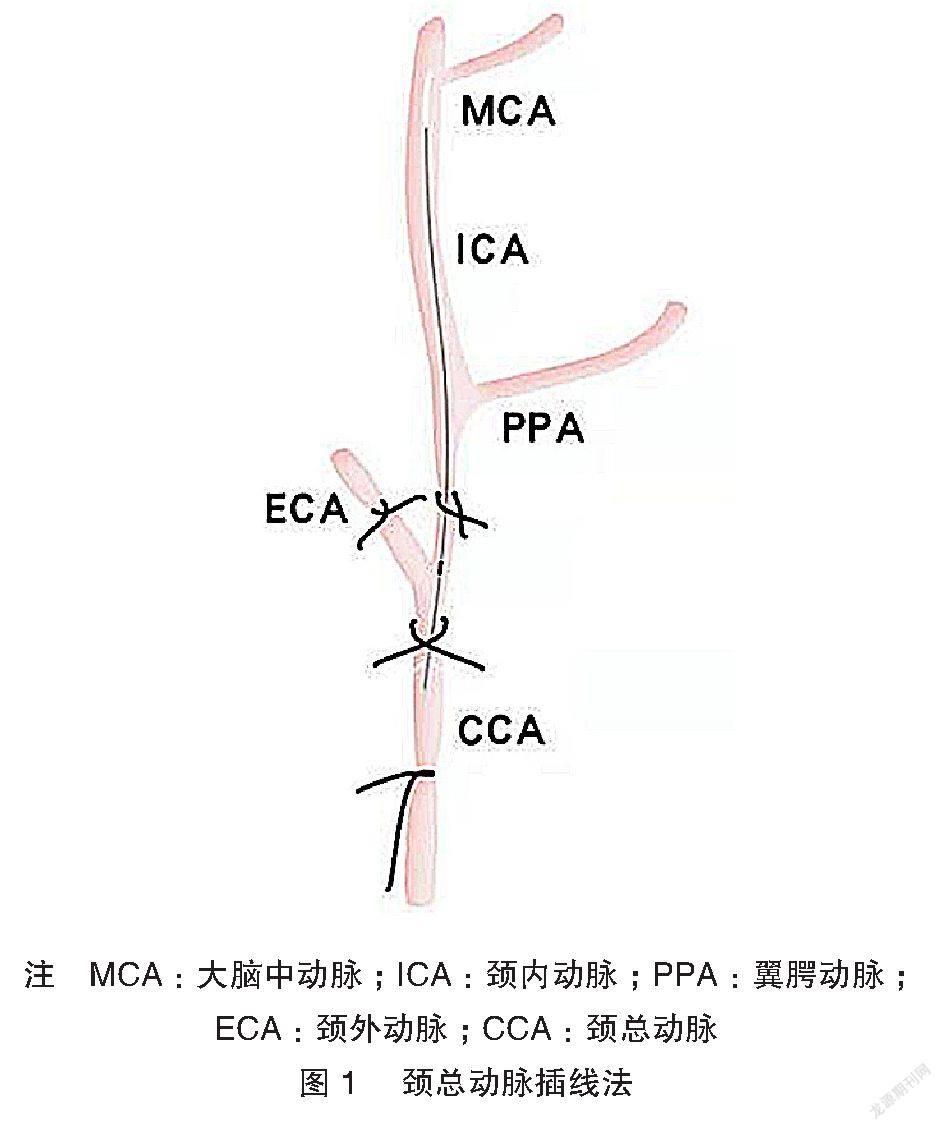
根据线栓的插入方式分为传统的颈总动脉插线法和改良的颈外动脉插线法[10]。二者的主要差别在于线栓插入的部位,前者由颈总动脉切口插入,而后者由颈外动脉切口插入,二者各有优势。相比颈总动脉插线法而言,由颈外动脉经颈总动脉分叉处插入线栓的操作难度更大,操作者难以控制线栓的走向和深度,更易误插损伤翼腭动脉,对操作者的熟练度和解剖知识的要求更高。
综上,笔者选取颈总动脉插线法,见图1。大鼠麻醉后,固定头部和四肢,以仰卧位放置于操作台上。仔细消毒后,持手术刀片沿颈部正中做一长约2 cm的切口。随后从两侧颌下腺之间剪开浅筋膜,暴露左侧胸锁乳突肌,反复钝性分离其与胸骨舌骨肌间的肌间隙,暴露左侧颈总动脉分叉所在之处,该操作过程应避免损伤气管和胸锁乳突肌等组织。然后沿左侧颈总动脉分叉处向心脏方向分离颈总动脉(CCA),并对其伴行的迷走神经行钝性分离操作。笔者通过大量造模发现大鼠的迷走神经走行存在个体差异,可使用无齿的显微弯镊反复轻柔地钝性分离,能在一定程度上避免损伤迷走神经。并且CCA分离的长度不宜过短,否则之后易致线栓头滑出,增加操作难度。分离完迷走神经后,在CCA 深面放置两根细线,其中一根置于靠近CCA分叉处,打活结用以随后固定线栓,另一根细线于CCA 的近心端结扎。随后分离颈外动脉(ECA)和颈内动脉(ICA),用一条细线结扎ECA,另预备一条细线于ICA处,并用血管夹夹闭ICA。之后使用眼科剪在CCA上剪一“V”型小口,插入线栓头,将CCA分叉处的活结系紧,松紧程度以能移动线栓和松开血管夹无血液流出为度。松开血管夹的同时,迅速将线栓沿着ICA插入,阻塞大脑中动脉(MCA)。若线栓进入部分后出现阻力感,提示可能插入翼腭动脉(PPA)[11]。此时切忌继续用力插入,而应将线栓稍往后退,顺血管走行调整角度,避免插入PPA。顺利插入线栓后,将CCA分叉处的活结再次系紧以固定线栓,并结扎ICA处预备的细线。此过程应注意检查CCA、ECA均结扎完毕后再行下一步操作,避免因忘记结扎或未结扎紧血管,使得血液返流,导致术中出血过多,影响术后生存率。若出现术中出血,应保持冷静,迅速找到出血点,用血管夹夹闭,待止血后,再用生理盐水反复冲洗,保持手术视野相对清晰。若不做脑缺血再灌注模型,可剪断残留于外的线栓。缝合肌肉与皮肤,完成操作。
2.2 线栓的选择与插入的深度
线栓的制作材料、头端直径、线头的包被和形态都会影响模型制备的效果[12],因此应统一规格,尽量减少对实验的影响。笔者使用的线栓购自北京西浓科技有限公司,选用2838A5系列型号0.38 mm栓线,该系列多适用于280~330 g体重的大鼠,栓线的长度为45 mm,头端直径(0.38±0.02)mm。使用该栓线制备的MCAO模型具有梗死面积相对稳定、症状较重的特点,适用于短时间的急性期研究。笔者通过实验发现使用该栓线能缩短实验时间、提高模型成功率、且脑梗死面积相对均一,符合模型制备的需求。
造模过程的核心环节为插入线栓,而线栓的插入深度是决定造模是否成功的关键。综合国内大多文献,对于体重250~300 g的大鼠,以超过颈总动脉分叉处18~20 mm为较为适宜的线栓插入深度,稍有阻力感即止。胡华等[13]认为当线栓插入深度为10~15 mm时,大鼠无明显的神经功能缺损;线栓插入深度为18~22 mm时,存在明显的神经功能缺损症状;而线栓插入深度>22 mm时,大鼠极易昏迷不醒。笔者在操作中发现,插入线栓的深度以超过颈总动脉分叉处18~19 mm为宜,而2838A5系列型号栓线的黑色标记处距线头为19~20 mm(±0.5 mm),故黑色标记进入颈总动脉分叉附近即停止插入。
3 术后死亡、并发症发生的原因分析与处理
3.1 死亡原因分析
笔者在实验中发现,第一批总共造模104只大鼠,死亡31只,死亡率为29.81%。其中造模手术当天死亡的大鼠为9只,占死亡总数的29.03%;术后第1~3天死亡的大鼠为13只,占死亡总数的41.94%。由此可知,MCAO模型的大鼠出现死亡的高峰期在术后的前3 d。分析其原因,蛛网膜下腔出血死亡的大鼠10只,继发性脑水肿6只,失血性休克、窒息各3只,麻药过量、营养不良各2只,未查明死因5只,见表1。①蛛网膜下腔出血:是最常见的死亡原因。操作者插入线栓的深度过深,插入线栓时力度过猛,均可导致蛛网膜下腔出血,因此要求操作者在线栓插入的操作过程中手法一定要轻柔,严格把握线栓的插入深度;②继发性脑水肿:也是常见的死亡原因之一。当大脑中动脉阻塞后,脑组织处于急性缺血缺氧的状态,血脑屏障遭到破坏,毛细血管通透性增加,致使水分子大量外渗,发生脑水肿[14-15];③失血性休克:术中操作失误,手术时间过长,可导致大鼠术中失血过多,发生失血性休克而亡。笔者在实验操作中发现,剪颈总动脉切口前,检查并确保颈总动脉、颈外动脉结扎固定到位,操作中避免反复多次插入线栓,可有效降低术中出血风险;④窒息:术中若不慎损伤气管或迷走神经,可导致呼吸抑制,呼吸道产生大量的分泌物而致窒息。操作时避开气管,将迷走神经完好分离,可有效避免大鼠因窒息而亡;⑤麻药过量:大鼠对麻药的敏感性和耐受性具有个体差异,麻药过量也会致使大鼠术后无法苏醒。故笔者实验时在麻醉前进行称重,并严格根据大鼠的体重予以10%的水合氯醛按照3~4 ml/kg的剂量进行腹腔注射;⑥营养不良:因术后营养不良死亡的大鼠多发生在术后1周以上,可采用10%葡萄糖按10 ml/kg剂量灌胃,1次/d。
经过上述改进后,在接下来的实验中共造模大鼠144只,死亡23只,死亡率下降至15.97%。其中蛛网膜下腔出血7只,继发性脑水肿5只,失血性休克、窒息各2只,麻药过量、营养不良各1只,死因不明5只。见表1。存活率第一批大鼠为70.19%,第二批大鼠为84.03%,两批大鼠比较差异有统计学意义(P<0.05)。见表2。
3.2 并发症发生原因分析及处理
在实验过程中,248只大鼠出现并发症的共70只,占造模总数的28.23%。其中出现腹泻的大鼠为41只,发生率为16.53%;阴茎水肿14只,发生率为5.65%;眼睛充血红肿32只,发生率为12.90%;继发性癫痫7只,发生率为2.82%。①腹泻:其原因一是腹腔注射水合氯醛对大鼠的胃肠黏膜有刺激作用;二是脑缺血后引起胃肠黏膜缺血。对于腹泻大鼠,应立即予以络合碘及生理盐水抹洗大鼠肛周,同时勤换垫料,保持干净的饲养环境。②阴茎水肿:可予以生理盐水反复冲洗大鼠的生殖器周围,保持生殖器清洁。③眼睛充血红肿:部分大鼠造模成功后,会出现眼部充血红肿,眼眵增多等症状。可能是因为线栓在插入过程中误入翼腭动脉引起的。笔者予以生理盐水清理眼部,并使用红霉素软膏涂抹眼周,1~3次/d,有效地改善了眼部相关症状。④术后护理:为减少感染的发生率,术后可预防性使用青霉素注射液,在大鼠大腿肌肉丰厚处行肌内注射。并使用生理盐水和络合碘清理大鼠颈部手术切口缝合处,取少量青霉素粉涂抹。另外术后大鼠体温较低,可将其放置于保温箱直至苏醒,苏醒后放置于维温22~25℃的动物饲养房内单笼饲养,避免其他大鼠挤压和踩踏影响伤口愈合,减少術后缝合伤口的感染率。采取以上措施能够有效改善模型大鼠并发症发生所带来的症状,提高大鼠的术后存活率。
4 总结与体会
提高大鼠MCAO模型的存活率一直备受关注。线栓法制备大鼠MCAO模型不需要开颅,能避免开颅所带来的一系列风险和损伤;且操作者可根据课题实验目的,设定线栓的插入深度、线栓取出与否以及线栓的保留时间,也方便脑缺血再灌注模型的建立。它同时具备梗死面积相对稳定、可重复性高、可操作性强等特点,因此是较为常用的方法。但因模型制备过程中诸多因素可造成大鼠的死亡或引发并发症而影响研究的开展,故笔者将实验过程中提升大鼠存活率、改善并发症的经验予以分享,以期为科研工作的顺利进行提供参考。
[参考文献]
[1]蔺文娟,吴松笛.IncRNA与缺血性脑卒中相关分子机制的研究进展[J].中风与神经疾病杂志,2020,37 (8):756-759.
[2] TrotmanLucas Melissa,Gibson Claire L. A review of experimental models of focal cerebral ischemia focusing on the middle cerebral artery occlusion model[J].F1000 Research,2021,10:242.
[3] Ma R,Xie Q,Li Y,et al.Animal models of cerebral ischemia:A review[J].Biomedicine & Pharmacotherapy,2020,131:110686.
[4]王琮,陈宇,张阿龙,等.局灶性脑缺血动物模型制作方法研究进展[J].齐齐哈尔医学院学报,2021,42 (6):506-509.
[5] Dittmar MS,Vatankhah B,Fehm NP,et al. Fischer-344 rats are unsuitable for the MCAO filament model due to their cerebrovascular anatomy[J].Journal of Neuroscience Methods,2006,156(1-2):50-54.
[6]林军,李艳芳,李冲,等.线栓法大鼠MCAO模型制作的要点及经验总结[J].医学综述,2018,24(17):3398-3402,3408.
[7]任北大,程发峰,王雪茜,等.雌激素对缺血性脑卒中的保护作用及相关机制研究进展[J].医学综述,2019,25(2):215-221,226.
[8]袁洪霞,朱世杰,石国凤,等.线栓法大鼠局灶性脑缺血模型制备研究进展[J].现代医药卫生,2019,35 (5):677-678.
[9]俞璐,曹晓华,赵政,等.线栓法制备大鼠大脑中动脉脑缺血模型的改进与经验探讨[J].神经损伤与功能重建,2018,13 (2):79-81.
[10]王文秀,张普,刘倩,等.改良线栓法与传统线栓法制备MCAO大鼠模型20天存活率的比较[J].西部中医药,2020,33 (4):42-44.
[11]马雁鸿,蒋佳,刘蕾,等.线栓法制备MCAO大鼠模型过程中相关影响因素探析[J].辽宁中医杂志,2020,47(4):186-188.
[12]潘洲佳,顾佳楠,谢竹青,等.脑缺血再灌注模型制作方法的研究进展[J].医学综述,2019,25 (14):2801-2805.
[13]胡华,刘杰,张燕辉,等.线栓法制作大鼠大脑中动脉梗死模型的体会与造模失败原因分析[J]. 中西医结合心脑血管病杂志,2018,16(10):1359-1361.
[14]张立娜,陈丽霞.缺血性脑水肿分子机制及脑水肿监测研究现状[J].卒中与神经疾病,2020 ,27 (4):546-548.
[15] 丁小军,杨宏,周翠翠,等.高频超声联合磁敏感成像诊断早产儿脑损伤的临床价值[J].中国当代医药,2021,28(13):152-155.

