二苯乙烯苷对阿尔茨海默病小鼠CDK5、MAPK1、PP1的调控作用
吴文雪 苏彦兆 李振中 刘超宇 蒙婉莹 黄健 朱晓莹 刘家碧 刘东明 黄忠仕
(1右江民族医学院基础医学院,广西 百色 533000;2广西中医药大学药学院;右江民族医学院 3药学院;4临床医学院;5文山州人民医院肿瘤科放疗中心)
阿尔茨海默病(AD)发病早期以进行性认知功能障碍为主要表现,随着病情进展还可表现为冷漠、幻想、狂躁等精神问题〔1〕。AD发病机制尚未完全清楚,研究表明AD发病机制与Tau蛋白过度磷酸化密切相关,如何最大限度抑制Tau蛋白过度磷酸化被认为是治疗AD的关键〔2,3〕。
二苯乙烯苷(TSG)具有抗炎、抗衰老、抗凋亡、增长记忆和清除自由基等功效〔4〕,研究表明TSG能延缓退行性神经疾病〔5,6〕,细胞周期蛋白依赖性激酶(CDK)5、细胞外蛋白调节激酶(MAPK)1、蛋白磷酸酶(PP)1参与Tau蛋白的异常磷酸化〔7~9〕,因此CDK5、MAPK1、PP1表达水平可能与AD的发病机制有关。但TSG能否在动物水平通过影响CDK5、MAPK1及PP1,调控AD小鼠Tau蛋白磷酸化水平达到抗AD的目的尚未见报道,本研究以淀粉样前体蛋白(APP)/早老蛋白(PS)1/Tau三转基因(3×Tg)-AD小鼠为研究对象,探讨TSG抗AD的可能机制。
1 材料与方法
1.1实验材料 SPF级雄性3×Tg-AD小鼠45只购自美国Jackson Laboratory(健康证书编号:1911A18008),6周龄,体重(25.02±0.20)g;相近遗传背景的SPF级雄性小鼠C57BL/6J 9只购自长沙市天勤生物技术有限公司〔生产许可证号:SCXK(湘)2019-0011〕,6周龄,体重(25.20±0.16)g;TSG购自成都克洛玛生物科技有限公司〔批号CHB180810,纯度≥70%〕;阳性药即石杉碱甲片购自辰欣药业股份有限公司(批号国药准字H20093133,50 μg/片);CDK5抗体(批号:00041207)、MAPK1抗体(批号:00077469)、PP1抗体(批号:10008903)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号:00083125)、抗鼠/兔通用型免疫组化检测试剂盒(批号:30202004)、山羊抗小鼠IgG二抗(批号:20000175)及山羊抗兔IgG二抗(批号:20000174)均购美国Proteinech Group公司;β-actin抗体(批号:UD277186)购自美国Invitrogen公司;P39抗体(批号:AG08022014)购自北京博奥森生物技术有限公司;Omini-ECLTM超灵敏感化学发光检测试剂盒(批号:02391063)、二喹啉甲酸(BCA)蛋白定量试剂盒(批号:013B1050)、牛血清白蛋白(BSA,批号:013C1028)均购自雅酶品牌;高效放射免疫沉淀试验(RIPA)裂解液(批号:20190922)购自美国Solarbio公司。
1.2方法
1.2.1动物分组与给药 所有小鼠统一饲养于广西百色右江民族医学院SPF级别动物实验中心,8月龄开始给药处理,SPF级别实验室提供的环境为:室温20~25℃,湿度55%~75%,小鼠自由进食、饮水。将45只8月龄3×Tg-AD小鼠随机分成5组:模型组(生理盐水),阳性对照组(石杉碱甲,0.150 mg/kg),TSG低剂量组(TSG,0.033 g/kg),TSG中剂量组(TSG,0.100 g/kg),TSG高剂量组(TSG,0.300 g/kg),再选取C57BL/6J雄性小鼠9只作为正常对照组(生理盐水),灌胃容积均为10 ml/kg;1次/d,连续给药60 d,本研究药物的剂量使用参考本课题前期已发表文献的数据〔10〕。本研究经医院伦理委员会审批,实验过程中对动物的处置符合《关于善待实验动物的指导性意见》宗旨。
1.2.2免疫组织化学(IHC)染色 小鼠颈椎脱臼处死,冰上操作取出整个大脑,常规固定、脱水、包埋、石蜡切片(厚度4 μm)、烤片,常规脱蜡、高压修复2 min冷却至室温,3%过氧化氢封闭10 min,磷酸盐缓冲液(PBS)冲洗5 min,重复3次,血清封闭1 h,P39一抗(1∶400)4℃过夜,PBS冲洗5 min,重复3次,二抗室温孵育30 min,二氨基联苯胺(DAB)显色1 min加PBS冲洗终止反应。常规复染、脱水、透明、封片后用正置荧光显微镜观察并拍照,观察各组大脑皮层、海马P39蛋白表达水平。
1.2.3实时荧光定量-聚合酶链反应(qRT-PCR) 迅速处死小鼠,冰上操作取出整个大脑保存于液氮,脑组织用液氮研磨,参照AxyPrep总RNA小量制备试剂盒说明书提取RNA,提取的 RNA按试剂盒步骤进行去DNA和逆转录,采用两步法以qRT-PCR仪进行扩增。反应体系(共20 μl):上/下引物各1 μl、模板cDNA2 μl、通用型快速反应SYBR绿色荧光染料混合物10 μl、无酶水6 μl。反应条件:95℃预变性600 s;95℃变性10 s,60℃延伸30 s,共40个循环。以GAPDH 为内参,采用2-ΔΔCt法计算各目的mRNA的相对表达量。CDK5上游引物:5′-CCCTGAGATTGTGAAGTCATTCC-3′,下游引物:5′-CCAATTTCAACTCCCCATTCCT-3′;MAPK1上游引物:5′-TTGCTTTCTCTCCCGCACAAA-3′,下游引物:5′-AGAGCCTGTTCAACTTCAATCC-3′;PP1上游引物:5′-AGAGAACGAGATCCGTGGTCT-3′,下游引物:5′-ACAGCCGTAGAAGGTCATAGT-3′;GAPDH上游引物:5′-GGTTGTCTCCTGCGACTTCA-3′,下游引物:5′-TGGTCCAGGGTTTCTTACTCC-3′。
1.2.4Western印迹 标本取材及保存同1.2.3,使用液氮研磨脑组织,按照每200 mg脑组织加蛋白裂解液(RIPA裂解液、蛋白酶抑制剂按体积比100∶1)2 ml于冰上充分裂解30 min,4℃ 12 000 r/min离心5 min,收集上清液,用 BCA法测定蛋白浓度后,再用5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液稀释,于95~100℃变性6 min存放于-80℃。按每孔上样量80 μg组织提取液行SDS-PAGE,然后在180 mA、室温条件转移60 min至NC膜上;将膜置于QuickBlockTMWestern封闭液中,摇床上振摇10 min封闭;TBST洗3次,10 min/次,然后分别加入CDK5(稀释比例均为 1∶1 000)、MAPK1(稀释比例均为 1∶2 000)、PP1和β-actin(稀释比例均为1∶5 000)、GAPDH(稀释比例为 1∶6 000)于4℃孵育过夜;以TBST 洗3次,10 min/次,加入相应的二抗(稀释比例均为1∶5 000),4℃ 避光环境振摇1 h,再次用TBST洗3次后,以超灵化学发光液进行发光显色,采用ImageJ v1.8.0版本软件测定条带灰度值。其中CDK5和MAPK1以GAPDH为内参,PP1以β-actin为内参,统计目的蛋白条带与内参蛋白条带吸光度的比值表示目的蛋白的表达水平。
1.3统计学方法 采用SPSS 22.0软件进行单因素方差分析及t检验。
2 结 果
2.1各组大脑皮层及海马区P39 IHC染色 正常对照组大脑皮层、海马区有少量P39表达,阳性反应物颜色较浅;与正常对照组比较,模型组P39广泛表达于大脑皮层及海马区,阳性反应物染色深;与模型组比较,阳性对照组及TSG各剂量组P39较少表达于大脑皮层及海马区,阳性反应物染色较浅;与阳性对照组比较,TSG各剂量组P39表达于大脑皮层及海马区的量无明显变化,阳性反应物染色无明显变化,见图1、图2。
2.2qRT-PCR检测各组阳性神经元细胞 与正常对照组比较,其余各组海马区、大脑皮层P39平均光密度值和阳性神经元细胞总数目显著增多(P<0.05);与模型组比较,阳性对照组及TSG各剂量组海马区、大脑皮层P39平均光密度值和阳性神经元细胞总数目显著降低(P<0.05);与阳性对照组比较,TSG高剂量组大脑皮层、海马区P39阳性细胞总数目显著降低(P<0.05),见表1。
2.3各组CDK5、MAPK1及PP1 mRNA表达 与正常对照组比较,其余各组CDK5、MAPK1 mRNA转录水平显著增高(P<0.05),PP1 mRNA转录水平显著降低(P<0.05);与模型组比较,TSG各剂量组CDK5 mRNA转录水平显著降低(P<0.05),阳性对照组及TSG各剂量组MAPK1 mRNA转录水平显著降低(P<0.05),TSG各剂量组PP1 mRNA转录水平显著增高(P<0.05);与阳性对照组比较,TSG高剂量组CDK5 mRNA转录水平显著降低(P<0.05),TSG高剂量组PP1 mRNA转录水平显著增高(P<0.05),见表2。
2.4各组CDK5、MAPK1及PP1蛋白表达 与正常对照组相比,其余各组CDK5、MAPK1蛋白表达显著增高(P<0.05),PP1蛋白表达显著降低(P<0.05);与模型组比较,阳性对照组及TSG各剂量组CDK5、MAPK1蛋白表达显著降低,PP1蛋白表达显著增高(P<0.05);与阳性对照组比较,TSG高剂量组MAPK1蛋白显著降低(P<0.05),TSG中、高剂量组PP1蛋白表达显著增高(P<0.05),见表2、图3。

图1 各组大脑皮层P39表达(IHC,×400)
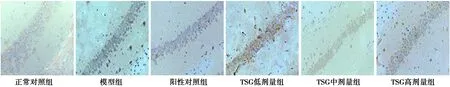
图2 各组海马区P39表达(IHC,×400)

表1 P39的光密度和IHC阳性神经元细胞表达

表2 各组CDK5、MAPK1及PP1 mRNA及蛋白表达

1~6 : 正常对照组,模型组,阳性对照组,TSG低剂量组,TSG中剂量组,TSG高剂量组图3 各组CDK5、MAPK1和PP1蛋白表达
3 讨 论
AD主要病理特点为细胞内Tau蛋白异常磷酸化聚集、细胞外β淀粉样蛋白(Aβ)沉积伴随一定数量突触及神经元的丢失〔11,12〕。TSG是名贵药材何首乌提取物的主要活性成分之一,其因抗炎、抗衰老等重要功效在各种退行性疾病中有极高的应用价值〔13,14〕,前期研究表明TSG有良好的抗AD作用〔10〕。
CDK5和MAPK1在参与调控神经细胞的迁移、生长等方面都有重要作用〔15〕。P39作为CDK5依赖激活剂,在参与CDK5调控神经细胞分化、髓鞘修复等生理功能发挥重要作用〔15〕。Tau的重要生理功能是协助微管蛋白组装到微管和维持微管的稳定。病理情况下,过度磷酸化Tau蛋白可通过异常构象增加自我聚集的能力,阻碍神经元的传输系统,加重AD〔16〕。PP1作为蛋白磷酸酶家族中的重要一员,参与机体的去磷酸化反应,Oliveira等〔9〕研究发现PP1的活化增强可降低神经元Tau蛋白的磷酸化水平。生理情况下,Tau蛋白在蛋白激酶和蛋白磷酸酶的相互调节下处于磷酸化和去磷酸化的动态平衡状态,当蛋白激酶表达上调和(或)蛋白磷酸酶下调时这种平衡会被打破,表现为AD〔17〕。本研究结果发现给予TSG低、中、高剂量处理后小鼠的MAPK1、CDK5和P39蛋白同模型组比较显著下调,这与研究〔18,19〕结果一致;给予TSG低、中、高剂量处理后小鼠的PP1蛋白同模型组比较显著上调。结果表明TSG对3×Tg-AD小鼠具有一定的改善作用。
综上,本研究证实TSG对3×Tg-AD小鼠具备一定改善作用,其作用机制可能与下调CDK5和MAPK1转录和表达、上调PP1转录与表达,抑制Tau蛋白磷酸化有关。

