低氧对非小细胞肺癌PDHA1、GBP1表达及细胞增殖的影响
曹静 楚天骄 班振英 张威 智艳芳 曾宪旭
(郑州大学第三附属医院病理科,河南 郑州 450052)
肺癌最常见的组织学类型为非小细胞肺癌(NSCLC),5年生存率仅40%左右。NSCLC的发病机制非常复杂,与多种分子异常、环境及遗传因素密切相关〔1〕。低氧是肿瘤普遍存在的微环境,低氧与代谢重编程互为因果促进了肿瘤的进展。肿瘤细胞糖代谢的特点是优先选择糖酵解,而回避氧化磷酸化的代谢模式。既往研究发现,抑制丙酮酸脱氢酶E1α亚单位(PDHA1)的表达能促进糖酵解〔2〕。 鸟苷酸结合蛋白(GBP)1是干扰素(IFN)-γ诱导下释放出的活性物,主要作用是抵抗各种病原体入侵〔3〕。大多数关于GBP1的研究集中在炎症疾病上,仅有少数研究证实GBP1与肿瘤相关。本研究拟分析低氧对NSCLC患者PDHA1、GBP1表达及细胞增殖的影响。
1 材料与方法
1.1实验材料 选取20例配对的肺癌组织及癌旁组织,其中临床分期Ⅰ、Ⅱ期(早期癌)12例,Ⅳ期(晚期癌)8例。肺鳞癌细胞株LC-42及肺腺癌细胞株SELS均来源于挪威奥斯陆大学肿瘤研究实验室冻存株。PDHA1抗体为Cell Signaling Technology公司生产,GBP1抗体为Novus Biologicals公司生产。主要仪器:Xvivo Closed Incubation System由美国Bio Spherix公司制造,细胞培养时可以准确调节不同含氧量。
1.2方法 肺鳞癌LC-42及肺腺癌SELS细胞株各自分别在常氧及低氧条件下培养。常氧培养:CO2培养箱的设定条件是37℃、20%O2、5%CO2、75%N2,饱和湿度。低氧培养:常氧培养24 h,待细胞贴壁,转移至Xvivo Closed Incubation System低氧培养48 h,即设定条件是37℃、1%O2、5%CO2、94%N2,饱和湿度。
1.3Western印迹 肺癌组织及细胞经过蛋白提取、蛋白测定及处理、聚丙烯酰胺凝胶电泳、转膜、封闭,最后一抗及二抗孵育、曝光,实验重复6次。
1.4RT-PCR 两种细胞系分别常氧及低氧处理后,通过胰蛋白酶消化细胞并提取RNA。根据TaKaRa逆转录试剂盒步骤反转录合成cDNA。冰上配制Template DNA/cDNA 2 μl 、RNase-free ddH2O 10 μl,10倍缓冲液3.0 μl,Taq 0.2 μl,dNTP 2.4 μl,上下游引物各1.0 μl。PCR在下述反应条件下进行:94℃变性30 s,56℃淬火30 s,72℃延伸30 s,35个周期,最后72℃延伸10 min。根据2-△△Ct,测出mRNA相对值,实验重复6次。
1.5CCK-8法检测低氧对细胞增殖的影响 两种细胞系分别常氧及低氧下培养48 h,调整细胞数为1×104/ml,每孔加100 μl细胞悬液,接种于96孔板中,在培养箱内常氧培养24、48、72 h,每孔加入CCK-8溶液10 μl继续培养2 h,于酶标仪检测450 nm处光密度(OD)值,细胞增殖率=(处理组OD值-空白OD值)/(对照组OD值-空白OD值)×100%。
引物序列:来源于NCBI数据库,经Primer premier5.0软件设计及BLAST检测其特异性,由TAG Copenhagen A/S公司合成。PDHA1上游引物:5′-TTCTCAGAAGCCGGCAAGC-3′,177 bp,下游列物5′-ATTCGGCGTACAGTCTGCAT-3′;GBP1上游引物:5′-TGGAACGTGTGAAAGCTGAG-3′,326 bp,下游引物:5′-TGACAGGAA GGCTCTGGTC-3′;GAPDH上游引物:5′-TGCCTCCTGCACCACCAACT-3′,423 bp,下游引物:5′-CCCGTTCAGCTCAGGGATGA-3′。
1.6统计学方法 采用SPSS19.0软件进行t检验和单因素方差分析。
2 结 果
2.1NSCLC及癌旁组织中PDHA1和GBP1蛋白表达比较 NSCLC临床分期增高,PDHA1蛋白表达减少,而GBP1蛋白表达增加,差异有统计学意义(P<0.05),见图1,表1。

图1 NSCLC与癌旁组织中PDHA1和GBP1蛋白表达
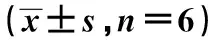
表1 NSCLC组织中PDHA1和GBP1蛋白表达
2.2低氧对肺鳞癌LC-42及肺腺癌SELS细胞系中PDHA1和GBP1蛋白表达的影响 与20%O2组相比,1%O2组PDHA1蛋白表达显著降低,而GBP1蛋白表达显著提高,差异有统计学意义(P<0.05)。见表2,图2。
2.3低氧对肺鳞癌LC-42及肺腺癌SELS细胞系中PDHA1和GBP1 mRNA表达的影响 与20%O2组相比,1%O2组PDHA1 mRNA表达显著降低,而GBP1 mRNA表达显著提高,差异有统计学意义(P<0.05)。见表2。
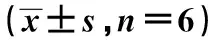
表2 肺癌两种细胞系PDHA1和GBP1蛋白及mRNA的表达
2.4CCK8法检测低氧对细胞增殖的影响 与20%O2组相比,培养24及48 h,1%O2组增殖率显著低于对照组(P<0.05),而培养72 h,两种细胞系的增殖率显著高于对照组(P<0.05)。见表3。

1~4:20%O2组LC-42、20%O2组SELS、1%O2组LC-42、1%O2组SELS图2 低氧及常氧培养两种肺癌细胞系PDHA1、GBP1蛋白表达

表3 肺癌两种细胞系细胞增殖率比较
3 讨 论
本课题组前期研究结果表明,低氧刺激前列腺癌及卵巢癌导致PDHA1表达降低,而GBP1表达增强,且提高了癌细胞干性及增殖能力。使用细胞周期抑制剂治疗前列腺癌时,存活的前列腺癌细胞会转向Warburg效应途径(糖酵解),且伴有GBP1表达上调。而且,通过对NSCLC细胞系siRNA基因沉默PDHA1及GBP1进行相应研究,发现GBP1是PDHA1的下游基因。
目前,低氧对NSCLC患者PDHA1、GBP1表达及细胞增殖影响的报道仍少见。本研究结果提示,PDHA1低表达和GBP1过表达与NSCLC进展有关。将肺鳞癌LC-42及肺腺癌SELS细胞株给予低氧培养,导致两种细胞系PDHA1蛋白及mRNA表达减少,而GBP1蛋白及mRNA表达增加。PDHA1及GBP1在体外低氧培养细胞的表达趋势,与二者在NSCLC组织中的表达规律基本一致。CCK8法检测低氧对两种细胞增殖的影响表明,培养48 h以内,低氧处理细胞增殖缓慢,培养72 h则显现出截然不同的结果,即低氧处理细胞增殖迅速。低氧虽然可以短暂抑制肿瘤增殖,但培养时间只要达到足够长,则表现为细胞增殖能力增强。内在原因可能是低氧导致肿瘤细胞糖代谢选择糖酵解的Warburg效应,而糖酵解是由PDHA1低表达触发。GBP1作为PDHA1的下游基因,则表现为GBP1过表达促进了NSCLC进展。据此推断,低氧、PDHA1低表达及GBP1高表达与NSCLC进展一脉相承,互为因果。
肿瘤细胞的社会微环境和物理微环境构成肿瘤的微环境。社会微环境是指肿瘤周围的免疫细胞、成纤维细胞、内皮细胞及细胞外基质。物理微环境是指低氧、营养压力、低pH值、氧化压力〔4〕。肿瘤细胞会随着微环境变化,代谢模式不断做出适应性调整,这种特有的代谢变化称为代谢重编程。因此,低氧是肿瘤细胞普遍存在的微环境要素之一。在低氧情况下,一些基因和蛋白的表达也会发生改变,甚至是参与了代谢重编程。肿瘤细胞吸收、利用最多的营养物质为葡萄糖,正常细胞摄取葡萄糖,经历了线粒体的氧化磷酸化进行产能,而肿瘤细胞则选择另外一种糖酵解的代谢方式。而氧化磷酸化与糖酵解转换的关键节点就是PDHA1。有学者证明PDHA1下调会促进糖酵解代谢及肿瘤进展〔5〕。
最早研究发现肿瘤细胞可对葡萄糖进行高效吸收,且相应的吸收路径为糖酵解,这种偏于糖酵解的代谢模式称为Warburg效应〔6〕。葡萄糖进行糖酵解产生丙酮酸,丙酮酸会有两种代谢途径选择:一种代谢途径是线粒体膜上的丙酮酸转运载体把丙酮酸从胞质运至线粒体基质,继而线粒体基质内包含PDHA1的丙酮酸脱氢酶复合体催化丙酮酸和CoA生成乙酰-CoA和CO2,乙酰-CoA再进入三羧酸循环进行氧化磷酸化;另一种代谢途径是丙酮酸在原来糖酵解的基础上继续代谢产生乳酸。因此,PDHA1是丙酮酸脱氢酶复合体的关键组件,连接着糖酵解和三羧酸循环,负责糖酵解和三羧酸循环之间的相互转换。当PDHA1下调,丙酮酸脱氢酶复合体活性下降,乙酰-CoA生成减少,三羧酸循环障碍,糖代谢转向糖酵解为主,Warburg效应增强,肿瘤更易侵袭及进展。而PDHA1表达正常时,糖代谢则以三羧酸循环氧化磷酸化为主〔7〕。有学者用miR-21-5p直接靶向PDHA1,抑制PDHA1表达,促进糖酵解和细胞增殖。miR-21-5p是一种MicroRNA,可绑定靶向RNA的3′端未翻译区域,导致与目的mRNA分离,蛋白翻译受阻〔8〕。PDHA1低表达预示卵巢癌、乳腺癌、大肠癌预后差〔9,10〕。GBP1为GTP酶的一种,被Ⅰ和Ⅱ型IFN诱导产生,对抗细菌、病毒及寄生虫。其后相关研究不断深入,且发现对细胞生长还具有调节作用,如通过对基质金属蛋白酶(MMP)-1 、核转录因子(NF)-κB的调控实现加速细胞增殖〔11~13〕。Yamakita等〔14〕通过RT-PCR实验显示浸润性肺腺癌GBP1表达的相对量是正常肺组织的3倍。用各种siRNA转染RERF-LC-OK细胞,沉默GBP1基因,得出划痕实验显著低于对照组。免疫组化显示浸润性肺腺癌的GBP1阳性率显著高于正常肺组织,且GBP1表达与癌组织淋巴血管侵犯正相关〔14〕。已有实验研究表明,GBP1可促进乳腺癌、胶质瘤、食管癌的形成,在癌细胞的生长中起一定调节作用。关于GBP1的潜在促肿瘤作用是目前此领域的研究重点〔15~17〕。本实验结果与其研究结果是大致相同。
PDHA1及GBP1可通过信号通路进行调节,而影响了肿瘤细胞的代谢重编程,发挥调控细胞增殖及凋亡的功能。因此,在抗肿瘤治疗中,可适当增强PDHA1及减弱GBP1的表达而抑制肿瘤生长。下一步应该研究其相关的信号通路及PDHA1、GBP1活性影响因素,从基因及物质能量代谢角度进行调控,从而有效预防NSCLC的发生,可将二者作为肿瘤治疗的新靶点,更好为患者的精确靶向治疗提供理论支持。

