基于脑-肠轴探讨补肾润肠方对老年慢传输型便秘大鼠结肠AQP3、AQP9表达的影响
左振魁 韩佳瑞 计树灵 贺露露
(1河南省中医院(河南中医药大学第二附属医院),河南 郑州 450000;2河南中医药大学)
近年来,便秘发生率逐渐增加,已成为影响人们健康的常见疾病〔1〕。结肠的传导功能出现异常,致使摄入的食物在肠道中大量贮存,或通过肠道的时间延长,从而引起慢传输型便秘〔2〕。临床治疗慢传输型便秘时,多选择泻药,症状未缓解者再予以手术,但存在药物不良反应、手术并发症等问题,效果有待于进一步提高。补肾润肠方为河南省中医院治疗慢传输型便秘的协定方,由经典方剂简化改进而来,补肾润肠方对慢传输型便秘患者病情的改善效果显著,但其机制仍不明确。现代研究发现中枢神经系统、肠神经系统及椎前神经节共同对胃肠运动阐释调控作用,脑部中枢系统、脊髓是接收信息及整合信息的重要器官,通过神经-内分泌系统及自主神经系统对调控信息进行传输,使其进入肠神经系统,并对胃肠效应细胞产生调控作用,促使胃肠道充分使用内部环境、外部环境的变化,从而促使其生理功能的实现〔3〕。此连接中枢神经系统、胃肠道系统的神经-内分泌网络即为脑-肠轴,于肠道功能的调控中,脑-肠轴的双相信号传导功能尤其关键〔4〕。本研究基于脑-肠轴探讨补肾润肠方对慢传输型便秘水通道蛋白(AQP)3、AQP9的作用机制。
1 材料与方法
1.1动物与材料 选取85只成年健康SPF级SD大鼠,均由上海杰思捷实验动物有限公司提供,18~20月龄,体重200~220 g,均在相同条件下进行饲养,温度20~25℃,湿度50%~65%,且在饲养期间保证12 h的光暗条件循环,本研究已获得动物伦理委员会批准。补肾润肠方剂:熟地黄、白术及山茱萸各20 g,肉苁蓉、瓜蒌仁、怀牛膝、火麻仁、当归、莱菔子、何首乌、杏仁及枳壳各15 g,为保证饮片的质量,由同仁堂有限公司药师对研究用药进行鉴定,且均证实为正品。伊托必利(山东信谊制药,H37023049),复方聚乙二醇电解质散〔舒泰神(北京)生物制药,H20040034〕;苏木素(北京索莱宝科技有限公司,H8070),二氨基联苯胺显色试剂盒(武汉博士德生物工程有限公司,ZLI-9032),由英国Abcam公司提供AQP3兔多克隆抗体;由SantaCruz公司提供AQP9兔多克隆抗体及目的基因一抗;由Epigentek集团公司提供山羊抗兔二抗;总RNA抽提试剂(美国Invitrogen公司,16596-026);β-actin鼠单克隆抗体(英国Abcam公司,ab8226)。
1.2仪器 BX50型光学显微镜(OLYMPUS),902ULTS型-80℃冰箱(美国Thermo),Thermo3111型CO2培养箱(美国Thermo),5804R型离心机(德国Eppendorf),EG1160型包埋机(LEICA),RM2245型切片机(LEICA),由美国Bio-Rad公司提供CFX96型实时荧光定量聚合酶链反应(PCR)扩增仪;由北京六一仪器厂提供DYCZ-25D型电泳仪、DYCZ-40G型转膜仪;由美谷分子仪器有限公司(上海)提供SpectraMaxiD5型多功能酶标仪;由日本Olympus公司提供FV1200型激光共聚焦显微镜;由美国Bio-Rad公司提供UniversalHoodⅢ型凝胶图像成像分析系统。
1.3分组和造模 对大鼠进行为期1 w的适应性饲养,将其随机分为空白组(10只)及造模组(75只),选择复方地芬诺酯进行造模,使用15 mg/(kg·d)复方地芬诺酯进行灌胃,在灌胃1个月后建立慢传输型便秘模型〔5〕。大鼠在2 w内出现明显便秘症状。与空白组相比,模型组体重明显减轻,24 h粪便数量明显减少,粪便含水量也减少,说明成功复制大鼠模型。剔除造模失败大鼠,将造模成功的大鼠(50只)进行二次分组,分为模型组、伊托必利组和补肾润肠方低、中、高剂量组各10只。
1.4给药 补肾润肠方剂 药液制作方法:将药材置于砂锅内,加2 000 ml水浸泡30 min,煎煮60 min后取汁200 ml,再次加水、浸泡后煎煮,取汁200 ml,充分混匀2次取得的药液400 ml,采用减压浓缩法,将补肾润肠方液汤浓缩为浓度为2.2 g/ml的药液,计算出药量为高剂量组33.2 g/(kg·d)、中剂量组16.6 g/(kg·d)、低剂量组8.8 g/(kg·d)。根据相关文献记载进行伊托必利药物剂量选择〔6〕,根据人和动物体表面积折算方法对大鼠用药剂量进行换算,确定各组大鼠用药剂量,即伊托必利组按50 mg/kg剂量灌胃,补肾润肠方低、中、高剂量组分别按相应剂量灌胃,空白组及模型组进行等体积生理盐水灌胃,各组灌胃1次/d,持续干预1个月。
1.5标本制备方法 ①结肠组织。在完成干预后统一颈椎脱臼处死大鼠,处死前禁食24 h,将大鼠腹部切开,确定胃底位置,然后由幽门位置将肠管捋出并摘除,摘除范围为幽门至直肠末端肛管上方,然后根据肠管位置不同分别截取近端及远端结肠各3 cm,将结肠组织均分为3段,对结肠内污物采用生理盐水进行清洗,然后再使用磷酸盐缓冲液(PBS)进一步清洗,随机选取其中一节肠管使用浓度为10%的多聚甲醛进行固定处理,将剩余两节肠管放置于冰箱中保存,温度设置为-80℃。②脑组织。于大鼠枕骨大孔进刀,将颅骨切开后,去除头顶骨,并将视神经剪断,取出脑组织,用人工脑脊液对表面血液进行冲洗,并以滤纸将残留血液吸除。于冰盘上对大脑组织进行剥离,提取前额叶皮质、下丘脑、海马及纹状体,放入1.5 ml Eppendorf离心管中,存储于-80℃冰箱内待检。
1.6苏木素-伊红(HE)染色及免疫组化检测AQP3、AQP9表达 ①HE染色:脱蜡。于4%多聚甲醛中置入1段结肠,予以固定24 h后,石蜡包埋切片,水化。于二甲苯中予以浸泡15 min,连续2次后,依次以梯度乙醇及纯水浸泡,各5 min,连续2次。染色。以苏木素进行初染,冲洗,伊红复染,依次以梯度乙醇及纯水浸泡,各2 min,再予以二甲苯透明处理2 min后,中性树胶进行封片,于光镜镜头下进行检查。②免疫组化:取HE染色的组织块,4 μm切片,切片按照顺序电烤箱1 h,在二甲苯Ⅰ和Ⅱ中浸泡10 min,然后依次放在梯度酒精5 min×2次,随后用PBS(pH7.4)冲洗2 min×3次,浸入枸橼酸盐缓冲液内,20 min后PBS冲洗5 min×3次,在切片上滴加浓度为10%的正常山羊血清封闭液,进行15 min孵育,温度设置为37℃。滴加一抗(按照1∶100稀释),孵育过夜,PBS冲洗3次。滴加二抗(IgG),PBS冲洗3次,用二氨基联苯胺(DAB)显色,镜下观察染色程度,将其置入苏木素溶液中,分化使用盐酸乙醇,常规进行脱水、透明及封片等处理,然后在镜下观察,通过Motic3000显微镜观察。
1.7Western印迹检测AQP3、AQP9蛋白表达 对蛋白浓度进行调整,相同后添加缓冲液,加热至100℃,维持沸腾状态10 min,在制胶架上展开分离胶制作,将电泳缓冲液加入其中,条带分离达到最佳状态时即可停止电泳。对转膜液进行4℃预冷处理,转膜90 min后,将聚偏氟乙烯膜取出并做标记,以TBST洗膜10 min,连续3次。将封闭液加入至封闭盒内,震荡60 min,于装有AQP3、AQP9Ⅰ抗的孵育盒内添加聚偏氟乙烯膜,置于4℃环境中过夜。以TBST洗膜10 min,连续3次,稀释Ⅱ抗,再以TBST洗膜10 min,连续3次。于暗室对包含蛋白质的聚偏氟乙烯膜进行曝光处理。
1.8高效液相-电化学检测仪对大鼠脑区神经递质的含量 于0.5 ml预冷工作内标液中加入待测脑组织,在冰浴条件下以电动微量匀浆器展开快速匀浆,予以静置10 min后,于4℃环境中予以14 000 r/min×15 min离心,取上清液后以Millipore 0.22 μm针头式过滤器进行过滤。色谱条件为:①预柱:ESAHR-80,8.0 cm×4.6 cm;②流动相:10%乙腈、1.7 mmol/L1-辛烷磺酸钠、pH=3、90 mmol/L磷酸二氢钠、50 μmol/L乙二胺四乙酸、50 mmol/L柠檬酸;③色谱柱:ESAMD-150(3.2 mm×150 mm);④流速:0.66 ml/min;⑤柱温:30℃;⑥进样量:20 μl;⑦电势:共4道,分别是150、500、200、350 mV。
1.9实时荧光定量PCR检测结肠细胞AQP3、AQP9 mRNA表达 提取结肠中的mRNA采用Trizol法进行,严格参照说明书操作,用核酸蛋白仪对总mRNA提取后的纯度进行检测,纯度在1.8~2.0时为合格,进行逆转录合成,按照TaKaRa逆转录试剂盒操作要求进行,各种试剂添加均严格按照SYBRPremixExTaqTM试剂盒说明书进行,基因扩增在PCR仪中完成,反应条件设置为温度95℃,反应时间为10 min,然后95℃,反应10 s,最后60℃,反应30 s,共进行40个循环,然后温度95℃,反应15 s,温度75℃,反应15 s,温度设置为75℃,反应30 s。对PCR过程中各组样本中的Ct值进行分析,mRNA相对表达水平采用2-△△Ct表示。光密度值采用酶标仪进行测定,内参β-actin及AQP9、AQP3引物序列为:β-actin:上游:5′-GAAGATCAAGATCATTGCTC CT-3′,下游:5′-TACTCCTGCTTGCTGATCCA-3′;AQP3:上游:5′-GTTCCGTGGCTCAAGTGGTGCTCAG-3′,下游:5′-GCAGGGTTCAAG TGGGCTCCAGACA-3′;AQP9:上游:5′-TCGGCAGT CGTGATGGCTCTCTATGA-3′,下游:5′-AGGCACCTGGCGTGGATATGAATGGA-3′。
1.10统计学方法 采用SPSS19.0软件进行单因素方差分析(One-WayANOVA),方差齐则采用LSD-t检验,方差不齐则采用TamhaneT2检验。
2 结 果
2.1老年慢传输型便秘大鼠AQP3及AQP9光密度表达 AQP3呈现带状条形规律分布,主要分布位置为大鼠近端结肠组织黏膜顶部吸收细胞的质膜顶部(腔面)上,阳性染色为棕黄色;AQP9同样呈现条带状规律分布,主要分布在大鼠远端结肠组织黏膜的杯状细胞上,染色为棕黄色。与空白组相比,模型组AQP3、AQP9光密度值明显升高(P<0.05),与模型组相比,伊托必利组、补肾润肠方低、中、高剂量组AQP3、AQP9光密度值明显降低(P<0.05),与伊托必利组相比,补肾润肠方低、高剂量组AQP3、AQP9光密度值明显升高(P<0.05),而补肾润肠方中剂量AQP3、AQP9光密度值无明显差异(P>0.05),见图1、表1。

图1 各组AQP3、AQP9光密度表达(HE染色,×400)

表1 各组AQP3及AQP9光密度比较
2.2各组结肠组织AQP3、AQP9蛋白及mRNA表达 与空白组相比,模型组AQP3、AQP9蛋白及mRNA表达均明显升高(P<0.05),与模型组相比,伊托必利组、补肾润肠方高剂量组AQP3、AQP9蛋白及mRNA表达均明显降低(P<0.05),补肾润肠方低、中剂量组AQP3、AQP9蛋白及mRNA表达均降低,但差异无统计学意义(P>0.05),与伊托必利组相比,补肾润肠方低、中剂量组AQP3、AQP9蛋白及mRNA表达均明显升高(P<0.05),补肾润肠方高剂量组AQP3、AQP9蛋白及mRNA表达升高,但差异无统计学意义(P>0.05),见图2、表2。
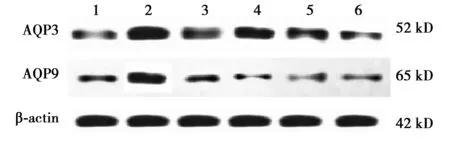
1~6:空白组,模型组,伊托必利组,补肾润肠方低剂量组,补肾润肠方中剂量组,补肾润肠方高剂量组图2 各组结肠组织AQP3、AQP9蛋白表达

表2 各组结肠组织中AQP3、AQP9蛋白及mRNA表达
2.3各组脑区神经递质含量比较 与空白组相比,模型组皮质、下丘脑、海马甲肾上腺素(NE)水平明显升高,多巴胺(DA)及5-羟色胺(HT)水平明显降低(P<0.05);与模型组比较,伊托必利组及补肾润肠方各组皮质、下丘脑、海马中NE水平明显降低,DA及5-HT水平明显升高(P<0.05);与伊托必利组相比,补肾润肠方各组皮质、下丘脑、海马中NE水平降低,DA及5-HT水平升高,但差异无统计学意义(P>0.05),补肾润肠方各组各指标差异无统计学意义(P>0.05),见表3。

表3 各组脑区神经递质含量比较
3 讨 论
慢传输型便秘是老年人常见病,中医学将慢传输型便秘归于“便闷”范畴,《素问·灵兰秘典论篇》有“大肠者,传导之官,变化出焉”的观点,强调大肠的功能是对小肠、脾胃消化吸收后的糟粕进行传导,大肠传导功能正常,粪便能够正常排出;大肠传导功能异常,粪便则无法排出,引起便秘〔7〕。中医治疗慢传输型便秘的重点在于“通下”,补肾润肠为主要措施之一,方中山茱萸及熟地黄滋肾阴,而肉苁蓉暖腰润肠,具补肾阳之效,三者共作君药,可双补阴阳;白术补气健脾,可促大肠运化;何首乌及当归均补血润肠;枳壳及莱菔子能宽肠下气助通便;牛膝补肾壮腰;杏仁降肺气及滋肠燥;瓜蒌仁及火麻仁均润肠通便〔8〕。诸药合用,共奏润肠通便及补肾益精之效。
本研究提示补肾润肠方组的干预效果虽未达到健康水平,但各项指标均与伊托必利组相似,表明补肾润肠方能使老年慢传输型便秘大鼠AQP3、AQP9表达降低。AQP3为胃肠神经递质,在消化系统中大量分布,于大肠、胃部及小肠中均有表达,其含量出现异常是引起便秘及腹泻的重要因素之一〔9〕。到目前为止,在肠道内已发现存在十多种AQPs表达,其中AQP1、AQP3、AQP4、AQP8、AQP9最为常见,目前已有研究指出,AQP3在结肠组织中存在高表达时,肠道内水分明显减少,而出现AQP3低表达时,肠道内水分增加〔10〕。研究指出,在进行细胞染色时发现,其染色部位主要集中在杯状细胞的基底侧,在便秘患者中,存在AQP9低表达情况,分析其水平下降与患者便秘症状存在相关性〔11〕。结肠中AQP3及AQP9含量升高与大鼠粪便含水量呈负相关,即大鼠结肠内AQP3及AQP9含量升高,致使肠道平滑肌出现痉挛,肠道的吸水能力增强,影响肠道蠕动频率,导致便秘出现。补肾润肠方具有润肠通便及补肾益精的功效,通过对老年慢传输型便秘大鼠进行干预,使其肠道的平滑肌张力得到有效控制,降低结肠中粪便的推进阻力,改善便秘程度,促进大鼠顺利排便,使AQP3、AQP9表达降低〔12〕。
研究发现,内分泌异常、脑-肠轴紊乱、心理应激、肠道动力异常及免疫功能异常等均可能引起便秘,且各种发病机制相互作用,于脑-肠轴内,胃肠道效应细胞、中枢神经系统、自主神经系统间产生神经传递作用的物质即脑肠肽,而慢传输型便秘出现后,患者血液、肠黏膜中脑肠肽含量发生改变,呈现出失衡状态〔13〕。胃肠道功能处于应激状态时,NE与5-HT均会活化,并于机体活动调节中处于对立统一关系,其中NE能使中枢系统兴奋,而5-HT能对中枢系统产生抑制作用。DA为NE前体,同时又是独立神经递质,于脑-肠轴内可对胃肠功能产生调节作用〔14〕。本研究结果提示,补肾润肠方可对老年慢传输型便秘大鼠中枢神经递质及胃肠激素的脑-肠轴产生调控作用,原因可能是通过发挥补肾润肠方润肠通便及补肾益精的功效,在改善患者肠道功能的同时,促使患者中枢神经系统功能恢复,并且调节中枢单胺类神经递质,从而促使神经递质改善。
综上,补肾润肠方可降低老年慢传输型便秘大鼠AQP3、AQP9表达,并对中枢神经递质及胃肠激素的脑-肠轴产生调控作用。但由于生物体内在机制十分复杂,且实验设计还存在一定缺陷,可能使本研究结果受到影响。对此,后续需加大研究样本量,并且展开重复实验。

