猪流行性腹泻病毒山东SD20BZ01株的分离鉴定及遗传进化分析
田似报,尹明荣,王文文,厉磊,王一新,李阳
(1.北京中科基因技术股份有限公司,北京 102600;2.山东农业大学动物科技学院,山东泰安 271018;3.临沂市畜牧发展促进中心,山东临沂 276003;4.中国动物卫生与流行病学中心,山东青岛 266032)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种急性、病毒性肠道传染病[1]。该病的临床症状主要为腹泻、脱水和呕吐,尤其以哺乳仔猪发病最为严重,10 日龄内哺乳仔猪死亡率可高达90%。该病于1971 年首次在英国被报道,我国最早于1984 年分离到PEDV 毒株[2-3]。此后,由于PEDV 疫苗的广泛使用,该病得到有效控制。然而,自2010 年以来,PED在我国再次大面积暴发,给我国养猪业带来了巨大经济损失[4-6]。
PEDV 属于尼多病毒目冠状病毒科冠状病毒属,为单股正链RNA 病毒。由于RNA 聚合酶缺乏修正功能,PEDV 在复制过程中发生变异的概率相对较高。研究[7]发现,2010 年以来我国PED 再次流行与变异株的出现有关,经典疫苗株对其保护效果减弱,从而造成PEDV 的广泛传播。基于对全基因组序列的遗传进化分析,PEDV 可被分为GI 和GII 两个基因型。其中,GI 群是以CV777株为主的经典毒株,GII 群为近几年流行的变异毒株,又可进一步被分为GII-a 亚群和GII-b 亚群[8]。因此,了解并掌握不同地区PEDV 毒株变异情况,对于PED 的针对性防控具有重要意义。
本试验采用细胞接种方法,从2020 年山东省滨州市某猪场的PEDV 阳性样品中成功分离到1株PEDV 毒株,并将其命名为SD20BZ01株。随后,本研究对SD20BZ01株进行了全基因组测序,并通过DNAstar、MEGA 7.0 等软件,将其与参考毒株序列进行同源性比对和遗传进化分析,以期了解该地区流行毒株的变异趋势,从而为科学有效防控PED 流行提供理论依据。
1 材料与方法
1.1 病料来源
2020 年1 月,山东省滨州市某猪场暴发腹泻疫情。发病猪表现消瘦、精神萎靡,排黄色水样粪便。剖检可见小肠肠管膨胀扩张,肠壁变薄(图1-A),肠系膜淋巴结肿胀出血(图1-B)。采用胶体金抗原快速检测试剂盒(广州悦洋)进行检测,初步判定为PEDV 阳性。采集发病猪的肠道组织和粪便样品,置于-80 ℃冻存。
1.2 主要试剂
高糖DMEM 培养基、胎牛血清,购自以色列BI 公司;病毒RNA 提取试剂盒,购自OMEGA公司;PrimeScript ™ One Step RT-PCR Kit、pMD18-T载体连接试剂盒,购自宝生物工程(大连)有限公司;DNA 凝胶回收试剂盒,购自北京诺贝莱生物科技有限公司;Trans 5 000 DNA Marker,均购自北京全式金生物技术有限公司;FITC 标记的羊抗鼠IgG,购自美国Sigma 公司;鼠抗PEDV N 蛋白多克隆抗体,由山东农业大学动物检疫与食品检验研究室制备、保存。
1.3 PEDV 分离与鉴定
将发病猪肠道组织和肠内容物研磨,用0.22 μm 滤器过滤除菌,接种至单层生长的Vero E6细胞,同时在培养基中添加20 μg/mL 的胰蛋白酶,置于含有5% CO2的37 ℃温箱孵育2 h。孵育结束后更换新鲜的DMEM 培养基(含20 μg/mL 胰酶),继续置于温箱培养,每隔一段时间观察是否出现细胞病变。若72 h 后仍未出现病变,则继续盲传细胞。待出现明显细胞病变后,收集细胞样品反复冻融3次后,1 500×g离心15 min,收集上清作为病毒液置于-80 ℃保存。
1.4 间接免疫荧光试验(indirect immunoinfluscent assay,IFA)
将Vero E6 细胞传代,细胞长满后加入PEDV毒株。待细胞出现明显病变后,使用PBS 轻柔清洗细胞板2 遍,用4%多聚甲醛固定10 min,PBS清洗3 遍,以鼠抗PEDV N 蛋白多克隆抗体为一抗,4 ℃孵育过夜。随后,用PBS 清洗3 遍,加入FITC 标记的羊抗鼠lgG 抗体,37 ℃孵育2 h;最后,经PBS 清洗3 遍,在荧光显微镜下观察试验结果。
1.5 PEDV 全基因组序列测定
提取病毒RNA,利用逆转录试剂制备cDNA。根据文献[9],使用15 对特异性引物进行RT-PCR 扩增。随后,将扩增产物胶回收,将纯化产物连接pMD18-T 载体,转化到DH5α 感受态细胞,并将阳性菌液送北京睿博兴科生物技术有限公司进行测序。
1.6 SD20BZ01株遗传进化分析
从GeneBank 下载29株国内外具有代表性的PEDV 毒株全基因组序列(表1),与本研究所分离的SD20BZ01株全基因组序列进行比对。利用MEGA 7.0 软件,采用邻接法(Neighbor-Joining method)对PEDV 全基因序列和S基因序列进行进化分析,同时使用DNAstar 软件MegAIign 程序中的Clustal W 算法对序列同源性的进行计算。

表1 本研究所选用PEDV 参考毒株信息
2 结果
2.1 病毒分离与鉴定
将病料研磨过滤,接种Vero E6 细胞后传代培养,在第三代逐渐出现典型的细胞病变,主要表现为细胞皱缩变圆、聚集成团、形成合胞体;随着感染时间增加,细胞病变面积变大,并且出现脱落现象,形成空泡(图2-A、B)。将病毒重新接种Vero E6 细胞,感染36 h 后,以鼠抗PEDV N 蛋白多克隆抗体为一抗,通过IFA 进行检测。结果(图2-C、D)显示,被感染细胞发出绿色荧光,而对照组细胞未见明显CPE 和荧光信号,证实成功分离到1株PEDV,将其命名为SD20BZ01株。
2.2 SD20BZ01株基因组结构分析
参考文献[9]报道,合成15 对特异性引物,对SD20BZ01株基因组进行分段扩增,成功扩增出符合预期的片段。将扩增产物进行测序,经拼接后获得SD20BZ01株全基因组序列。PEDV SD20BZ01株全基因组序列长度为28 038 bp,病毒基因组结构为5′UTR-ORF1a/ORF1b-S-ORF3-E-MN-3′UTR。对PEDV 不同毒株编码区所包含的氨基酸数目进行比较发现,SD20BZ01株的M、N、E基因较为保守,序列大小与参考株基本一致(表2)。
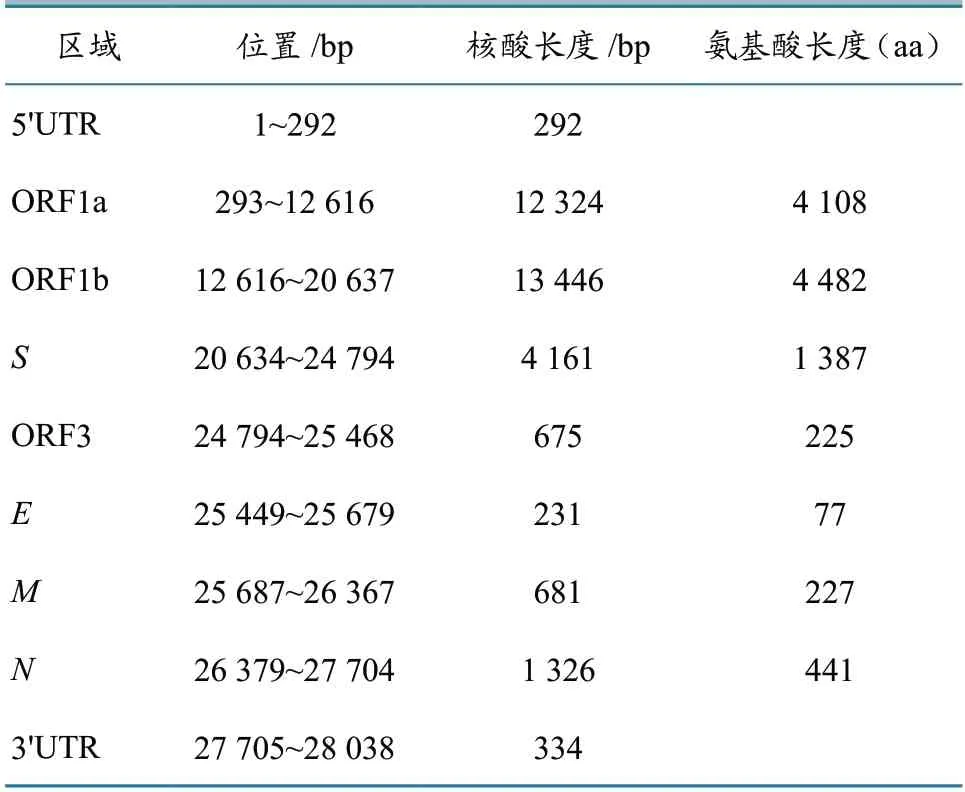
表2 PEDV SD20BZ01株各基因结构分析结果
2.3 SD20BZ01株全基因组同源性与遗传进化分析
SD20BZ01株全基因组序列与其他29株参考毒株全基因组序列的核苷酸同源性为96.4%~98.8%,与2014 年分离自德国的L00721-GER-2014 毒株同源性最高,为98.8%,与1998 年分离自韩国的SM98-South Korea毒株同源性最低,为96.4%。SD20BZ01株与我国2010 年以来流行的GII-b 亚群变异株序列同源性为97.8%~98.7%,与CV777、DR13、SM98、SD-M 等经典毒株同源性为95.4%~96.6%。利用 MEGA 7.0 软件构建系统发育进化树,分析其遗传进化规律。分析结果显示,SD20BZ01 与GII-b 亚群CH-SCZY44-2017、ZL29等毒株的进化距离较近,而与GI 群的经典毒株进化距离较远,该结果与同源性分析结果基本一致(图3)。因此,SD20BZ01株属于近年来流行的GII-b亚群变异型毒株。
2.4 SD20BZ01株S 基因同源性与遗传进化分析
SD20BZ01株S基因全长4161bp,编码1386 个氨基酸。与疫苗株CV777 相比,S基因存在16 处碱基插入和10 处碱基缺失,同时伴有大量碱基突变。缺失位点具体为,S基因第163~164 位(CV777)插 入TTG,第173~174 位插 入GGGTGTTAA,第193~194位插入G,第402~403 位插入GAT;插入位点具体为,在第217~218 位(SD20BZ01)缺失A,第479~480 位缺失TGGAAA。其推导的氨基酸在第58~59 位插入QGVN,第139~140 位插入N;第162~163 位缺失DI。同疫苗株CV777 相比,SD20BZ01 在核心表位(core neutralizing epitope,COE)结构域(499~638 位氨基酸区域)存在氨基酸变异,分别 是A517S、L521S、S523G、V527L、T594S、A605E、G594S、A705D、L612F、I635V。运 用DNAstar 软件对SD20BZ01株S基因的抗原指数进行分析,发现SD20BZ01株S 蛋白和CV777株S蛋白抗原性基本一致,差别主要集中在20~100 及300~350 氨基酸位置。
SD20BZ01株S基因与其余29株PEDV 参考株S基因的核苷酸同源性为92.9%~98.8%,与2016 年分离自美国的PC177 毒株同源性最高,为98.8%;而与SD-M 毒株同源性最低,为92.9%。SD20BZ01株S基因与我国2010 年以来流行的GII-b 亚群变异株核苷酸同源性为96.7%~98.7%,与CV777、DR13、SM98、SD-M 等经典毒株同源性为93.9%~94.2%。基于S基因序列的进化树显示,SD20BZ01株与我国近年来分离的变异株位于同一进化枝,与CV777 等经典毒株所属的GI 群存在显著的分支差异(图4)。上述结果表明,SD20BZ01株与近年来国内外流行的GII-b 亚群PEDV 变异株亲缘关系较近,与早期经典毒株亲缘关系较远。与经典株CV777 相比,SD20BZ01株S基因虽然发生了一定突变,但与近年来流行的GII-b 亚群PEDV 变异株序列基本一致。
3 讨论
PED的流行给我国养猪业造成重大经济损失,疫苗免疫是防控该病的主要方式。目前,已经开发了几种PEDV 疫苗,例如CV777 减毒或灭活疫苗以及活病毒疫苗83P-5、SM98-1和DR13[10]。在我国,TGEV 和PEDV 二联弱毒苗和灭活苗的使用降低了PEDV 对养猪业带来的损失。然而,2010 年以来,PEDV 再次流行,疫苗免疫无法达到理想保护效果[7,11-12]。一般认为,PEDV 属于单股正链RNA病毒,其RNA 酶缺乏校正功能,因此RNA 病毒容易发生变异。此次PEDV 流行株的S基因发生了变异,引起抗原表位发生改变,从而导致疫苗保护效果不佳。因此,掌握各地区当前PEDV 流行毒株变异情况,制备特异性疫苗成为防控PEDV持续传播的关键。
为了解山东省PEDV 流行株的分子特征及遗传进化规律,本研究对山东省滨州市某猪场进行了PEDV 流行株分离鉴定和测序分析。病毒分离鉴定是疾病诊断的金标准,也是动物病毒生物学特性研究的基础。目前,对于PEDV 的分离培养,一般认为在Vero E6 细胞或IPEC-J2 细胞上可成功获得PEDV 细胞适应株。本研究使用Vero E6 细胞在病料中分离到一株PEDV。该毒株可使Vero E6 细胞产生典型的细胞病变,且随着传代次数增多,病变时间变早。使用特异性引物进行RT-PCR 检测,可扩增出目的条带,证实成功分离到PEDV 毒株,将其命名为SD20BZ01。
随后,本研究通过RT-PCR 进行全基因序列的分段扩增,并进行测序和序列分析。分析结果显示,SD20BZ01 与GII-b 亚群变异株同源性最高,且位于进化树的同一分支上,表明SD20BZ01 为GII-b亚群PEDV。PEDV 为冠状病毒科冠状病毒属、有囊膜的单股正链RNA 病毒,基因组全长约28 kb,编码4 个结构蛋白(S、M、E、N 蛋白)、15 个非结构蛋白(NSP1—NSP15)和ORF3[13]。其中S 蛋白位于病毒衣壳外侧,主要作用是识别并结合细胞特异性受体,启动病毒感染过程,其变异程度较高,且与PEDV 的毒力和遗传关系密切[14]。一般认为,PEDV S 蛋白的499~638 位氨基酸是一个关键的中和表位,并将其命名为COE 区。本研究对SD20BZ01 的S基因序列进行了比对和分析。结果显示,与CV777株相比,SD20BZ01 的S蛋白发生了多处突变、缺失和插入事件,而这些改变与近年来我国PEDV 变异株基因序列基本一致,提示GII-b 亚群PEDV 变异规律逐渐趋于稳定[9,12,15-16]。与CV777株相比,SD20BZ01株 在中和抗原表位COE 区有10 个氨基酸发生突变,这些突变可能会影响免疫原性,从而导致疫苗免疫失败,造成PED 暴发。
综上所述,本研究分离的SD20BZ01株为PEDV GII-b 亚群毒株,其基因序列与近年来我国流行的PEDV 变异株突变情况基本一致。对其全基因组序列进行比对分析,对于深入了解山东省PEDV 流行状况,有针对性设计疫苗,以及科学防控PED 传播具有重要意义。

