3株禽副黏病毒4型国内分离株的基因组序列及生物学特性分析
李 峥,舒波,彭程,于晓慧,李金平,侯广宇,蒋文明,王静静,王桂军,刘华雷
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.安徽农业大学动物科技学院,安徽合肥 230000;3.江西农业大学动物科技学院,江西南昌 330000)
目前禽副黏病毒(avian paramyxovirus,APMV)有21 个种,分别为APMV-1—APMV-21。国际病毒分类委员会(The International Committee on Taxonomy of Viruses,ICTV)于2019 年分类报告中设立禽腮腺炎病毒亚科,并基于RNA 依赖的RNA 多聚酶(RdRp)将过去归为禽腮腺炎病毒属(Avulavirus)的1~19型病毒进行了重新分类,其中1、9、12、13、16~19型归为正禽腮腺炎病毒属(Orthoavulavirus),2、5~8、10、11、14、15型归为偏禽腮腺炎病毒属(Metaavulavirus),3、4型归为副禽腮腺炎病毒属(Paraavulavirus)。2019 和2020 年又分别确立了2 种新的禽类副黏病毒——偏禽腮腺炎病毒20型和正禽腮腺炎病毒21型。APMV 是一种有囊膜的单股负链RNA 病毒,可感染世界上多数野生及家养禽类。APMV-4 属于副禽腮腺炎病毒属,在电镜下,负染的病毒颗粒一般呈圆形,表面有致密的纤突,且在病毒内部有被囊膜包裹的对称螺旋核衣壳[1-4]。1975 年,研究人员首次从我国香港地区鸭群中分离到APMV-4[7],此后从美国、韩国、比利时、南非、俄罗斯等国家的野鸟和水禽中也陆续分离到APMV-4[8]。2012 年,我国内陆地区首次报道发现APMV-4[5]。APMV-4 主要感染雁形目的野鸟和商品化的水禽(鸭、鹅),通常导致感染禽类出现卡他性气管炎和间质性肺炎[6]。目前,关于APMV-4 基因组和生物学特性的研究较少。本研究对2020 年从我国野鸭和家鸭中新分离的3株APMV-4 毒株进行了基因组测序和序列分析,并对其生物学特性进行了初步研究,以期为进一步研究我国APMV-4 的流行病学分布特点奠定基础。
1 材料与方法
1.1 病毒来源
APMV-4/Mallard/Ningxia/224-1/2020、APMV-4/Mallard/Ningxia/Y175-1/2020、APMV-4/Duck/Guangdong/G2191/2020 毒株,由中国动物卫生与流行病学中心禽病监测室2020 年在广东省和宁夏回族自治区的野鸭和家鸭中分离并保存。
1.2 生物学特性分析
1.2.1 病毒繁殖 使用1.0 mL 注射器吸取病毒上清液,按照0.2 mL/枚的剂量,经尿囊腔接种9~11日龄的SPF 鸡胚,每个样品接种5 枚鸡胚;接种后,37 ℃继续孵育,18 h 后每12 h 照胚1 次,并观察记录鸡胚死亡情况;收集18 h 以后的死胚及96 h仍存活鸡胚,置于4 ℃环境中4 h,无菌收取鸡胚尿囊液,按照标准方法[16]测定病毒血凝(HA)效价,最终计算各毒株的HA 效价平均值。
1.2.2 鸡胚半数感染量(EID50)测定 将病毒液进行10 倍倍比稀释,取适当稀释度的病毒液接种鸡胚,0.1 mL/枚,每个稀释度接种5 枚鸡胚,96 h 后收获鸡胚尿囊液并测定HA 效价,按照Reed-Muench 方法计算EID50。
1.2.3 病毒致病指数(ICPI)测定 取HA 效价24以上的新鲜病毒液,10 倍稀释后脑内接种1 日龄雏鸡,每组10 只鸡,每只接种0.05 mL,接种后连续观察8 d,每天记录鸡只发病、死亡情况,并打分,最终计算病毒的ICPI 值[16]。
1.3 基因组扩增与测序
采用High Pure Viral RNA Kit(Roche)提取病毒RNA,将提取到的RNA 立即用于RT-PCR扩增或置-20 ℃保存。根据GenBank 中已发表的APMV-4 全基因组序列,运用Oligo 7 软件设计基因组扩增引物和RACE 引物,并由青岛睿博兴科生物技术有限公司合成,基因组扩增引物序列详见表1。利用一步法RT-PCR 试剂盒(南京诺唯赞生物科技股份有限公司产品)进行基因组扩增,按照试剂盒说明书配置反应体系。反应条件:

表1 APMV-4 全基因组扩增引物
50 ℃ 30 min,94 ℃ 3 min;94 ℃ 30 s,55~59 ℃30 s,72 ℃ 2 min,共35 个循环;72 ℃ 5 min。利用SMARTer RACE 5′/3′试剂盒(Clontech)扩增病毒基因组5′和3′末端。将RT-PCR 产物送青岛睿博兴科生物科技有限公司测序。
1.4 遗传进化分析
利用MEGA-X 软件,对病毒基因组进行系统进化分析,采用邻位相连法(Neighbor-Joining)构建系统进化树,bootstrap 设置为1 000 次重复。
1.5 数据分析
利用Lasergene 软件和MEGA-X 软件进行基因组序列拼接,以及病毒基因组结构和关键氨基酸位点分析。
2 结果
2.1 病毒生物学特性
3株APMV-4分离毒株的HA效价为(4~5)log2,EID50为(10-7.62~10-7.65)/0.1mL,ICPI值为0~0.23,均为低致病性毒株。3株APMV-4 分离株的生物学特征见表2。

表2 APMV-4 分离株生物学特征
2.2 病毒基因组序列
3株APMV-4 分离株的基因组序列分析结果显示:3株毒株的基因组长度均为15 054 nt,基因组结构均为3′-N-P-M-F-HN-L-5′,遵循副黏病毒科的“六碱基原则”;3株毒株的基因组结构与副禽腮腺炎病毒属的其他成员类似,3′端前导序列长55 nt,5′端尾随序列长度为17 nt,各个基因间的基因间隔序列(IGS)由9 nt 到42 nt 长度不等(表3、图1),3株毒株在N/P和HN/L的IGS有1 nt 的微弱差异(表4);3株毒株的N、P、M、F、HN和L基因5′端非转录区(untranslated region,UTR)均长于3′UTR(表3),除N基因外,其余5 个基因片段的起始序列高度保守(3′-UCCCACCCCUUCC-5′);3株毒株共有的基因终止序列为3′-AAAUUAAUUUUU-5′,但P、M和L基因中分别存在2、6 和1 nt 的差异(表5)。

表4 基因间序列

表5 基因起始及终止序列

表3 APMV-4 分离株的基因组特征和蛋白质特征
3株分离毒株的N 蛋白均编码457个氨基酸(amino acid,aa),与目前已知的APMV-4毒株相同,并包含高度保守氨基酸序列322FAPGNFPHMYSYAMG336;3株毒株F 蛋白裂解位点序列均为116DIPQR ↓F121,与大部分APMV-4毒株一致,其F 蛋白具有3 个潜在的糖基化位点,分别位于F1 蛋白第260、455 位以及F2 蛋白的第89 位;分离毒株的F 蛋白有2 个七肽重复区(heptad repeat region,HR),与我国香港、韩国分离株相比,仅在F 蛋白头部非关键位点存在11 处氨基酸差异,而HRa 和HRb 区域均未出现变异位点;3株毒株的HN 蛋白具有5 个潜在的糖基化位点,部分毒株HN 蛋白的第57、103、124、153、262、366、424位氨基酸存在变异(表6),但HN 蛋白唾液酸受体结合位点(229NRKSCS234)均未发生变异。
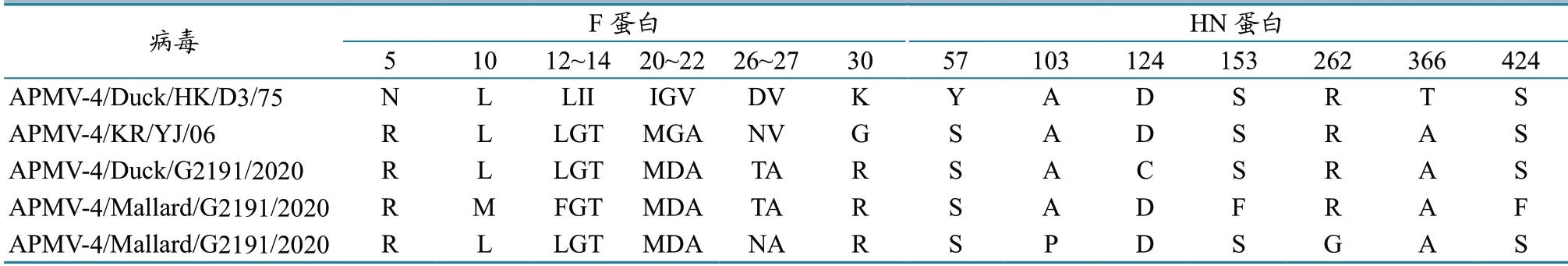
表6 F 蛋白和HN 蛋白氨基酸差异对比
2.3 病毒基因组核苷酸同源性
选取APMV-1—APMV-21 代表株各1株(表7),与本研究中的3株APMV-4 分离株进行基因组核苷酸序列同源性分析。结果显示:3株分离株与APMV-4 代表株同源性最高(97.2%~97.5%),与APMV-11同源性最低(37.1%),与其余APMV 代表毒株的核苷酸同源性为38.1%~47.3%(图2)。
2.4 基因组遗传进化
病毒基因组遗传进化分析结果(图3)显示,3株APMV-4 分离毒株属于副禽腮腺炎病毒属,与我国香港、韩国分离株高度同源。
3 讨论
自1975 年首次在我国香港地区发现APMV-4以来,在雁形目的野生鸟类和家养的鸭、鹅中也分离到多株该型毒株。APMV-4 虽然经常感染禽类,但其致病力不强[11]。蛋鸡感染APMV-4 后仅表现为产白壳蛋[11],鸡人工感染后出现轻度的卡他性气管炎或肠淋巴组织增生等症状,在人工感染雏鸡的肠道和胰腺中可检测到病毒[11]。部分研究[12]结果证明,APMV-4 感染小鼠后,会广泛分布于肺脏与鼻甲,但通常不导致严重的疾病症状。与其他型APMV 相比,APMV-4 在鸡体内复制力较差,但可在人工感染鸭的气管和肺中有效复制,说明APMV-4 在鸭体内的复制力较强[12]。本研究中的3株APMV-4 毒株分离自野鸭和家鸭,其在鸡胚中的复制力较差,且对雏鸡表现为低致病力(ICPI为0~0.23),其生物学特性与大部分APMV-4 分离株一致[13]。
通常情况下,APMV 基因组长度约15 500 nt,且遵循“六碱基原则”。本研究中的3株APMV-4毒株基因组长度均为15 054 nt,与其他APMV-4分离株一致[14]。3株APMV-4 分离株的3′端前导序列长度为55 nt,与大多数APMV 毒株一致。禽副黏病毒5′端尾随序列长度一般为25~60 nt[15],而APMV-4 尾随序列仅为17 nt,是APMV 成员中最短的。分析结果显示,APMV-4 毒株3′端前导序列与5′端尾随序列呈现70.3%的互补配对,且基因组3′端序列具有保守性。除此之外,APMV-4的基因启动序列(3′-UCCCACCCCUUCC-5′)与基因终止序列(3′-AAAUUAAUUUUU-5′)也高度保守,可有效区分基因组内各基因片段。APMV-4 的基因间隔序列与腮腺炎病毒、麻疹病毒和亨尼帕病毒相似[15]。APMV-4 的6 个基因具有六聚体的基因起始序列,且其P基因编辑位点是APMV 中最具特异性的[17]。
副黏病毒F0 蛋白无活性,需被宿主细胞蛋白酶切割成F1 和F2 两部分才具有生物活性,而F1和F2 蛋白依靠F1 蛋白C346 和F2 蛋白C80 两个半胱氨酸连接[17]。本研究中的3株APMV-4 毒株的F 蛋白裂解位点序列为116DIPQR ↓F121,与新城疫弱毒株裂解位点较为相近[18]。此外,F1 蛋白在第260 位以及第455 位存在两个高度保守的糖基化位点,F2 蛋白也存在一个糖基化位点,位于第89 位,同时F1 蛋白中还存在2 个疏水性七肽重复序列,分别为HRa(142~193)和HRb(469~500)。3株APMV-4 毒株的F 蛋白糖基化位点与我国香港、韩国分离株对比并未发现突变,且七肽重复区均一致。APMV-4 的HN 蛋白是一种 II型整合膜蛋白,在第11、58、141、317 和448 位分别存在5 个潜在的糖基化位点[14],而这3株毒株的HN 蛋白糖基化位点和229~234 位的唾液酸受体结合基序(NRKSCS)未发生变异。本研究系统分析了我国3株APMV-4 鸭源分离株的生物学特性和基因组特性,为进一步了解APMV-4 和科学防控APMV-4感染提供了参考数据。

