铜催化活性烯烃与3-氨基吲唑反应合成芳氰基取代2-吲哚酮化合物
于金涛,滕建刚,李伊婷
(常州大学 石油化工学院,江苏 常州 213164)
2-吲哚酮是一类普遍存在于天然产物及药物分子中的结构,许多含有该类结构的分子都具有独特的生理活性,如抗癌、抗真菌、抗病毒等[1-3]。如图1所示,环丙烷环的2-吲哚酮(Ⅰ)是一种HIV-1非核苷逆转录酶抑制剂[1];3-氨基衍生的2-吲哚酮(Ⅱ)具有非常多的生理应用,其中包括对大鼠软骨增生的诱导作用等[2];舒尼替尼(Sunitinib,Ⅲ)是辉瑞公司生产销售的一种口服的小分子多靶点受体酪氨酸激酶抑制剂[3]。因此,对于2-吲哚酮化合物合成方法的研究吸引了研究者的注意[4-6]。传统上,2-吲哚酮类化合物是由强酸或强碱促进的苯胺与羰基化合物的缩合反应得到的。近年来,以丙烯酰胺为底物,通过对烯烃双官能化反应来实现2-吲哚酮结构的合成取得了巨大进展。在过渡金属催化或者无金属参与下,通过自由基对双键的加成、环化,得到一系列烷基化、芳基化、硅基化、磺酰化等官能化的2-吲哚酮化合物[7-10]。例如,课题组曾报道过的丙烯酰胺与过氧化二叔丁基(DTBP)的反应,得到甲基化的2-吲哚酮化合物[11]。

图1 几种含2-吲哚酮结构的药物分子
多氮杂环化合物在发生脱氮开环反应时,会转化为相应的金属碳烯或者活性自由基结构,因此广泛应用于有机合成方面。在这一领域,过渡金属催化的三氮唑脱氮开环反应研究较早,并实现了多种有用化合物,特别是杂环化合物的合成[12-13]。此外,其他的多氮杂环化合物,如苯并三唑[14-15]、吡啶三唑[16-17]、苯并三嗪酮[18]以及四唑[19-20]的脱氮开环反应研究也较多,并已成功应用于多种复杂结构的构建。近期,3-氨基吲唑这类多氮环结构的脱氮开环反应研究引起了化学工作者的广泛重视[21-22]。课题组近期也实现了N-(2-甲基烯丙基)芳胺与3-氨基吲唑的脱氮开环反应,经历一系列的脱氮开环、加成、环化、水解等步骤,得到2,2-二取代的茚酮结构[23]。过渡金属催化有机合成反应可以用于构建多种复杂结构,在合成领域有着举足轻重的地位[24-25]。课题研究铜催化,以丙烯酰胺为自由基受体与3-氨基吲唑反应,期望能够得到3-芳氰基取代的2-吲哚酮化合物。
1 实验部分
1.1 仪器与试剂
芳胺(>97%,上海阿拉丁试剂有限公司);水合肼(>98%,上海阿拉丁试剂有限公司);酰氯、邻氟芳甲腈(>97%,安耐吉化学技术(上海)有限公司);铜盐催化剂(>99%,国药集团化学试剂有限公司);其他所用溶剂和试剂(分析纯,除特殊说明外,均直接由国药集团化学试剂有限公司购得)。
300/400 MHz核磁共振仪(德国Bruker公司);QP 2010 SE气质联用仪(日本岛津公司);ZF-IA三用紫外分析仪(上海和勤分析仪器有限公司);旋转蒸发仪(郑州长城仪器有限公司)。
1.2 N-芳基甲基丙烯酰胺化合物的合成
以制备N-甲基-N-苯基甲基丙烯酰胺(1a)为例,此方法适用于其他丙烯酰胺制备[11]。
在0 ℃下,向苯胺(10 mmol)的二氯甲烷(40 mL)溶液中加入三乙胺(20 mmol)及酰氯(12 mmol)。恢复至室温,继续搅拌1 h。加水20 mL,并用二氯甲烷(30 mL×2)萃取,合并有机层经无水硫酸钠干燥,低压浓缩,得到粗制酰胺。继续在0 ℃ 下,于5 min内,向上述酰胺的乙醚(20 mL)溶液中加入氢化钠(7.5 mmol),随后缓慢滴加碘甲烷(7.5 mmol)。将混合物0 ℃搅拌1 h,恢复至室温继续搅拌过夜。向混合物中加入NH4Cl水溶液20 mL,并用乙酸乙酯(30 mL×2)萃取。合并的有机层经无水硫酸钠干燥,浓缩,柱色谱分离纯化,得到产物1a。
1.3 3-氨基吲唑化合物的合成
以制备3-氨基吲唑(2a)为例,此方法适用于其他含取代基3-氨基吲唑的制备[26]。
在50 mL的圆底烧瓶中,加入5 mL乙醇,1.0 g 2-氟苯甲腈(8.3 mmol),2.0 mL水合肼,将混合物回流反应12 h。反应完成之后,减压除去溶剂,将5 mL水加入到粗反应混合物中,室温搅拌1 h以除去过量的水合肼。反应混合物用布氏漏斗过滤,柱色谱分离纯化,得到灰白色固体产物2a。
1.4 芳氰基取代2-吲哚酮化合物的合成
以制备3aa为例,此方法适用于其他含3-芳氰基取代2-吲哚酮化合物(3)的合成。
在装有搅拌子的20 mL Schlenk管中,依次加入1a(0.2 mmol)、3-氨基吲唑(2a)(0.3 mmol)、叔丁基过氧化氢(TBHP,70%水溶液)(0.4 mmol)、Cu(OAc)2(7.3 mg)和乙腈(2.0 mL),密封。将反应管置于80 ℃ 油浴中搅拌反应16 h。反应完成后加水淬灭,用乙酸乙酯(5 mL×3)萃取,盐水(5 mL)洗涤,有机相用无水硫酸镁干燥并减压去除溶剂。硅胶柱层析纯化得到产物3aa。
2 结果与讨论
2.1 反应条件优化
以N-甲基-N-苯基甲基丙烯酰胺(1a)与3-氨基吲唑(2a)的反应作为模板反应来筛选最佳反应条件。使用0.04 mmol的Cu(OAc)2作为催化剂,0.3 mmol的TBHP(70%水溶液)作为氧化剂,在1.5 mL乙腈溶剂中80 ℃的条件下反应16 h,以66%的收率得到2-((1,3-二甲基-2-氧吲哚-3-基)甲基)苄腈(3aa)(表1,序号1)。首先对催化剂种类进行筛选,分别尝试了常见铜盐CuI,Cu(OTf)2和CuCl2,结果显示Cu(OAc)2的反应效果最好,而用其他铜盐催化剂都会导致反应产率明显降低(表1,序号2~序号4)。而在不加任何铜盐的情况下,该反应不能发生(表1,序号5)。其次对氧化剂进行了筛选,分别考察了BPO(过氧化苯甲酰),H2O2(30%水溶液),K2S2O8,DTBP(二叔丁基过氧化物)和TBPB(过苯甲酸特丁酯)作氧化剂对反应的影响,结果并未观察到产率的明显提高(表1,序号6~序号10)。使用无水TBHP(叔丁基过氧化氢)(30%甲苯(Tol)溶液),3aa的产率也仅有49%(表1,序号11)。在不加任何氧化剂的情况下仅有痕量的3aa产物生成(表1,序号12)。随后,又继续筛选了氧化剂TBHP(70%水溶液)的用量,当氧化剂的用量增加为0.4 mmol时,产物的产率提升至73%;而如果减少TBHP用量,产物产率明显降低(表1,序号13)。最后对反应温度进行了考察,60 ℃时,产率降低,但温度升高到90 ℃,对产率没有明显提升(表1,序号15,序号16)。据此,可以得出最佳的反应条件为:N-甲基-N-苯基甲基丙烯酰胺(1a)(0.2 mmol),3-氨基吲唑(2a)(0.3 mmol),醋酸铜(0.04 mmol),TBHP(0.4 mmol),乙腈(1.5 mL)中,80 ℃反应16 h。
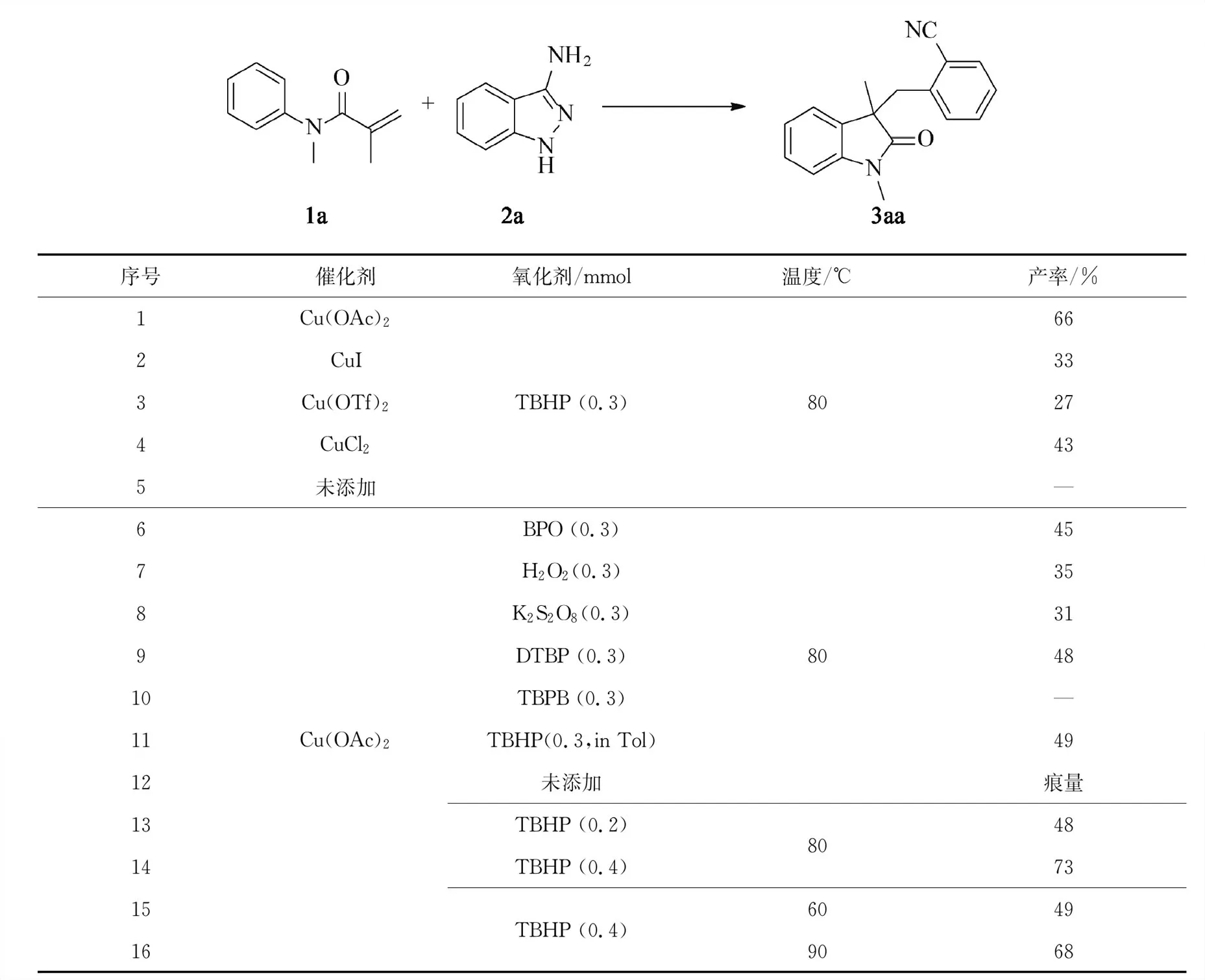
表1 最佳反应条件筛选
2.2 底物拓展
在确定最佳反应条件后(1(0.2 mmol),2a(0.3 mmol),Cu(OAc)2(0.04 mmol),TBHP (0.4 mmol),乙腈(1.5 mL),氮气保护下在Schlenk管内80 ℃反应16 h),研究了该脱氮开环反应的底物适用范围,如图2所示。正如预期,在苯环的4-位上有各类取代基团的(卤素、叔丁基、三氟甲氧基、硝基等)取代N-芳基甲基丙烯酰胺底物都能够以中等至良好的产率生成对应3-芳氰基取代2-吲哚酮化合物(图2,3ba~3fa)。底物N-芳基甲基丙烯酰胺的苯环3-位有溴、甲基等取代时,反应也能顺利发生,得到目标产物3ga和3ha。然而,2-取代的N-甲基-N-苯基甲基丙烯酰胺,无论是甲基还是卤素取代,都不能发生该转化。除N-甲基取代的底物外,N原子的保护基换成乙基、苄基时反应也能平稳进行,以较好产率得到对应的2-吲哚酮(3ia和3ja)。对3-氨基吲唑的底物范围进行了研究,反应条件为:1a(0.2 mmol),2(0.3 mmol),Cu(OAc)2(0.04 mmol),TBHP (0.4 mmol),乙腈(1.5 mL),氮气保护下在Schlenk管内80 ℃反应16 h,结果如图3所示。对于5-位或6-位有烷基、氯、溴、氟、三氟甲基取代的3-氨基吲唑,脱氮开环反应都能顺利进行,与N-甲基-N-苯基甲基丙烯酰胺反应得到一系列5-位或4-位取代的2-吲哚酮芳腈衍生物(图3,3ab~3ag)。
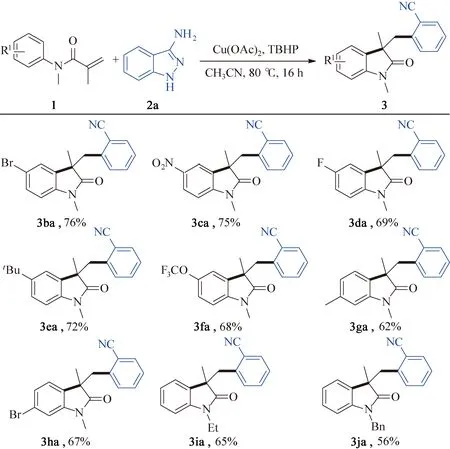
图2 N-芳基丙烯酰胺底物范围
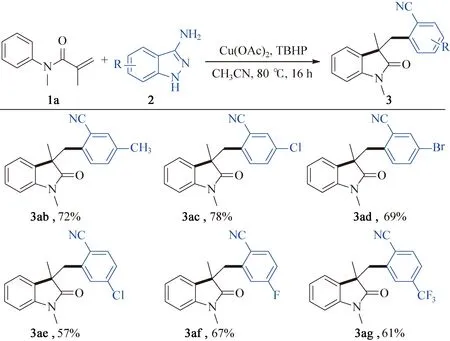
图3 3-氨基吲唑化合物的范围
2.3 机理研究
实施了一系列的对照实验来研究反应的机理。在反应体系中加入2,2,6,6-四甲基哌啶氧化物(TEMPO)或2,6-二叔丁基-4-甲基苯酚(BHT)作为自由基抑制剂,反应明显受到抑制。如果在反应体系中加入1,1-二苯基乙烯,通过GC-MS检测到了加合物4的存在(图4,反应式(1))。而当使用TBHP的甲苯溶液作为氧化剂时,通过GC-MS检测了芳基化产物甲基联苯-2-甲腈(5)(图4,反应式(2))。上述控制实验表明,该反应经历了自由基途径,并且2-氰基苯基自由基是反应的中间体。
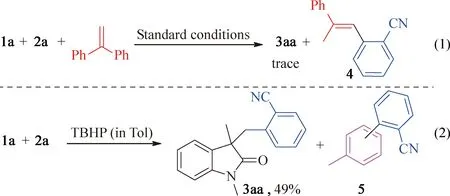
图4 机理研究实验
最后,在对实验结果分析及对文献调研的基础上,提出该脱氮开环/环化反应可能的机理(图5)。3-氨基吲唑在氧化剂作用下首先得到化合物A,与此同时Cu(Ⅱ)与TBHP反应得到活性叔丁氧基自由基及Cu(Ⅲ)物种。接着在叔丁氧基自由基作用下,化合物A失去氢原子、脱除氮气生成关键自由基中间体B。随后,B与1a经历分子间自由基加成得到另一个自由基中间体C。接下来,C的叔碳自由基与胺的芳环发生分子内自由基加成反应,得到自由基中间体D。中间体D迅速被Cu(Ⅲ)氧化为阳离子中间体E,同时实现催化剂Cu(Ⅱ)再生。最后,中间体E脱质子得到目标产物3aa。
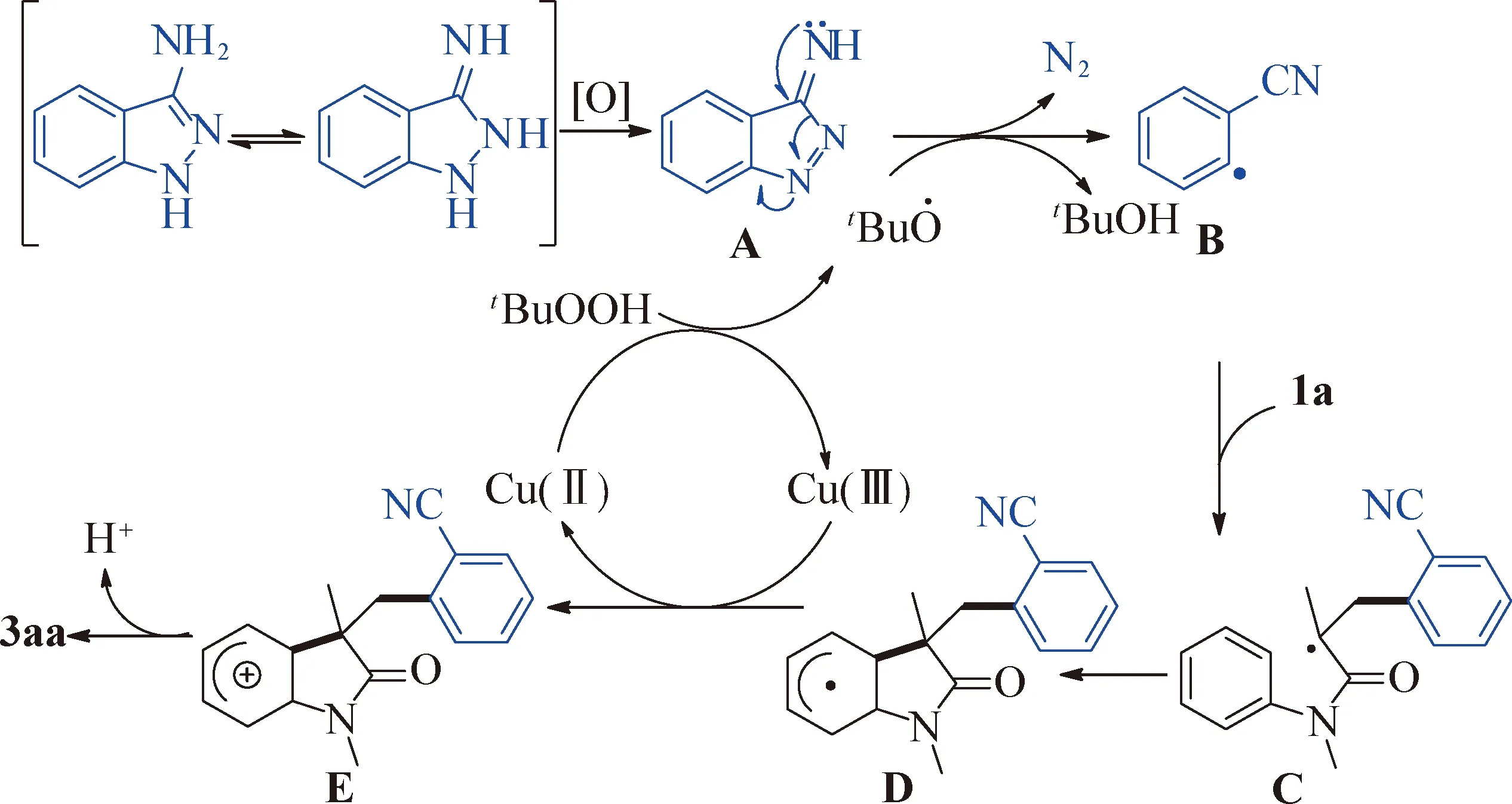
图5 可能的反应机理
3 产物表征
2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3aa),黄色油状液体,40.3 mg (产率73%);1H NMR (400 MHz, CDCl3)δ7.39~7.31 (m, 3H,), 7.24~7.16 (m, 3H,), 7.05 (t,J=7.5 Hz, 1H,), 6.64 (d,J=7.7 Hz, 1H,), 3.38 (d,J=2.6 Hz, 2H), 3.10 (s,J=1.5 Hz, 3H);13C NMR (100 MHz, CDCl3)δ179.5, 142.5, 140.3, 132.3, 131.9, 131.4, 130.0, 128.0, 127.0, 124.0, 122.4, 118.2, 113.6, 107.7, 49.9, 41.7, 26.0, 23.1;HRMS (ESI-TOF)m/z[M+Na]+计算值C18H16N2ONa 299.115 5, 实验值 299.115 8。
2-((5-溴-1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ba),黄色油状液体,53.8 mg (产率76%);1H NMR (400 MHz, CDCl3)δ7.42~7.35 (m, 3H), 7.29 (d,J= 8.3 Hz, 1H), 7.20 (t,J= 7.3 Hz, 2H), 6.51 (d,J= 8.2 Hz, 1H), 3.31 (d,J= 2.6 Hz, 2H), 6.63 (d,J= 7.7 Hz, 1H), 3.05 (s, 3H), 1.49 (s, 3H);13C NMR (100 MHz, CDCl3)δ178.8, 141.6, 139.7, 133.5, 132.5, 132.0, 131.0, 130.1, 127.4, 127.3, 118.0, 115.1, 113.7, 109.1, 50.0, 41.6, 26.1, 22.7;HRMS (ESI-TOF)m/z[M+Na]+计算值 C18H15N2ONa 377.026 0, 实验值 377.025 9。
2-((1,3-二甲基-5-硝基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ca),黄色油状液体,48.2 mg (产率75%);1H NMR (400 MHz, CDCl3)δ8.18 (dd,J1= 8.6 Hz,J2= 2.2 Hz, 1H), 8.04 (d,J= 2.2 Hz, 1H), 7.44~7.40 (m, 2H), 7.28~7.20 (m, 4H), 3.35 (t,J= 13.68 Hz, 2H), 3.16 (s, 3H), 1.56 (s, 3H);13C NMR (100 MHz, CDCl3)δ179.4, 148.3, 143.1, 139.0, 132.6, 132.3, 132.2, 130.3, 127.7, 125.5, 120.0, 117.8, 113.7, 107.4, 49.5, 41.6, 26.5, 22.3;HRMS (ESI-TOF)m/z[M+Na]+计算值 C18H15N3O2Na 344.100 6, 实验值 344.101 0。
2-((5-氟-1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3da),黄色油状液体,40.6 mg (产率69%);1H NMR (400 MHz, CDCl3)δ7.43~7.35 (m, 2H), 7.23~7.18 (m, 2H), 7.04~7.01 (m, 1H), 6.90~6.86 (m, 1H), 6.57~6.54 (m, 1H), 3.36 (s, 2H), 3.08 (s, 3H), 1.51 (s, 3H);13C NMR (101 MHz, CDCl3)δ178.1, 145.1, 139.8, 132.5 (d,J= 110 Hz), 130.0 (d,J= 32.0 Hz), 129.8, 127.1 (d,J= 3.0 Hz), 119.5, 117.9, 113.7, 107.0, 51.4, 38.9, 26.2, 20.6;HRMS (ESI-TOF)m/z[M+Na]+计算值 C18H15FN2ONa 317.106 1, 实验值317.106 7。
2-((5-(叔丁基)-1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ea),黄色油状液体,47.8 mg(产率72%);1H NMR (400 MHz, CDCl3)δ7.36 (t,J= 8.0 Hz, 2H), 7.25~7.23 (m, 2H), 7.21~7.16 (m, 2H), 6.57 (d,J= 8.4 Hz, 1H), 3.36 (s, 2H), 3.11 (s, 3H), 1.52 (s, 3H), 1.30 (s, 9H);13C NMR (100 MHz, CDCl3)δ179.8, 145.6, 140.6, 140.1, 132.2, 131.9, 131.1, 130.1, 127.1, 124.8, 121.3, 118.3, 113.9, 107.2, 50.1, 41.8, 34.6, 31.5, 26.1, 23.1;HRMS (ESI-TOF)m/z[M+Na]+计算值 C22H24N2NaO 355.178 1, 实验值 355.177 6。
2-((1,3-二甲基-2-氧代-5-(三氟甲氧基)吲哚-3-基)甲基)苯甲腈 (3fa),黄色油状液体,49.0 mg (产率68%);1H NMR (400 MHz, CDCl3)δ7.49 (d,J= 8.0 Hz, 1H), 7.44~7.41 (m, 3H), 7.23 (t,J= 7.6 Hz, 1H), 6.74 (d,J= 8.4 Hz, 1H), 3.42~3.31 (m, 2H), 3.15 (s, 3H), 1.55 (s, 3H);13C NMR (101 MHz, CDCl3)δ178.1, 145.1, 139.8, 132.9, 131.8, 130.2, 129.9, 129.8, 127.2, 127.0, 119.5 (q,JC—F= 256.4 Hz), 117.9, 113.7, 107.0, 51.4, 38.9, 26.2, 20.6;HRMS (ESI-TOF)m/z[M+Na]+计算值C19H15F3N2O2Na 383.097 8, 实验值 383.097 4。
2-((1,3,6-三甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ga),黄色油状液体,38.8 mg (产率62%);1H NMR (400 MHz, CDCl3)δ7.42~7.36 (m, 1H), 7.36~7.27 (m, 1H), 7.24~7.06 (m, 3H), 6.84 (d,J=7.8 Hz, 1H), 6.60~6.40 (m, 1H), 3.60~3.25 (s, 2H), 3.03 (s, 3H), 2.40 (s, 3H), 1.56 (s, 3H);13C NMR (101 MHz, CDCl3)δ179.1, 141.7, 140.4, 132.4, 132.0, 131.8, 130.3, 128.1, 127.1, 124.4, 122.3, 118.4, 113.7, 107.9, 49.9, 41.7, 34.5, 23.6, 12.4;HRMS (ESI-TOF)m/z[M+Na]+计算值C19H18N2ONa 313.131 1, 实验值313.131 2。
2-((6-溴-1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ha),黄色油状液体,47.4 mg (产率67%);1H NMR (400 MHz, CDCl3)δ7.47 (dd,J1=7.6 Hz,J2=1.2 Hz, 1H), 7.29~7.24 (m, 1H), 7.21~7.16 (m, 2H), 7.11 (t,J= 7.8 Hz, 1H), 6.92 (d,J=7.6 Hz, 1H), 6.62 (dd,J1= 7.6 Hz,J2= 0.4 Hz, 1H), 3.68~3.4 (m, 2H), 3.00 (s, 3H), 1.69 (s, 3H);13C NMR (101 MHz, CDCl3)δ178.1, 145.1, 139.8, 132.9, 131.8, 130.2, 129.9, 129.8, 127.2, 127.0, 119.5, 117.9, 113.7, 107.0, 51.4, 38.9, 26.2, 20.6;HRMS (ESI-TOF)m/z[M+Na]+计算值 C18H15N2ONa 377.026 0, 实验值 377.025 9。
2-((1-乙基-3-甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ia),黄色油状液体,37.7 mg (产率65%);1H NMR (400 MHz, CDCl3)δ7.37 (d,J= 7.6 Hz, 1H), 7.33~7.29 (m, 1H), 7.22 (d,J= 7.4 Hz, 1H), 7.18~7.13 (m, 2H), 7.05 (dd,J= 7.5 Hz, 1H), 6.63 (d,J= 7.7 Hz, 1H), 3.83~3.73 (m, 1H), 3.57~3.48 (m, 1H), 3.38 (s, 2H), 1.52 (s, 3H), 1.06 (t,J= 7.2 Hz, 1H);13C NMR (101 MHz, CDCl3)δ179.1, 141.7, 140.4, 132.4, 132.0, 131.8, 130.3, 128.1, 127.1, 124.4, 122.3, 118.4, 113.7, 107.9, 49.9, 41.7, 34.5, 23.6, 12.4;HRMS (ESI-TOF)m/z[M+Na]+计算值 C19H18N2ONa 313.131 1, 实验值 313.131 2。
2-((1-苄基-3-甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ja),黄色油状液体,39.4 mg(产率56%);1H NMR (400 MHz, CDCl3)δ7.41~7.38 (m, 2H), 7.23~7.17 (m, 6H), 7.08~7.00 (m, 4H), 6.54~6.52 (m, 1H), 4.91 (d,J= 15.6 Hz, 1H), 4.71 (d,J= 16.0 Hz, 1H), 3.50~3.42 (m, 2H), 1.58 (s, 3H);13C NMR (100 MHz, CDCl3)δ179.5, 141.9, 140.3, 135.5, 132.5, 132.2, 131.5, 130.4, 128.6, 128.1, 127.4, 127.1, 127.0, 124.3, 122.5, 118.3, 113.7, 108.8, 50.1, 43.6, 41.4, 24.4;HRMS (ESI-TOF)m/z[M+H]+计算值C21H21N2O 353.164 8, 实验值353.165 0。
2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)-5-甲基苯甲腈 (3ab),黄色油状液体,41.8 mg(产率72%);1H NMR (400 MHz, CDCl3)δ7.30 (d,J= 7.6 Hz, 1H), 7.21~7.03 (m, 5H), 6.65 (d,J= 7.6 Hz, 1H), 3.36~3.29 (m, 2H), 3.11 (s, 3H), 2.24 (s, 3H), 1.51 (s, 3H);13C NMR (100 MHz, CDCl3)δ179.7, 142.6, 137.3, 137.0, 132.9, 132.6, 131.7, 129.9, 128.1, 124.1, 122.5, 118.5, 113.5, 107.7, 49.9, 41.3, 26.1, 23.2, 20.6;HRMS (ESI-TOF)m/z[M+H]+计算值C19H19N2O 291.149 2, 实验值 291.149 5。
5-氯-2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ac),黄色油状液体,48.4 mg(产率78%);1H NMR (400 MHz, CDCl3)δ7.41 (d,J= 8.0 Hz, 1H), 7.39~7.35 (m, 2H), 7.30~7.26 (m, 1H), 7.21~7.18 (m, 2H), 6.50 (d,J= 8.2 Hz, 1H), 3.35~3.28 (m, 2H), 3.05 (s, 3H), 1.49 (s, 3H);13C NMR (100 MHz, CDCl3)δ178.8, 141.6, 139.7, 133.5, 132.4, 132.0, 130.9, 130.0, 127.4, 127.3, 118.0, 115.1, 113.7, 109.1, 50.0, 41.6, 26.1, 22.7;HRMS (ESI-TOF)m/z[M+Na]+计算值C18H15ClN2NaO 333.676 5, 实验值 333.676 3。
5-溴-2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ad),黄色油状液体,48.9 mg(产率69%);1H NMR (400 MHz, CDCl3)δ7.38 (d,J= 7.7 Hz, 1H), 7.33~7.29 (m, 2H), 7.22~7.15 (m, 2H), 7.07~7.02 (m, 1H), 6.65 (d,J= 7.7 Hz, 1H), 3.32 (s, 2H), 3.13 (s, 3H), 1.52 (s, 3H);13C NMR (100 MHz, CDCl3)δ179.2, 142.6, 142.3, 133.3, 133.1, 131.2, 130.5, 128.4, 127.0, 124.0, 122.6, 117.6, 112.6, 107.9, 49.9, 41.7, 26.1, 23.0;HRMS (ESI-TOF)m/z[M+Na]+计算值C18H15BrN2NaO 377.026 0, 实验值 377.025 3。
4-氯-2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)苯甲腈 (3ae),黄色油状液体,38.0 mg(产率57%);1H NMR (300 MHz, CDCl3)δ7.33~7.28 (m, 2H), 7.22~7.21 (m, 1H), 7.19~7.13 (m, 2H), 7.07~7.02 (m, 1H), 6.65 (d,J= 7.7 Hz, 1H), 3.33 (s, 2H), 3.13 (s, 3H), 1.52 (s, 3H);13C NMR (75 MHz, CDCl3)δ179.2, 142.5, 142.2, 138.6, 133.3, 131.1, 130.1, 128.3, 127.6, 124.0, 122.6, 117.5, 112.1, 107.9, 49.8, 41.6, 26.0, 23.0;HRMS (ESI-TOF)m/z[M+Na]+计算值C18H15ClN2NaO 333.676 5, 实验值 333.675 9。
2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)-4-氟苯甲腈 (3af),黄色油状液体,39.4 mg(产率67%);1H NMR (400 MHz, CDCl3)δ7.39~7.33 (m, 2H), 7.20~7.16 (m, 2H), 7.01~6.99 (m, 1H), 6.87~6.82 (m, 1H), 6.56~6.52 (m, 1H), 3.32 (s, 2H), 3.06 (s, 3H), 1.48 (s, 3H);13C NMR (100 MHz, CDCl3)δ179.0, 160.6 (1JC—F= 247.7 Hz), 136.5 (4JC—F= 3.8 Hz), 132.0, 131.9, 131.3, 128.3, 124.1, 122.6, 119.7 (2JC—F= 20.8 Hz), 118.9 (2JC—F= 24.1 Hz), 117.2, 114.8 (3JC—F= 9.2 Hz), 108.1, 50.2, 41.5, 26.1, 22.8;HRMS (ESI-TOF)m/z[M+Na]+计算值C18H15FN2NaO 317.106 1, 实验值 317.106 6。
2-((1,3-二甲基-2-氧代吲哚-3-基)甲基)-4-(三氟甲基)苯甲腈 (3ag),黄色油状液体,42.0 mg(产率61%);1H NMR (400 MHz, CDCl3)δ7.48 (d,J= 8.0 Hz, 1H), 7.44~7.40 (m, 2H), 7.36~7.34 (m, 1H), 7.20~7.14 (m, 1H), 7.08~7.03 (m, 1H), 6.60 (d,J= 7.7 Hz, 1H), 3.43 (s, 2H), 3.06 (s, 3H), 1.55 (s, 3H);13C NMR (75 MHz, CDCl3)δ179.0, 144.4, 142.4, 131.0, 130.8, 129.2 (3JC—F= 3.0 Hz), 128.5 (2JC—F= 3.7 Hz), 126.9 (3JC—F= 3.3 Hz), 126.5, 124.2, 122.8 (1JC—F= 270.7 Hz), 122.7, 116.9, 114.6, 49.9, 41.9, 25.9, 22.9;HRMS (ESI-TOF)m/z[M+H]+计算值C19H15F3N2NaO 367.102 9, 实验值 367.108 8。
4 结 论
成功地开发了铜催化的3-氨基吲唑化合物与N-甲基-N-苯基甲基丙烯酰胺化合物的脱氮开环反应,以中等到良好的产率得到了一系列3-芳氰基取代2-吲哚酮化合物。该工作是以3-氨基吲唑的脱氮开环得到的2-氰基苯基自由基为反应的关键中间体,与N-甲基-N-苯基甲基丙烯酰胺发生自由基加成、环化反应,完成2-吲哚酮结构的构建。鉴于氰基丰富的反应活性,该反应为2-吲哚酮衍生物的合成提供了新的思路。

