黄芩素和汉黄芩素抑制肝癌细胞能量代谢的作用机制差异研究
许珂嘉 张子蒙 付传奎 陈志鹏 李伟东 吴丽

关键词黄芩素;汉黄芩素;肝癌细胞;能量代谢;糖酵解代谢表型;线粒体能量代谢
以有氧糖酵解为代表的能量代谢重编程是肿瘤细胞的重要特征,常伴有不同程度的线粒体能量代谢异常[1]。这种代谢变化是肿瘤细胞为满足快速增殖需要,在提供一定数量三磷酸腺苷(adenosine triphosphate,ATP)的同时,为蛋白质、脂类和核酸等生物大分子的合成提供充足的中间体,并实现细胞能量代谢与物质代谢相平衡的一种适应性改变[1-5]。随着研究的深入,人们发现很多肿瘤细胞的能量代谢出现了糖酵解和氧化磷酸化均显著增强的特点,且在不同条件下存在显著的异质性和可塑性,能够影响疾病的进展与转归[6-9]。这种能量代谢表型的改变为抗肿瘤治疗提供了潜在的治疗靶点。
现代研究表明,黄芩中的有效成分主要为黄芩苷、汉黄芩苷、黄芩素、汉黄芩素等,其中黄芩素和汉黄芩素具有共同的母核,黄芩素含有3 个相邻羟基,而汉黄芩素中的1 个羟基被甲氧基取代,两者同为黄芩抗肿瘤作用的重要物质基础[10-11]。作者团队前期的网络药理学研究结果提示,黄芩素、汉黄芩素可通过抑制肿瘤细胞的能量代谢产生抗肿瘤作用[12]。本文旨在研究黄芩素和汉黄芩素影响肝癌细胞能量代谢的不同作用特点,分析两者影响肝癌细胞能量代谢的构效关系,以期为黄芩素和汉黄芩素的抗肿瘤作用机制研究提供新的思路。
1 材料
1.1 仪器
A1301026 型低温高速离心机购自上海艾测电子科技有限公司;SW-CJ-1G型双人无菌操作台购自苏州市苏杭科技器材有限公司;INCO108 型CO2细胞培养箱购自德国Memmert 公司;Seahorse XF96 生物能量检测仪购自美国Seahorse Bioscience 公司;CKX-31 倒置显微镜购自日本Olympus 公司;KQ5200DB台式数控超声波清洗器购自昆山市超声仪器有限公司;BP121S 电子分析天平购自瑞士Mettler Toledo公司。
1.2 药物与试剂
黄芩素(纯度≥98%,批号H-018-170427)、汉黄芩素(纯度≥98%,批号H-019-180823)标准品购自中国药品生物制品检定所;MTT(批号23305-68-2)、线粒体酶复合物Ⅰ~Ⅴ(CⅠ~Ⅴ)抗体(批号分别为12444-1-AP、14865-1-AP、10894-1-AP、55070-1-AP、15999-1-AP)、己糖激酶(hexokinase,HK)抗体(批号22029-1-AP)、磷酸果糖激酶(phosphofructokinase,PFK)抗体(批号55028-1-AP)、丙酮酸激酶M2(pyruvate kinase M2,PKM2)抗体(批号15822-1-AP)、ATP5F1 抗体(货号15999-1-AP)、NDUFS1 抗体(货号12444-1-AP)、PK-Specific 抗体(货号15822-1-AP)、CYB5R3 抗体(货号10894-1-AP)、HK2抗体(货号13105-1-AP)、MTCO2抗体(货号55070-1-AP)、SDHA 抗体(货号14865-1-AP)、β-肌动蛋白(β-actin)抗体和羊抗兔IgG 二抗购自美国Proteintech 公司;二甲基亚砜(批号BCBR6170V)购自北京索莱宝科技有限公司;2- 脱氧-D- 葡萄糖(2-deoxy-D-glucose,2-DG,批号BCBC9986V)、寡霉素(ATP 合酶阻滞剂,批号089K7008V)、鱼藤酮(CⅠ抑制剂,批号MKBZ2534V)、线粒体压力测试试剂盒(货号103015-100)、糖酵解压力测试试剂盒(货号103020-100)购自美国Seahorse Bioscience公司;抗霉素A(C Ⅲ 抑制剂,货号MS0070-10MG)购自上海懋康生物科技有限公司;RIPA裂解液(货号P0013K)、苯甲基磺酰氟(PMSF,货号ST506)、TBST缓冲液(货号P0231)、增强型ATP 检测试剂盒(批号112614170503)、BCA 蛋白质分析试剂盒(批号102815160401)购自上海碧云天生物技术有限公司。
1.3 细胞
人肝癌HepG2细胞株购自中国科学院上海细胞库。
2 方法
2.1 HepG2 细胞活力检测
取对数生长期的HepG2 细胞接种至96 孔板中,每孔含1×104 个细胞,于37 ℃、5%CO2 培养箱中培养过夜。根据作者团队前期实验结果[12],将细胞分为空白对照组(不给药)、黄芩素不同剂量组和汉黄芩素不同剂量组(均为1.25、2.5、5、10、20 μmol/L),分别加入相应剂量的黄芩素和汉黄芩素培养24 h,每组设6 个复孔。培养结束后每孔加入0.5% MTT 溶液20 μL,37 ℃孵育4 h后,每孔加入100 μL 二甲基亚砜振荡10 min,在450 nm波长处检测吸光度(A)值,计算得6 个复孔的平均A值。细胞生长抑制率(%)=(1-给药组平均A 值/空白对照组平均A 值)×100%,利用SPSS 软件计算2 种药物的半数抑制浓度(IC50)。
2.2 HepG2 细胞中ATP浓度检测
采用增强型ATP 检测试剂盒检测。将HepG2 细胞接种至48 孔板中,于37 ℃、5%CO2培养箱中培养过夜,每孔含2.5×104个细胞。根据“2.1”项下筛选结果,以不影响细胞活力为前提,将细胞分为空白对照组(不给药)、黄芩素组、汉黄芩素组,分别加入相應剂量的黄芩素和汉黄芩素培养12 h,每组6 个复孔。培养结束后,检测细胞中ATP 浓度,再通过BCA 蛋白分析试剂盒将细胞内的ATP浓度标准化为蛋白质含量。
2.3 HepG2 细胞糖酵解压力测试和线粒体压力测试
将HepG2 细胞接种至96 孔板中,于37 ℃、5%CO2培养箱中培养过夜,每孔含5×103个细胞。根据“2.2”项下方法进行细胞分组、给药,培养12 h,每组6 个复孔。培养结束后,采用带有糖酵解和线粒体压力测试试剂盒的生物能量检测仪分别检测细胞外酸化率和细胞耗氧率,评价细胞糖酵解及线粒体能量代谢水平。细胞使用测定培养基洗涤后,于37 ℃、5%CO2培养箱中孵育1 h。在糖酵解压力测试中,于22 min时加入10 mmol/L葡萄糖,检测基础细胞外酸化率;于44 min时加入1 μmol/L寡霉素,检测细胞最大酸化率,即细胞的最大糖酵解水平;于72 min 时加入50 mmol/L 2-DG,检测细胞非糖酵解的酸化率。在线粒体压力测试中,基础耗氧率为加入寡霉素前的细胞耗氧率;于22 min 时加入0.5 μmol/L寡霉素;于44 min 时加入试剂盒自带的氧化磷酸化解偶联剂FCCP(0.5 μmol/L),检测最大细胞耗氧率,呼吸储备功能为最大细胞耗氧率与基础细胞耗氧率之间的差异;于72 min 时加入0.5 μmol/L鱼藤酮和0.5 μmol/L抗霉素A,检测细胞非线粒体呼吸水平。
2.4 黄芩素和汉黄芩素影响能量代谢的靶点预测
以糖酵解、线粒体能量代谢关键酶(表1)为研究对象,使用分子对接技术分析黄芩素和汉黄芩素影响能量代谢的可能作用靶点。从蛋白质数据库(PDB,http://www.pdb.org)下载三维晶体结构[13]。将受体的晶体结构坐标加载到Discovery Studio 4 软件,默认格式为线性结构模型,优化处理后保存备用。使用ChemBioDrawUltra 12.0 软件制备黄芩素和汉黄芩素的配体分子,并进行能量最小化优化[14]。采用Discovery Studio 4 软件的CDOCKER模块对黄芩素和汉黄芩素与8 种能量代谢关键酶的蛋白质分子对接,使用Compute 模块下的3D质子化功能,可自动优化氢原子并对其质子化[15-16]。按照上述方法将蛋白质的能量进行最小化优化,选择分子对接结果显示最有利的结合模式和负CDOCKER相互作用的最高能量值。目标蛋白(能量代谢关键酶)和不同化学成分结合力的强度通过能量值的大小来评估,以能量值的绝对值7 为划分亲和力强弱的界限,其绝对值越大,表示两者间亲和力越强,是药物作用靶点的可能性越大[17]。
2.5 HepG2 细胞中能量代谢关键酶表达的检测
采用Western blot 法检测。将HepG2 细胞接种至6孔板中,每孔含0.5×106~1.0×106个细胞。根据“2.2”项下方法进行细胞分组、给药,培养24 h,每组6 个复孔。培养结束后,PBS 洗涤细胞2 次,裂解后采集细胞提取物。采用裂解缓冲液(由RIPA裂解液、PMSF 以100 ∶1比例组成)冰上采集细胞提取物,以12 000 r/min 于4 ℃离心5 min,取上清液,采用BCA 试剂盒检测蛋白质浓度。将5×加样缓冲液与标本蛋白按1 ∶4 比例混匀,沸水浴10 min,以12 000 r/min 于4 ℃离心10 min,取上清液,根据检测的蛋白浓度确定上样量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(10%分离胶)。上样后先用40mA跑120 min,再以100 V转膜100 min,然后用5%BSA封闭液在4 ℃环境下封闭2 h;加入内参抗体β-actin 和各一抗(ATP5F1、NDUFS1、PK-Specific、CYB5R3、HK2、MTCO2、SDHA、PKM2,稀释度均为1 ∶ 100),4 ℃孵育过夜;1×TBST 洗膜6 次,每次5 min,加入二抗(稀释度1 ∶200),4 ℃孵育1 h;1×TBST洗膜6 次,每次5 min。利用暗室显影技术采集化学发光图像。用Image Lab 软件进行图像分析,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示目的蛋白的表达水平。
2.6 统计学分析
使用SPSS 20.0 统计软件进行统计学分析,计量资料以x±s 表示,多组间比较采用方差分析,多重比较采用Scheffe检验,检验水准α=0.05。
3 结果与分析
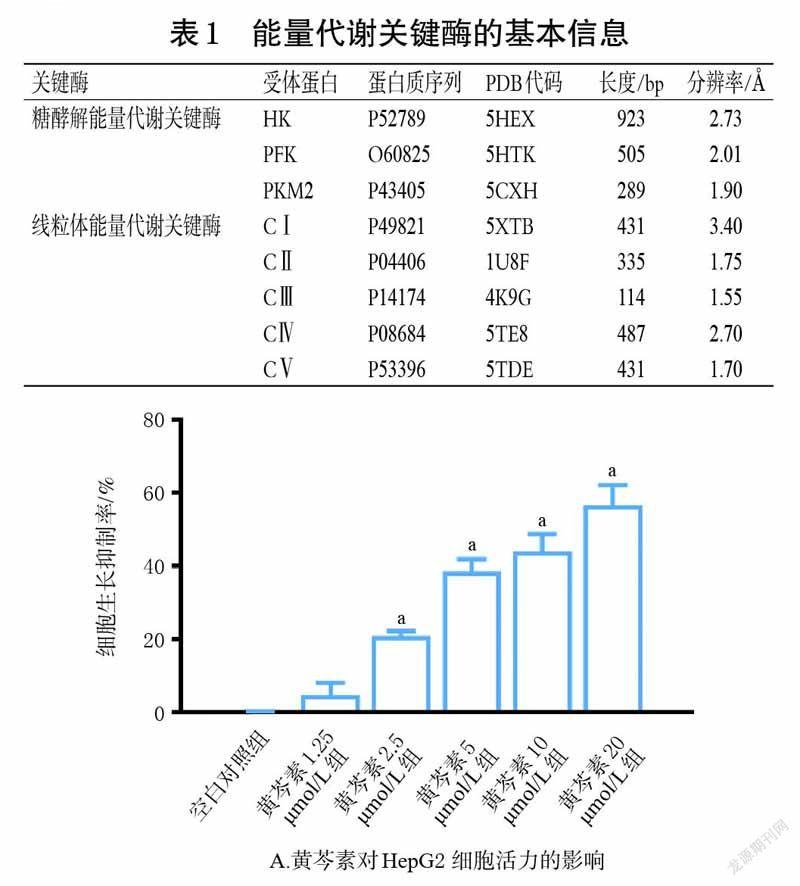
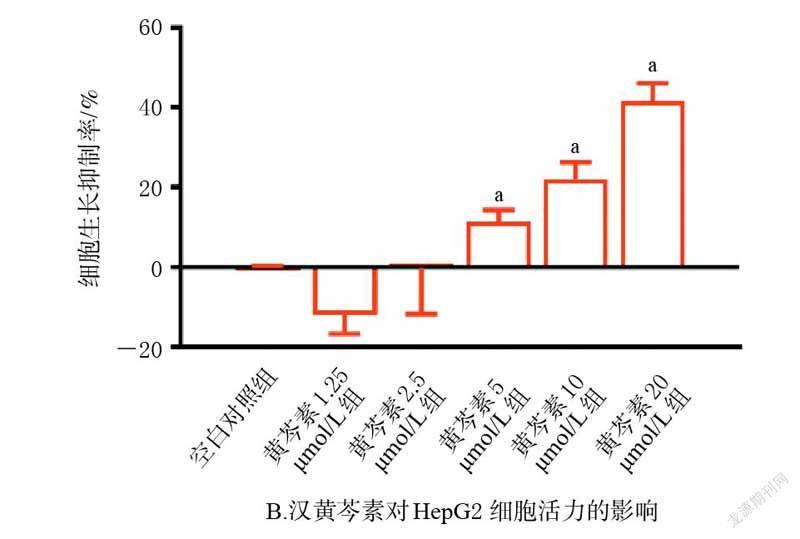
3.1 黄芩素和汉黄芩素对HepG2 细胞活力的影响
MTT 实验结果显示,在2.5~20 μmol/L 剂量范围内,黄芩素和汉黄芩素均能抑制HepG2 细胞增殖(P<0.05),且呈剂量依赖趋势。进一步计算IC50值,其中黄芩素的IC50值为12.84 μmol/L、汉黄芩素为24.09 μmol/L,提示黄芩素对HepG2 细胞活力的抑制作用较汉黄芩素更强。为排除细胞活力过低对能量代谢相关指标的影响,后续实验采用对细胞活力无显著影响的剂量开展研究,即黄芩素1.25 μmol/L 为黄芩素组剂量,汉黄芩素2.5 μmol/L為汉黄芩素组剂量。结果见图1。
3.2 黄芩素和汉黄芩素对HepG2 细胞中ATP 浓度的影响
ATP检测结果显示,与空白对照组[(148.10±12.48)nmol/mg pro]比较,黄芩素组[(127.74±6.05)nmol/mgpro]、汉黄芩素组[(122.65±4.71)nmol/mg pro] HepG2细胞中ATP 浓度显著降低(P<0.05),提示黄芩素和汉黄芩素均能明显降低HepG2细胞中的ATP浓度。
3.3 黄芩素和汉黄芩素对HepG2 细胞糖酵解的影响
糖酵解压力测试结果显示,与空白对照组比较,黄芩素组、汉黄芩素组HepG2 细胞基础酸化率均显著降低(P<0.05),表明其能明显降低细胞糖酵解水平;且给予寡霉素抑制ATP 合成酶的活性后,2 个给药组细胞最大酸化率均较空白对照组显著降低(P<0.01),提示黄芩素和汉黄芩素不仅能直接抑制糖酵解,还能抑制细胞在应激状态下能量代谢表型的转变。进一步比较黄芩素组、汉黄芩素组的结果显示,汉黄芩素组细胞基础酸化率较黄芩素组显著降低(P<0.05),提示汉黄芩素对糖酵解的抑制作用较黄芩素更强。结果见图2。
3.4 黄芩素和汉黄芩素影响糖酵解能量代谢关键酶的靶点预测结果
分子对接评估黄芩素和汉黄芩素与糖酵解能量代谢关键酶HK、PFK、PKM2 相互作用的结合能量值,结果显示,黄芩素和汉黄芩素与PKM2 对接的最大能量值分别为-7.904、-7.626 kJ/mol,亲和力较强;黄芩素和汉黄芩素与HK、PFK 对接的最大能量值的绝对值均小于7,亲和力较弱。
进一步分析黄芩素和汉黄芩素与PKM2 的作用力发现,黄芩素与PKM2 的作用以氢键、范德华力为主,而汉黄芩素与PKM2 之间的作用力主要为范德华力。分析原因为:黄芩素有2 个芳香环、3 个相邻羟基,在分子结构上共轭程度强,电子传递能力强,易与糖酵解关键酶形成稳定氢键,结合力更强;而汉黄芩素只有2 个相邻羟基,与糖酵解关键酶形成稳定氢键的结合力较弱[18]。该结果部分解释了黄芩素和汉黄芩素对糖酵解的抑制机制。
3.5 黄芩素和汉黄芩素对HepG2 细胞糖酵解能量代谢关键酶表达的影响
Western blot 检测结果显示,与空白对照组比较,汉黄芩素组HepG2 细胞中HK、PFK、PKM2 的蛋白表达水平显著降低(P<0.05 或P<0.01),提示下调糖酵解关键酶表达是汉黄芩素抑制HepG2 细胞能量代谢的重要机制;黄芩素组糖酵解关键酶的蛋白表达水平虽有下降趋势,但与空白对照组比较差异无统计学意义(P>0.05),综合分子对接结果,提示黄芩素可能通过抑制PKM2 蛋白活性进而抑制糖酵解。结果见图3。
3.6 黄芩素和汉黄芩素对HepG2 细胞线粒体能量代谢的影响
线粒体压力测试结果显示,与空白对照组比较,黄芩素组、汉黄芩素组细胞的基础耗氧率均显著降低(P<0.05 或P<0.01),提示这2 种成分能干预线粒体呼吸链的氧化还原反应,降低细胞的线粒体能量代谢水平。给予寡霉素后,黄芩素组、汉黄芩素组细胞耗氧率均明显下降,但与空白对照组比较差异无统计学意义(P>0.05)。
给予FCCP后,细胞耗氧率显著增加,迅速达到最大耗氧率;与空白对照组比较,黄芩素组、汉黄芩素组均能降低HepG2 细胞的最大耗氧率,其中黄芩素组差异有统计学意义(P<0.05),提示黄芩素和汉黄芩素能不同程度地抑制线粒体能量代谢的呼吸储备功能。结果见图4。
黄芩素和汉黄芩素对HepG2 细胞线粒体能量代谢均有不同程度的影响,分析原因如下:(1)在肝癌细胞中,线粒体能量代谢被激活,氧化磷酸化作用异常强烈,导致药物作用明显[19];(2)氧化磷酸化的关键酶均集中在线粒体膜上,而细胞内线粒体数量多(每个细胞约含1 000 个线粒体),导致药物作用靶点较多且集中[20]。
3.7 黄芩素和汉黄芩素影响HepG2 细胞线粒体能量代谢关键酶的靶点预测结果
分子对接评估黄芩素和汉黄芩素与线粒体能量代谢关键酶CⅠ~Ⅴ相互作用的结合能量值,结果显示,黄芩素具有最有利的构象,易与CⅠ、CⅡ、CⅣ蛋白上的活性位点结合,其对接的最大能量值分别为-7.786、-7.030、-7.693 kJ/mol;而汉黄芩素可与CⅠ、CⅡ、CⅣ蛋白结合,但亲和力较弱,其最大能量值的绝对值均小于7。
进一步分析发现,黄芩素可与CⅠ(氢键、共价键)、CⅡ(氢键、共价键)、CⅣ(氢键、共价键)相互作用。分析原因为:黄芩素和汉黄芩素均有2 个芳香环;黄芩素有3 个相邻羟基,易与受体蛋白的氨基酸残基形成稳定的氢键,与线粒体能量代谢关键酶亲和力强,易形成稳定结构;汉黄芩素有1 对间位羟基,且相邻1 个甲氧基,具有较大的空间位阻,影响氢键的形成[21],故与受体蛋白的亲和力较弱。该结果部分解释了黄芩素和汉黄芩素对线粒体能量代谢的抑制机制。
3.8 黄芩素和汉黄芩素对HepG2 细胞线粒体能量代谢关键酶表达的影响
Western blot 结果显示,与空白对照组比较,汉黄芩素組细胞中CⅠ、CⅡ、CⅣ的蛋白表达水平均显著降低(P<0.05 或P<0.01),而黄芩素组细胞中线粒体能量代谢关键酶的表达水平差异无统计学意义(P>0.05),提示黄芩素主要与关键酶结合,通过影响关键酶的催化活性来调节HepG2细胞的能量代谢。结果见图5。
4 结论
本研究结果表明,黄芩素和汉黄芩素均能降低HepG2细胞糖酵解和线粒体能量代谢水平,抑制细胞能量代谢。更重要的是,两者均能降低HepG2 细胞线粒体能量代谢的储备能力,抑制细胞应激状态下糖酵解和线粒体能量代谢的转化功能,导致细胞对恶劣环境的适应能力减弱。
进一步实验表明,黄芩素与PKM2、CⅠ、CⅡ、CⅣ蛋白的亲和力强,但对其蛋白表达水平无显著影响,推测这可能与黄芩素具有3 个相邻羟基有关:一方面黄芩素容易与蛋白上的活性位点形成稳定的氢键,表现出强亲和力,结合力更高;另一方面黄芩素易失去氢质子使区域内电负性增强,而线粒体具有双层膜结构,内膜向内折入形成嵴,内膜外侧带正电,内膜内侧带负电,形成约-180 mV的膜电位[22-24],且黄芩素易溶于脂溶性溶剂,故黄芩素可能更容易进入线粒体,从而干预能量代谢关键酶的功能,抑制细胞能量代谢。汉黄芩素只与PKM2 蛋白的结合力较强,这可能与汉黄芩素除含有2个羟基外还引入了甲氧基有关,较大的空间位阻阻碍了较多氢键的形成,故与蛋白的亲和力较弱[24]。Westernblot 结果提示,汉黄芩素可显著下调HK、PFK、PKM2、CⅠ、CⅡ、CⅣ蛋白的表达,其抑制能量代谢的机制与下调能量代谢关键酶的表达有关。
综上所述,黄芩素和汉黄芩素均能抑制肝癌细胞能量代谢,但作用机制不同:黄芩素的作用与影响关键酶活性有关,而汉黄芩素的作用与抑制能量代谢关键酶表达有关。

