洋甘菊总黄酮对HepG2细胞脂质沉积的改善作用研究
阿曼古丽·艾则孜 马红梅 兰卫


关键词洋甘菊总黄酮;脂质沉积;降脂作用
近年来,随着社会的飞速发展和人们物质生活水平不断提高,高脂血症患者不断增加,发病率逐年升高[1]。
游离脂肪酸(non-esterified fatty acids,FFA)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)中的1种及以上升高或脂蛋白水平升高即可诊断为高脂血症[2]。该病可引发如心肌梗死、心脏猝死、糖尿病、高血压、脂肪肝等一系列疾病,是形成冠心病的主要原因之一[3],因此,对高脂血症的预防与治疗意义重大。洋甘菊是菊科母菊属,又称德国洋甘菊,为菊科植物洋甘菊Matricaria chamomilla L.的干燥花或全草。洋甘菊具有降低血压、降低胆固醇、发汗通便等功效,其提取物(如黄酮类)具有抗炎、抗氧化、抗肝毒性、抗病毒、保护血管和解痉等作用[4-5]。本实验采用油酸和棕榈酸联合诱导HepG2 细胞建立脂质沉积细胞模型,探讨洋甘菊总黄酮对肝脂质异常的调节作用及其降脂机制,以期为洋甘菊治疗高脂血症的临床应用提供实验依据。
1 材料
1.1 主要仪器
STS-2 型脱色摇床购自上海琪特分析仪器有限公司;Benchmark Plus 型全波长酶标仪、Power Pac 型垂直电泳槽、Gel Doc XR+型凝胶成像分析系统、AB135-S 型电子分析天平购自美国Bio-Rad 公司;5424R 型低温高速离心机购自德国Eppendorf 公司;SW-XJ-2F 型超净台购自苏州安泰空气技术有限公司;371 型直热式CO2恒温培养箱购自美国Thermo Fisher Scientific 公司;IX71-5-12FL/pH 型倒置荧光三目显微镜购自德国RoperScientific 公司;DW-HL668 型超低温冰箱购自合肥中科美菱低温科技股份有限公司;TCS SP8 型激光共聚焦显微镜购自德国Leica 公司;RE-52B型旋转蒸发仪购自上海亚荣生化仪器厂。
1.2 主要试剂
TG 试剂盒、FFA 试剂盒、丙氨酸转氨酶(alanineaminotransferase,ALT)试剂盒、天冬氨酸转氨酶(aspartateaminotransferase,AST)试剂盒(批号分别为A110-1-1、A042-2-1、C009-2-1、C010-2-2)购自南京建成生物工程研究所;油红O 溶液、棕榈酸、油酸(批号分别为SLBW7964、SLBZ8298、0459K073)购自美国Sigma 公司;青霉素+链霉素双抗、4%多聚甲醛组织固定液(批号分别为Bj111995904、1810473)购自合肥白鲨生物科技有限公司;乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合成酶(fatty acid synthase,FAS)、二酰基甘油酰基转移酶2(diacylglycerol transferase 2,DGAT2)、β-肌动蛋白(β-actin)抗体、辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号分别为bsm-52486R、bsm-54469R、bs-12998R、bs-0061R、bs-0295G-HRP)购自北京博奥森生物技术有限公司;牛血清白蛋白(批号EZ6688B182)购自德国BioFroxx 公司;10×TBST、D-101 大孔树脂(批号分别为T1081、1021Q011)购自北京索莱宝科技有限公司;DAPI染液、Alexa Fluor488 标记的山羊抗兔IgG 二抗(批号分别为C1005、A0423)购自上海碧云天生物技术有限公司;DMEM培养基(批号AF29562465)购自美国HyClone 公司;胎牛血清、25%胰蛋白酶(批号分别为70101002、2186974)购自美国Gibco 公司;彩色蛋白Marker(40~300 kDa,批号26625)购自美国ThermoFisher Scientific 公司;彩色蛋白Marker(10~250 kDa,批号3580111)购自北京博泰斯生物技术有限公司;磷酸盐缓冲液(PBS,批号26625)购自北京中杉金桥生物技术有限公司;亚硝酸钠、氢氧化钠(批号分别为20200803、20210320)购自天津市盛奥化学试剂有限公司;硝酸铝(批号20200305)购自天津市永晟精细化工有限公司。其他试剂均为国产优质分析纯。
1.3 主要药物
洋甘菊药材采自新疆医科大学中医学院药材基地,经新疆医科大学第四附属医院李永和主任中药师鉴定为母菊属一年生草本植物洋甘菊的干燥花。非诺贝特胶囊(规格0.2 g/粒,批号20181239)购自美国Abbott公司。
1.4 细胞
人肝癌HepG2 细胞株购自武汉普诺赛生命科技有限公司。
2 方法
2.1 洋甘菊总黄酮的制备
2.1.1 洋甘菊总黄酮的初步提取取洋甘菊药材700 g,用12 倍体积(8 400 mL)的70%乙醇浸泡2 h,放入提取锅在80 ℃提取3 次,每次2 h;合并提取液,用纱布过滤,滤液用旋转蒸发仪在80 ℃浓缩回收乙醇,待浓缩液总体积为700~800 mL,冷冻干燥,收集干膏粉。
检测洋甘菊总黄酮提取物中的总黄酮含量。总黄酮含量检测方法[6]:取干膏粉0.029 70 g,置于25 mL量瓶中,用甲醇定容至刻度,超声助溶,充分溶解;取10 mL置于25 mL量瓶中,依次加入5%亚硝酸钠溶液、10%硝酸铝溶液各1 mL,每加1 种试剂后,室温放置6 min;再加入4%NaOH溶液10 mL,用甲醇定容至刻度,摇匀,在500 nm波长处检测吸光度(A)值,按回归方程A=0.011 30C+0.009 25 計算提取物中的总黄酮含量,其中C表示总黄酮含量。
2.1.2 洋甘菊总黄酮的分离纯化取“2.1.1”项下干膏粉36.93 g,用3 000 mL蒸馏水溶解制成含总黄酮约0.8mg/mL 的溶液,用D-101 大孔树脂(使用前均用95%乙醇浸泡2 h,再以大量蒸馏水洗至无醇味)填好分离柱后上样,上样量为16 倍柱体积,上样速度为1.0 mL/min。上样完成后,用大量蒸馏水洗去吸附在大孔树脂柱中的还原糖类成分,洗脱速度为1.0 mL/min。最后用70%乙醇洗脱,收集吸附在大孔树脂上的黄酮类成分,洗脱速度为0.5 mL/min。蒸馏水洗脱和乙醇洗脱用量均控制在柱体积的6 倍左右。洗脱液采用旋转蒸发仪在70 ℃挥干乙醇,冷冻干燥,收集纯化后的干膏粉。
取纯化后的干膏粉0.028 10 g,置于25 mL量瓶中,用甲醇定容,超声助溶,充分溶解;取1 mL置于25 mL量瓶中,按照“2.1.1”项下同法检测纯化后的总黄酮含量。
2.2 造模
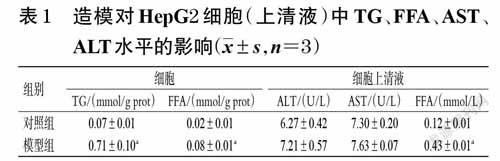
HepG2 细胞用含10%胎牛血清、1%青/链霉素的高糖DMEM培养基,在5%CO2、37 ℃条件下培养。待细胞处于对数生长期时,以5×104个/mL 接种于6 孔板,每孔500 μL。细胞分为对照组和模型组。待细胞贴壁后,对照组给予含10% 胎牛血清、1% 青/链霉素的高糖DMEM 培养基继续培养,模型组加入终浓度均为1mmol/L 的油酸和棕榈酸混合液[7],培养24 h 后收集培养液和细胞。根据AST、ALT、FFA检测试剂盒说明书上的操作步骤,采用酶标仪检测上清液中的AST、ALT、FFA水平。加细胞裂解液裂解细胞后,将细胞刮下来,以12 000 r/min 于4 ℃离心细胞裂解液10 min,取上清液,用BCA试剂盒检测细胞中的TG、FFA水平。结果显示,与对照组比较,模型组细胞中的TG、FFA水平显著升高(P<0.01);细胞上清液中的FFA 水平显著升高(P<0.01),ALT、AST水平差异无统计学意义(P>0.05)。这说明造模后细胞内脂质类成分增加,但细胞未受到严重损伤,表明成功诱导HepG2 细胞建立脂质沉积细胞模型[8],可进行后续实验。结果见表1。
2.3 TG、FFA水平检测
采用Benchmark Plus型全波长酶标仪检测。取对数生长期细胞,以5×104个/mL接种于6 孔板,每孔500 μL。细胞分为对照组、模型组、非诺贝特组(阳性对照,终质量浓度为3.61 μg/mL)和洋甘菊总黄酮低、中、高剂量组(终质量浓度分别为100、150、200 μg/mL)[7]。待细胞贴壁后,对照组给予含10%胎牛血清、1%青/链霉素的高糖DMEM培养基继续培养,其余5 组按照“2.2”项下进行造模,再给予相应剂量药物干预24 h 后,吸取6 孔板中的培养液,分别按FFA检测试剂盒说明书上的操作步骤检测各组细胞上清液中的FFA水平和细胞中的TG、FFA水平。
2.4 脂质积累的观察与脂质含量的检测
采用倒置显微镜观察并用Benchmark Plus 型全波长酶标仪检测。取对数生长期细胞,以5×104个/mL接种于6 孔板,每孔500 μL。细胞按照“2.3”项下方法分组、造模、给药后,吸弃培养液,用PBS 轻缓漂洗2 次;加入4%多聚甲醛溶液固定30 min左右,再用PBS轻缓漂洗2次;每孔加入1.5 mL的油红O染液(去离子水与油红O溶液体积比为3 ∶2)染色30 min,用PBS 漂洗1 次,60%异丙醇固定;用PBS 清洗掉多余的油红O染液,甘油明胶封片,倒置显微镜下观察并拍照。细胞内脂质类成分可以与油红O染液特异性结合呈橘红色,橘红色区域大小可以反映HepG2 细胞的脂质沉积状况。拍照结束后,吸弃上清液,每孔加入1 mL 异丙醇,轻柔摇晃10~15min 使染剂充分溶解,以酶标仪检测在490 nm波长处的吸光度(A)值,用以表示脂质含量。
2.5 DGAT2蛋白表达量的检测
采用DAPI染液染色法观察并检测。取对数生长期细胞,以5×104个/mL接种至共聚焦皿中,每皿200 L。细胞按照“2.3”项下方法分组、造模、给药后,以4%多聚甲醛溶液室温固定30 min,PBS冲洗2 次,每次3 min;在圈内滴加3%牛血清白蛋白溶液300 μL均匀覆盖组织,封闭1 h 后,吸弃封闭液,PBS冲洗2 次,每次3 min;在圈内滴加DGAT2 一抗(稀释度1 ∶300),用封口膜封口,湿盒内4 ℃孵育过夜;次日吸走一抗,PBS 冲洗3 次,每次3min;圈内滴加入300 μLAlexa Fluor488 标记的山羊抗兔IgG 二抗(稀释度1 ∶300),室温下继续避光孵育2 h,PBS冲洗3 次,每次3 min;在圈内滴加200 μL DAPI 染液避光染色10 min,PBS 冲洗3 次,每次3 min;每皿加入1mL PBS 冲洗,用TCS SP8 型激光共聚焦显微镜观察并拍照。DAPI染液染色后细胞核在紫外光激发下显蓝色荧光,DGAT2 蛋白阳性表达显绿色荧光。每个样本选取3 个视野,使用Image J 软件统计DGAT2 蛋白表达的荧光强度,荧光强度越大表示蛋白表达量越高。
2.6 ACC、FAS、DGAT2 蛋白表达水平的检测
采用Western blot 法检测。细胞培养至形态正常且贴壁满70%~80%时,消化计数后以5×104个/mL 接种至培养瓶中。细胞按照“2.3”项下方法分组、造模、给药后,弃上清液,每瓶加PBS 2 mL冲洗2 次,每次1 min;每瓶加细胞裂解液200 μL,冰浴裂解30 min。将裂解的细胞刮下来并转移至EP管中,以12 000 r/min 于4 ℃离心10 min;将细胞上清液转移至1.5 mL EP管中;用BCA法检测总蛋白浓度,样品中加入4×蛋白上样缓冲液和双蒸水,使总蛋白浓度调成一致,100 ℃煮蛋白10 min,再置于-80 ℃冰箱备用。将蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转移至PVDF 膜,取出PVDF 膜置于含5%脱脂奶粉的TBST封闭液中封闭1.5 h,洗涤3 次后加入一抗(ACC、FAS稀释度1 ∶700,DGAT2、β-actin 稀释度1 ∶1 000),4 ℃孵育过夜,收集一抗,洗涤3 次;加入二抗(稀释度1 ∶ 5 000),室温避光孵育1 h,洗涤3 次;然后暗室中以ECL 发光试剂曝光,压片、显影、定影后用Image Lab 软件分析图像,以目標蛋白与内参蛋白(β-actin)的灰度值比值表示目标蛋白的表达水平。
2.7 统计学分析
采用SPSS 21.0 统计软件对各组数据进行统计分析,计量资料以x±s 表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 洋甘菊总黄酮的制备结果
初步提取得到的干膏粉中,总黄酮含量为6.72%;纯化后的干膏粉中,总黄酮含量为56.20%。这表明分离纯化后,洋甘菊总黄酮含量明显提高。
3.2 洋甘菊总黄酮对细胞(上清液)中TG、FFA水平的影响
与对照组比较,模型组细胞中的TG、FFA水平和细胞上清液中的FFA水平均显著升高(P<0.01)。与模型组比较,非诺贝特组和洋甘菊总黄酮低、中、高剂量组细胞中的TG、FFA水平和细胞上清液中的FFA水平均显著降低(P<0.01)。结果见图1。
3.3 洋甘菊总黄酮对HepG2 细胞脂肪积累的影响
由油红O染液染色结果可见,对照组细胞间结合紧密,基本上无橘红色脂滴;模型组细胞中可见大量橘红色脂滴堆积,表明1 mmol/L 油酸和棕榈酸混合液干预24 h 能显著增加细胞内脂质沉积;非诺贝特组和洋甘菊总黄酮低、中、高剂量组细胞中脂滴堆积较模型组显著减少。结果见图2。
脂质含量检测结果显示,与对照组细胞脂质A 值(0.30±0.11)比较,模型组细胞脂质A值(0.93±0.14)显著升高(P<0.01);与模型组比较,非诺贝特组和洋甘菊总黄酮低、中、高剂量组细胞脂质A 值(0.34±0.09、0.54±0.17、0.43±0.13、0.43±0.06)显著降低(P<0.01)。以上结果进一步验证了油红O染液的染色实验结果,说明洋甘菊总黄酮可以降低脂质沉积细胞中的脂质含量。
3.4 洋甘菊总黄酮对HepG2 细胞中DGAT2 蛋白表达量的影响
由DAPI 染液染色结果可见,模型组细胞绿色荧光明显增强,表明DGAT2 蛋白表达量明显上调;非诺贝特组和洋甘菊总黄酮低、中、高剂量组绿色荧光明显减弱,DGAT2 蛋白表达量明显下调。结果见图3。
荧光强度检测结果显示,与对照组(23.53±1.88)比较,模型组DGAT2 蛋白表达荧光强度(81.40±7.21)显著升高(P<0.01);与模型组比较,非诺贝特组和洋甘菊总黄酮低、中、高剂量组DGAT2 蛋白表达荧光强度(35.85±2.97、44.77±1.05、35.95±1.42、35.72±1.17)显著降低(P<0.01)。以上结果进一步验证了DAPI 染液的染色实验结果,说明洋甘菊总黄酮可以降低脂质沉积细胞中的DGAT2 蛋白表达量。
3.5 洋甘菊总黄酮对HepG2 细胞中ACC、FAS、DGAT2 蛋白表达水平的影响
Western blot 法检测结果显示,与对照组相比,模型组ACC、FAS、DGAT2 蛋白表达水平显著升高(P<0.01);与模型组相比,非诺贝特组和洋甘菊总黄酮低、中、高剂量组ACC、FAS、DGAT2 蛋白表达水平显著降低(P<0.01)。结果见图4。
4 讨论
过量FFA蓄积在肝,超过肝的代谢能力时会对细胞产生脂毒性,并可能诱导脂肪肝的发生。棕榈酸是大部分哺乳动物体内FFA的重要组成部分,参与FFA在体内的脂质生物合成过程;其除对细胞有脂毒性外,与油酸共同作用可诱导肝细胞发生脂肪变性[9-10]。AST、ALT是细胞非特异性功能酶,AST 主要存在于肝细胞线粒体,ALT 存在于肝细胞的细胞质,两者可以较准确地反映肝脏病理损伤程度,已成为公认的最灵敏的肝细胞损伤指标[11-12]。本实验以HepG2 细胞为研究对象,分别用1 mmol/L油酸和棕榈酸混合液联合诱导HepG2 细胞,结果显示,与对照组比较,模型组细胞中的TG、FFA水平和上清液中的FFA 水平显著升高,而细胞上清液中的ALT、AST 水平差异无统计学意义,说明模型组细胞未发生严重的脂质性损伤,符合脂质沉积细胞模型建立要求[8],造模成功。
洋甘菊是常用中药材,洋甘菊总黄酮提取物主要成分有槲皮素、木犀草素及其衍生物等[13]。研究发现,槲皮素是一种潜在的生物类黄酮,具有抗癌、抗氧化、抗炎、抗衰老、神经保护等药理活性,对肥胖症、癌症、糖尿病具有明显的治疗作用[14],对大鼠脂质代谢紊乱、肝功能损伤及神经精神行为障碍有改善作用[15]。槲皮素可以显著降低血清TG、TC、低密度脂蛋白、极低密度脂蛋白和组织中TG、TC 水平,显著升高血清高密度脂蛋白水平[16]。木犀草素及其衍生物可以改善糖和脂代谢紊乱[17]。本课题组前期研究显示,洋甘菊70%醇提物可以显著改善实验性高脂血症大鼠的血脂水平,具有明显的降脂保肝作用,且有效降脂成分主要为总黄酮[18]。洋甘菊70%醇提物中总黄酮含量较低(只有5%左右),若用大孔树脂进行分离纯化后可提高提取物中总黄酮含量(达50%左右)。因此,为提高洋甘菊总黄酮的降脂功效,本研究先对提取物进行分离纯化,得到较高含量的洋甘菊总黄酮(56.20%),再进一步研究洋甘菊总黄酮的降脂机制。非诺贝特是过氧化物酶增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)激活剂,而PPARα在肝脏组织中高表达,可以调控脂质合成关键基因DGAT2 的表达[19-20],所以本研究选择非诺贝特为阳性对照药来观察洋甘菊总黄酮的降脂作用机制。
本研究建立HepG2 细胞的脂质沉积细胞模型后,给予洋甘菊总黄酮100、150、200 μg/mL干预24 h。结果显示,与模型组比较,洋甘菊总黄酮低、中、高剂量组细胞中的TG、FFA水平和细胞上清液中的FFA水平均显著降低,脂滴堆积得到明显改善,脂质含量显著降低。这说明洋甘菊总黄酮可以有效改善HepG2 细胞的脂质沉积情况。
参与脂肪及TG生物合成的酶很多,其中FAS 催化脂肪合成的全过程;ACC是一种生物素依赖酶,催化长链脂肪酸合成過程;DGAT2 是参与二酰甘油/TG 生物合成的关键限速酶,可促进DGAT2 表达、增加TG合成、导致脂质累积[21-22]。以上酶在肝细胞脂肪酸合成及TG生物合成中起着至关重要的作用。研究发现,消痰化瘀类中药通过调控固醇调节元件结合蛋白(sterol regulatoryelement binding protein 1c,SREBP-1c)、FAS 和ACC 基因的过度表达,抑制脂质合成,促进脂肪酸氧化,从而减少肝脏脂质沉积[23] ;胰岛素类似物Exendin-4 可通过下调SREBP-1c、FAS和ACC基因的表达而降低由胰岛素引起的HepG2 细胞中TG水平的升高程度[24],减轻脂肪变性程度。杨玲等[25]研究发现,棕榈酸可引起BRL 3A细胞氧化应激,并通过提高SREBP表达及核转位效率,上调ACC、FAS、DGAT1、DGAT2 的mRNA及蛋白表达水平,促进TG合成,诱导脂肪变性。本研究结果表明,洋甘菊总黄酮能够下调脂肪酸诱导HepG2 细胞中TG合成相关蛋白ACC、FAS、DGAT2的表达。
综上所述,洋甘菊总黄酮可以抑制脂质沉积模型HepG2 细胞的TG合成,减少细胞脂质积累,防止细胞脂质损伤,其机制可能与下调ACC/FAS/DGAT2 通路表达有关。

