药物快速卫生技术评估方法学研究
刘梦娜 吴斌 艾丹丹 许倩 李雪 陈金榆 郭武栋

关键词抗肿瘤用药;快速卫生技术评估;卫生技术评估;多准则决策分析
生命科学、生物科技、医药技术的创新层出不穷、日新月异,提高了健康预期目标,而不断增长的健康需求与卫生健康事业发展不平衡、不充分成为各个国家和地区卫生健康决策者普遍面临的现实问题。近些年来,面对新技术的广泛应用、医疗费用的快速增长和医疗卫生体制改革中的利益调整,很多国家和地区开展了卫生技术评估(health technology assessment,HTA)工作,通过科学规范的证据分析和全面系统的综合评估,为医疗资源配置的循证决策提供了可靠依据和选择方案,为医疗技术准入、配置、定价、补偿、管理和淘汰等政策的制定提供了证据支持。
上述循证决策需求促进了HTA方法学的研究和应用。HTA方法学包括传统的完整HTA以及相对较新的快速卫生技术评估(rapid health technology assessment,rHTA)。完整HTA的质量较高,通常需要1~2 年的评估时间来完成。然而,卫生健康决策者往往需要及时的技术信息,以便在保证科学严谨性的前提下,用相对较短的时间推进决策。rHTA能够快速收集与整合证据,整个评估过程较HTA大幅缩短,是一个新兴的方法学领域,并越来越受到不同类型决策者的青睐。实证研究领域已经有了比较完整HTA和rHTA的相关研究,两种评估方法学的研究结果都表明,完整HTA包含更多细节,但通过完整HTA和rHTA得出的总体结论是相似的[1-4]。
本研究以多准则决策分析(multi-criteria decisionanalysis,MCDA)与HTA 为基础的Evidence and ValueImpact on Decision Making(EVIDEM)框架为纲,以抗肿瘤药物为抓手,探索建立基于我国国情的抗肿瘤用药rHTA方法学,具体包括评估维度、指标、数据、规则等;而后以疾病负担较重的肺癌用药为例,验证rHTA方法学的科学性和实操性,以便其更广阔的应用。
1 相关概念的介绍
1.1 HTA
HTA是利用循证医学、卫生经济学、社会学、医学伦理学以及其他相关学科的原理和方法,全面系统地评价卫生技术的安全性、有效性、经济性、创新性和公平性等,其目的是在有限的资源配置中实现价值最大化[1]。卫生技术包括药品、诊疗手段和设备、公共卫生和其他卫生干预措施,科学地评估这些技术可为决策者提供卫生科学的信息。HTA可以回答该技术在真实环境里安全有效性如何,是否具有经济性,合适的价格是多少,对医保资金预算影响多大,其创新性是否可以有效提升患者可及性和便利性,是否可以改善患者依从性等一系列问题[2]。
1.2 MCDA
MCDA作为一项可以帮助决策者从多个角度对卫生技术进行评估的工具,通过一系列方法对卫生技术进行价值评估,从而确定最佳选择[3-4]。在MCDA中,决策者根据研究主题,识别影响因素,制定适宜的评审标准,并对每一标准进行价值赋权,形成某主题的MCDA评价体系。然后根据评价体系对每一候选方案逐一打分,通过打分与权重计算每一候选方案的分值。MCDA评价结果使得候选方案的优缺点清晰明了,方便决策者选择[5]。自2010 年以来,关于MCDA的研究文献也逐渐增多,主要为MCDA应用于临床诊断和治疗、医保报销等决策领域[6-7]。
1.3 rHTA
rHTA又叫快速评估或快速证据评价,是根据用户需求,针对某一具体问题,简化系统评价方法,获取当前最佳证据并快速合成证据以满足决策者需求的方法。rHTA方法学可以在切实可靠证据的基础上加速整个评估过程,整个rHTA的评估过程大约需要12~24 周,这使得及时、科学的政策决策成为可能[8]。由于rHTA 及时性强且成本相对较低,越来越多的国家或地区采用了rHTA以优化其定价和调整医保报销目录的决策,如加拿大、泰国、爱尔兰等[9-10]。
简言之,HTA是证据生产的过程,MCDA是证据应用的过程,而rHTA是HTA的一个分支,能够快速收集与整合证据,可以更有效、及时地满足不同利益相关方的各种需求,并广泛应用于社会科学研究和实践中。rHTA无疑更具时效性,但也存在固有的局限性,如文献检索受限、关注范围狭窄、泛化能力有限、缺乏经济建模和预算影响分析等。因此,在决策中使用rHTA需要作更多考量。与HTA相比,rHTA的代价是在方法学上作出的权衡。
2 抗肿瘤用药rHTA方法学构想
2.1 基于HTA-MCDA评估经验的EVIDEM框架
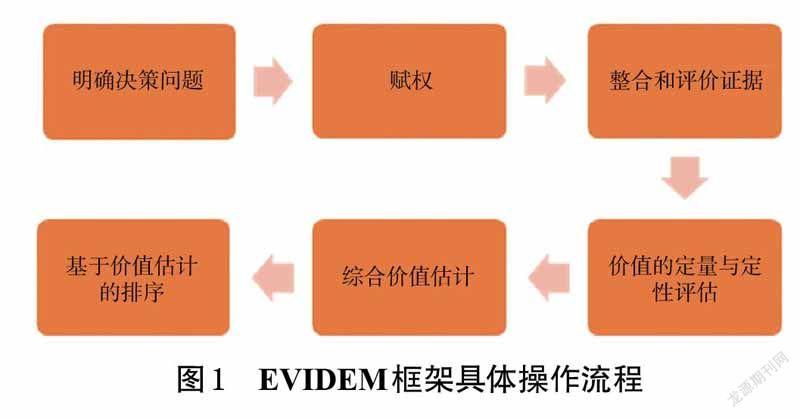
由Goetghebeur等[9]组成的EVIDEM协作组将MCDA模型与HTA结合,建立了EVIDEM框架,并用于卫生决策过程。经过10 多年的更新完善,目前研究者经常采用的为2018 年发布的第10 版EVIDEM 框架[11],其准则分为规范化的通用准则和情景化准则2 个层面。该框架通过定性定量相结合的方式对卫生技术进行价格评估[12]。
EVIDEM 框架的具体操作步骤包括选择和构建准则、赋权、整合和评价证据、价值的定量与定性评估、综合价值估计及基于价值估计的排序。选择和构建准则是根据决策目的,调整或删除部分维度和/或指标确定评审体系的过程。赋权是利益相关者权衡各个维度、指标重要性,賦予相关权重的过程——EVIDEM框架有2 种赋权方法,分别为5 分非层级结构法和100 分层级结构法。整合和评价证据是根据矩阵手册,对证据进行整合、分析、评价。卫生技术价值的定量与定性评估是根据评审体系及掌握证据进行打分。卫生技术的综合价值估计是根据打分及权重测算干预措施的定量分值。基于价值估计的卫生技术排序是根据综合价值评估结果对所有干预方案进行排序,供决策者选择。EVIDEM 框架适用于疾病的诊断、治疗、管理等领域,应用范围包括医疗保险报销、药物遴选、政策制定、监管决策等,可为更加系统、透明、科学的卫生决策提
2.2 抗肿瘤用药rHTA方法学构想
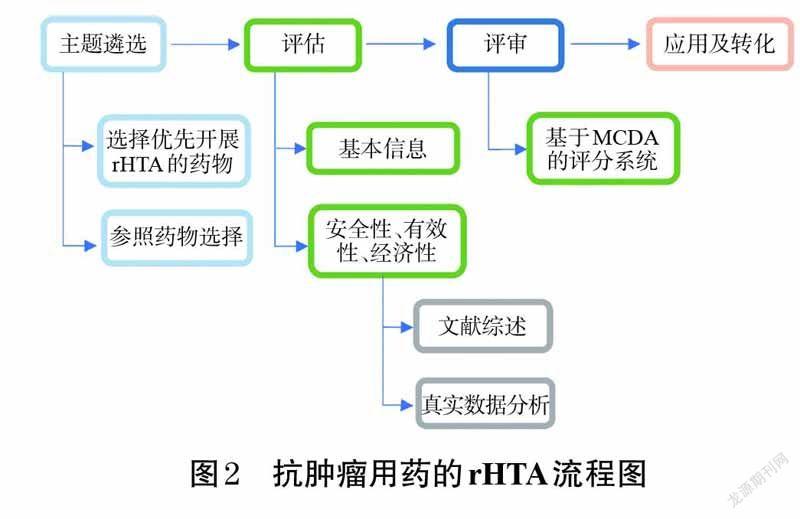
本研究基于以上HTA-MCDA评估经验及相关文献研究[16-17],结合当前中国特色医疗卫生体系,建立适合本研究需求的抗肿瘤用药rHTA方法学操作流程。抗肿瘤用药rHTA方法学包括4 个关键步骤:主题遴选、评估、评审、应用及转化(如图2所示)。
2.2.1 主题遴选
(1)选择优先开展rHTA的抗肿瘤用药——选择高优先级药物的过程即确定哪些药物适合进行rHTA的过程。用于评估的目标药物主要由医疗卫生领域的专业人员和国家或地区决策者来确定,也可通过文献检索和国家HTA 机构的横向扫描(horizon scanning)来确定[18]。《基本医疗保险药物用药管理暂行办法》确定的基本医疗保险用药筛选标准旨在衡量国家医疗保险基金的安全性、临床价值、临床可替代性、资金占用额度和可持续发展能力[5]。
(2)参照药物选择——参照药物是用于治疗相同病症的替代药物。HTA通常会对正在接受评估的拟谈判药物与其相应参照药物进行比较。在选择参照药物时,通常会优先考虑相同适应证的其他药物。参照药物遴选应有其他证据来源作为支撑,如参考目前当地的通用模式和循证医学及临床实践指南[19]。
2.2.2 评估
评估内容主要包括药物基本信息、安全性、有效性、直接医疗费用、增量成本-效果比、预算影响分析及在其他国家报销情况等信息。综合这些来自真实世界和文献的证据,为评审和形成建议提供了重要的参考依据。
(1)安全性——安全性信息侧重收集3 级及以上的药物不良反应/事件和黑框警告、其他警告和退市情况。不良反应/事件分类主要参考常见不良事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)。药物在获批上市时会在说明书中标明不良反应、禁忌证和注意事项等安全警告信息。美国FDA也会对该药物的一些重要风险进行警告,即黑框警告。对于上市后发现有严重安全问题的药物,如果风险大于治疗效益,而风险管理措施不能有效降低风险,可能会出现退市的情况。
(2)有效性——有效性信息侧重收集主要临床结局指标改善情况及临床实践指南推荐情况。主要临床结局指标改善情况主要从国内外公开发表文章、关键临床试验以及真实世界数据库中提取。对该药物国内外临床实践指南进行回顾,对方案及指南推荐情况进行评估。
(3)经济性——经济性信息主要包括直接医疗费用、增量成本-效果比、预算影响分析结果。根据患者基本诊疗信息计算患者临床用药方案的直接医疗费用,包括药物费用、检查检测费用、医疗服务费用等;构建增量成本-效果比指标,评估目标临床用药方案的成本-效果;汇总试点统筹地区临床用药方案的报销金额和药物数量,衡量其对医保基金的影响。
(4)证据质量——证据等级可根据纽约州立大学医学中心2001 年提出的证据金字塔[20]对入选研究进行排序。在循证医学的证据金字塔中系统评估和元分析(即Meta分析)等级最高,随后是随机对照双盲研究,见图3。
2.2.3 评审
评审是多个学科、多个利益相关方的融合,进行评审时可先确定统一的评审维度及指标。然后专家根据自己的专业判断和来自审查报告的证据,对评审维度和指标进行赋权赋分。通过对指标评审结果的均值和异常值进行判定,运用统计分析方法汇总整理专家意见。
根据每一指标的权重及指标得分汇总计算该药物的加权分值。最终,每个药物得到唯一对应的分值。
2.2.4 应用及转化
评审结束后,形成评审报告,递交至评审委员会,由评审委员会对评审结果进行审查,形成最终评审意见。未来借助相关决策部门力量,促进结果的转化应用。
3 抗肿瘤用药rHTA方法学的实践与探索
3.1 主题遴选
考虑到不同癌种的流行病学和经济负担有所区别,本研究选择肺癌进行实践研究。肺癌化疗药物目前在临床的使用较为成熟、规范,因此拟评估药物种类聚焦在肺癌靶向药物。本研究对2 个试点机构——A医院和B中心肺癌晚期患者使用的靶向药进行分析,结果发现C药品的使用量排第1 位,而单价和费用则低于D药品、居于第2 位。基于以上维度考量并结合临床专家咨询意见,遴选出在真实世界中实际用量大、总费用金额高的C药品作为本次rHTA的目标药物,D药品为对照药物。
3.2 评估
3.2.1 安全性
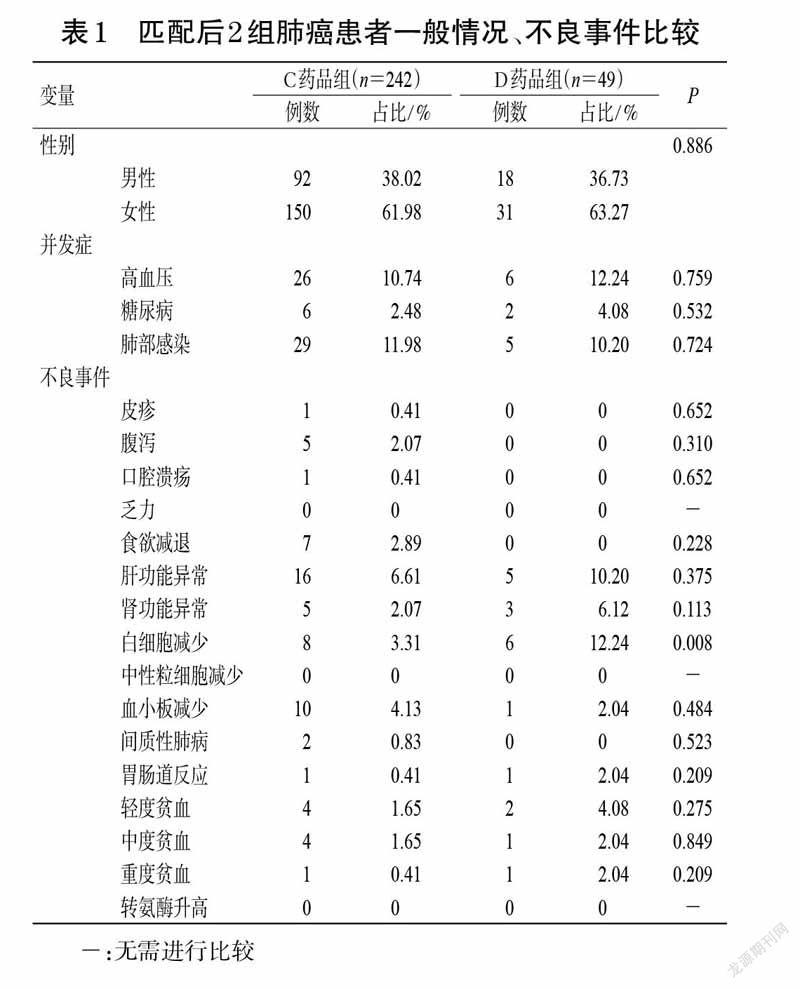
C药品临床试验中观测到的3 级及以上的不良事件主要为腹泻与间质性肺病。仅有少量的患者会出现CTCAE中的3 级及以上不良事件。在A医院和B中心的真实世界数据中,通过对患者诊疗记录进行清洗,使用Stata 15.0 软件进行统计分析,采用倾向性评分匹配(propensity score matching,PSM)控制C 药品组患者和D药品组患者组间数据偏差和混杂变量。以50 例使用D药品的肺癌患者为基准组,选择年龄、性别、高血压、糖尿病和肺部感染共5 个因素作为匹配的协变量,卡钳值设置为0.05,采用1 ∶10 临近匹配法成功筛选出242 例使用C药品的肺癌患者作为试验组。匹配后共纳入291例肺癌患者資料。显著性差异分析显示,经匹配后2 组患者的年龄、性别、高血压、糖尿病和肺部感染差异均无统计学意义(P>0.05)。匹配后,D药品组患者发生白细胞减少的概率仍然高于C 药品组(12.24% vs. 3.31%),差异具有统计学意义(P=0.008);其他不良事件的发生率在2 组之间没有统计学差异。匹配后患者一般情况、不良事件发生情况详见表1[匹配后C、D药品组患者年龄分别为(59±14)、(56±13)岁,P=0.091]。查询各国说明书及相关网站,结果并未在该药的说明书上发现相关的黑框警告及退市信息。
3.2.2 有效性
与C 药品主要临床结局指标相关的文献共有5篇[21-25],其中3 篇为关键临床试验,2 篇为近5 年内的系统评价。2 篇系统评价具有较高的证据质量等级,3 篇临床试验均为多中心临床随机对照试验,证据等级为中等。结果表明,无论是一线还是二线使用C药品,对特定群体的无进展生存期和生活质量均有积极的影响,特别是针对带有EGFR基因突变的肿瘤患者。检索国内外肿瘤学会发布的最新版本指南,阅读指南后对国内外权威指南中关于C药品治疗非小细胞肺癌(non-small-celllung cancer,NSCLC)的情况进行梳理。综合评估美国国立综合癌症网络(National Comprehensive CancerNetwork,NCCN)、欧洲临床肿瘤学学会(EuropeanSociety for Medical Oncology,ESMO)、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南中对EGFR基因突变的NSCLC一线治疗用药推荐情况。
在A医院和B中心真实世界数据中,D药品组患者生存率高于C 药品组。C 药品组患者的1 年生存率为61.29% [95% 置信区间(confidence interval,CI):53.2%~68.41%],D药品组患者的1 年生存率为75.77%(95%CI:59.36%~86.28%);C 药品组患者的2 年生存率为33.42%(95%CI:22.3%~44.91%),D药品组患者的2 年生存率为54.12%(95%CI:24.99%~76.20%)。但是2 组的生存曲线出现交叉,表明2 组生存时间的影响因素不全是用药方案的不同所致,存在混杂因素。C药品组患者中位生存时间为16.14 个月(95%CI:13.15~20.05 个月),D药品组患者由于随访时间过短,尚未观测到中位生存时间,其第四分位数间距的生存时间为17.39 个月。Log-rank 检验结果显示,2 组患者的生存时间差异无统计学意义(χ2=2.99,P=0.084)。
3.2.3 经济性
在A医院和B中心真实世界数据中,D药品组的人均总费用高于C 药品组(58 957.21 元vs. 22 726.93 元,P<0.001);D 药品组的人均药品费(25 448.19 元vs.13 646.19 元,P<0.001)、人均检查检验费(7 292.00 元vs. 3 748.09 元,P=0.025 )、人均诊疗耗材费(4 451.32元vs. 2 003.19 元,P=0.005 )、人均其他费用(3 230.28元vs. 1 135.50 元,P=0.011 )也高于C 药品组,差异具有统计学意义。
在文献研究中,检索到此次评审药物C药品与参照药品D药品的经济学评价文献共2 篇[26-27],研究结果表明C药品是具有成本-效果优势的方案。暂未检索到预算影响分析方面研究。
3.3 评审专家根据此次评审药品C药品及其适应证NSCLC现阶段诊疗情况,进行了维度的赋权。对5 位专家赋权的结果进行加权平均,得到C药品各个价值维度及指标下的唯一权重值,最终计算得到C药品各维度下的平均权重。通过对指标评分结果均值及异常值的分析处理,以各指标评分的算术平均数乘以相应的指标权重和维度权重,得出指标加权分值(具体结果略)。
3.4 应用及转化
最后,将上述rHTA结果以及价值量化的结果撰写成一份报告,提交给评审委员会。由该委员会专家对结果进行审查,并结合其他证据和其他相关利益方的权益进行最终价值判断(具体结果略),供决策者参考。
4 讨论
基于HTA与MCDA结合为出发点的rHTA,需要以问题为导向,服务循证决策,原则是本土化、可操作、易实施。结合本次抗肿瘤用药rHTA 实践,为促进未来rHTA方法学优化与实施,笔者总结了4 点经验与建议。
4.1 评审维度的确定需与HTA内容相结合
HTA是一个证据生产的过程,综合考量了评估对象的安全性、有效性、经济性等,从多视角实现了对相关证据的全面收集和分析。因此以HTA结果为基础的维度确定,既可以发挥现有证据对决策的直接支撑,又保持了评估和评审环节的一致性,同时通过评审可以对评估内容进行反向验证。这样一致性的保持,既得到了文献验证,例如文献综述和专家咨询结果显示安全性、有效性和经济性是价值判断的通用维度,又凸显了评审工作的科学性、严谨性、紧密型和可操作性。
4.2 多方参与以确保决策公开、公正、公平
决策是一个复杂的过程,不同利益相关者出于不同的利益考量,会对同类型的研究证据进行不同的权衡和取舍。而本模拟所借鉴的MCDA,目的就是在具有相互冲突、不可共度的利益相关者之间进行选择,目的是做出利益共融且具有“帕累托(Pareto)最优”特点的决策。评审全流程要做到公开、公正、公平,且多方参与。利益相关者尤其不能忽略非传统意义评审代表——患者代表及企業代表的利益。
4.3 强调评审流程的可操作性
MCDA既是方法学的探索,同时更需要通过应用实践保持对价值维度和指标结构的持续优化,这就需要在维度全面性和实操性之间进行平衡。在应用之初,可以按照由易到难的原则,二级指标的设定不宜过多过细,指标过多会稀释主要指标的作用,而且会降低评审专家对评审参与的依从性和投入热情。维度结构和内容的设定秉承简化、直接、准确的原则,但是在评分计算方面应更着重于体现科学性和严谨性。
4.4 信息化对评审流程的支撑
评审流程的信息化操作可以大大提高评审效率。在模拟实践中,借助相关电子设备终端(例如手机)和统计软件的应用(例如问卷星),可以实现评审信息的快速收集、统计和调整。从当前国际评审流程发展趋势来看,随着电子设备的普遍应用,评审流程将借助信息化优势实现便捷化、可溯化和安全化。
5 结语
随着循证医学方法的发展,rHTA作为一种证据合成的新兴方法,能够在短时间内整合现有的真实世界数据与相关文献资料,快速评估药物的安全性、有效性、经济性和其他关键信息,为决策者提供证据支持。目前主要应用于指导新药研发、药品审评审批、药品参考定价、医保目录调整、基本药物遴选、临床合理用药等领域。但是目前国际上尚无公认的rHTA方法和流程,多数国家和地区多基于自身决策需求因地制宜开发相应的快速评估指南。因此本研究基于我国医疗卫生服务体系独有特点,开发了rHTA方法学和操作流程,并通过2 个试点机构的数据,以C药品为例对rHTA方法学的科学性、可行性进行了全流程验证。但由于rHTA强调时效性,证据收集和评审方面可能存在偏倚,因此在结论推广的同时,应积极进行后效评价,保持对评估结果的持续优化或者必要时开展完整的评估,用更多且全面的证据来验证和完善rHTA的方法和应用。

