肺癌免疫治疗相关肝毒性的影响因素分析
金萌 杨光杰 王振光
(青岛大学医学部基础医学院,山东 青岛 266100)
近年来,基于程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡蛋白配体1(PD-L1)的免疫检查点抑制剂(ICIs)被广泛用于肺癌患者的治疗,其不仅成为改善晚期肺癌患者预后的重要治疗方式之一,还被应用于早期肺癌的临床干预中[1-5]。随着ICIs在肺癌等恶性肿瘤患者治疗中的逐步应用,其所诱发的不良事件也逐渐引起重视。肝脏在免疫治疗中常常发生损伤,一般表现为免疫相关性肝炎或胆管损伤,该类损伤被称为免疫相关肝毒性(IMH)。IMH一般可被有效控制,但严重时也可导致患者死亡。一项回顾性分析发现,接受免疫治疗的肿瘤患者中有2%出现致命性免疫相关不良事件,其中0.4%为重度IMH患者[6]。因此,早期识别IMH,尤其是重度IMH,对患者十分重要。目前,IMH发生的危险因素尚不明确,相关研究较少[7],本研究旨在探讨肺癌患者PD-1/PD-L1免疫治疗诱发IMH的相关影响因素,指导临床医生对PD-1/PD-L1抑制剂治疗后的IMH进行早期预防。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月1日—2020年12月31日于我院接受PD-1/PD-L1抑制剂治疗的123例肺癌患者的临床资料,一般指标包括性别、年龄、体质量指数(BMI)、是否为脂肪肝、是否为乙型肝炎、PD-1/PD-L1抑制剂治疗线数(一线、二线及以上)、免疫治疗药物种类(PD-1抑制剂、PD-L1抑制剂)、免疫治疗方案(PD-1/PD-L1抑制剂单药、PD-1/PD-L1抑制剂联合其他药物)、肿瘤淋巴结转移情况、肿瘤远处转移(肝、肺、脑、骨转移)情况、肿瘤组织学类型(鳞癌、腺癌、小细胞癌)及晚期肺癌炎症指数(ALI)。实验室生化指标包括免疫治疗开始前1周的嗜酸性粒细胞计数(EOS)、嗜酸性粒细胞百分比(EO%)、淋巴细胞计数(LCC)、中性粒细胞计数与淋巴细胞计数比值(NLR)、血小板计数与淋巴细胞计数比值(PLR)、乳酸脱氢酶(LDH)水平、营养预后指数(PNI)以及免疫治疗前后EO%变化率(△EO%)。患者纳入标准:①病理证实为肺癌者;②采用PD-1/PD-L1抑制剂治疗者;③临床及随访资料完整者。排除标准:①未进行病理检查或病理检查证实非肺癌者;②既往有其他恶性肿瘤病史者。根据患者是否发生IMH将患者分为IMH组(45例)和非IMH组(78例)。另根据2019年美国临床肿瘤学会联合美国国家综合癌症网络发表的《免疫检查点抑制剂治疗相关毒性的管理指南》[8]将IMH患者分为G1~G4级,其中G1~G2级及非IMH患者设为非重度IMH组(112例),G3~G4级患者设为重度IMH组(11例)。
1.2 统计分析
采用SPSS 20.0软件进行统计学分析。计量资料使用受试者工作特征曲线(ROC)选择其最佳截断值,将其转化为二分类资料。计数资料和转换为二分类资料的计量资料均采用例(χ/%)表示,组间比较采用卡方检验。将单因素分析有差异的临床资料采用Enter法进行多因素的Logistic回归分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 IMH组与非IMH组患者临床资料比较
IMH组患者性别及免疫治疗前血清中EOS、EO%、PLR、LDH水平与非IMH组比较差异有显著性(χ2=4.034~13.493,P<0.05)。见表1。

表1 IMH组与非IMH组患者临床资料比较[例(χ/%)]

续表1
2.2 影响肺癌患者IMH多因素Logistic回归分析
Logistic分析显示,性别是影响肺癌患者IMH发生的独立的危险因素(OR=4.770,95%CI=1.808~12.585,P<0.05)。见表2。计算得到其ROC曲线下面积(AUC)为0.642,灵敏度为0.400,特异度为0.885。
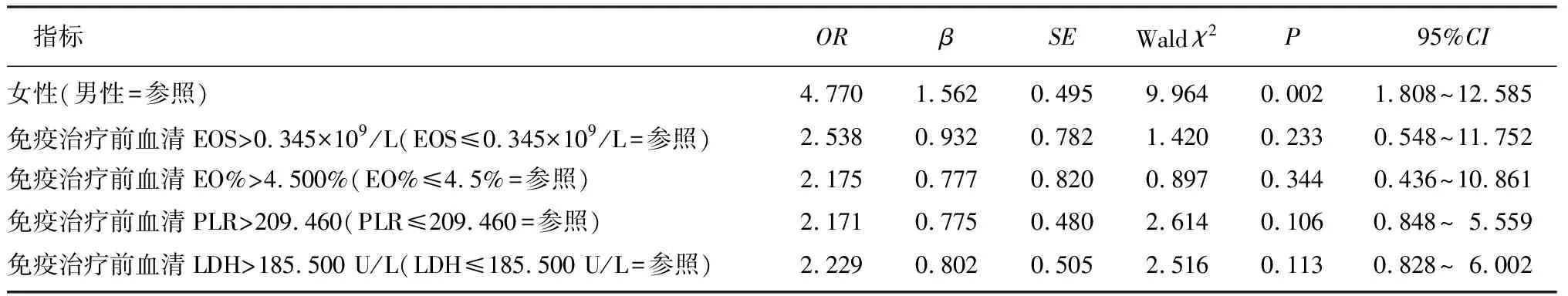
表2 影响IMH的多因素Logistic回归分析
2.3 重度IMH组与非重度IMH组患者临床资料比较
重度IMH组患者的△EO%及免疫治疗前血清EOS、PNI与非重度IMH组相比较差异均有统计学意义(χ2=4.327~7.094,P<0.05)。见表3。

表3 重度IMH组与非重度IMH组患者临床资料比较[例(χ/%)]

续表3
2.4 重度IMH影响因素的ROC曲线分析
绘制ROC曲线对重度IMH的影响因素进行分析,以△EO%判断重度IMH的AUC为0.642,95%CI=0.493~0.821,灵敏度为0.727,特异度为0.587;以免疫治疗前血清EOS判断重度IMH的AUC为0.585,95%CI=0.391~0.780,灵敏度为0.273,特异度为0.947;以免疫治疗前的PNI判断重度IMH的AUC为0.580,95%CI=0.436~0.723,灵敏度为0.909,特异度为0.411。结果详见图1。△EO%联合免疫治疗前血清EOS判定重度IMH的AUC为0.767,灵敏度为0.909,特异度为0.545。
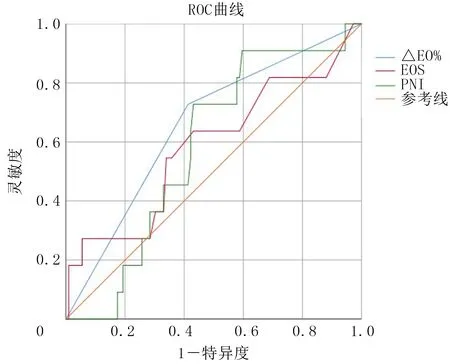
图1 重度IMH影响因素的ROC曲线
3 讨 论
PD-1/PD-L1抑制剂治疗改变了肺癌患者抗肿瘤治疗的前景,是肺癌有效的治疗方法之一。PD-1/PD-L1抑制剂通过激活T细胞,可增强其识别和杀伤肿瘤细胞的能力[9],然而这一过程往往伴随着机体自身组织损伤。IMH是PD-1/PD-L1抑制剂常见的治疗相关不良反应之一[10]。IMH的发生可能会影响PD-1/PD-L1抑制剂的治疗策略,发生重度IMH的患者被禁止再次使用PD-1/PD-L1抑制剂。因此在临床工作中需早期识别发生IMH的高危患者,以预防IMH发生。
多项研究表明,血清EOS、EO%可作为免疫相关不良反应的有用预测指标。DIEHL等[11]的研究表明,在使用免疫治疗的实体肿瘤患者中,免疫相关不良反应与免疫治疗前较高的血清EOS间存在关联,但其并未报告血清EOS与各具体类型免疫相关不良反应间的相关性。NAKAMURA等[12]的研究表明,在接受PD-1抑制剂治疗的黑色素瘤患者中,免疫治疗前较高的血清EOS和EO%与内分泌免疫相关免疫不良反应的发生有关。另有研究显示,在帕博利珠单抗作为一线治疗的晚期非小细胞肺癌患者中,免疫治疗前较高的血清PLR与免疫相关不良反应的风险增加显著相关[13]。本研究在上述研究结果的基础上探究了免疫治疗前各项生化指标与IMH关系,结果示免疫治疗前血清EOS、EO%、PLR较高与肺癌患者IMH发生相关。
CORTELLINI等[14]报道,在接受抗PD-1单药治疗的晚期癌症患者中女性免疫相关不良反应发生率均显著高于男性。本研究对IMH组和非IMH组患者的多因素Logistic回归分析显示,性别是影响IMH发生的独立危险因素,该结论从一定程度上对上述报道进行了印证。本研究结果还显示,△EO%、免疫治疗前血清EOS和PNI是重度IMH发生的相关影响因素。既往研究表明,免疫治疗前血清EOS偏高和免疫治疗1月后EO%升高均与IMH发病风险的增加相关[12]。此外,一项对晚期非小细胞肺癌患者进行的回顾性分析显示,免疫治疗前PNI较高与免疫相关不良反应的发生相关[15]。
有报道指出,相比于PD-1/PD-L1抑制剂单药治疗,PD-1/PD-L1抑制剂与其他ICIs联合使用时,可促使各类免疫相关不良反应(尤其是重度不良反应)发生[16],而PD-1/PD-L1抑制剂联合化疗则较少导致免疫相关不良反应发生[17]。本研究中,使用PD-1/PD-L1抑制剂单药治疗的患者与使用PD-1/PD-L1抑制剂联合化疗或血管生成抑制剂治疗的患者间发生IMH的情况无显著差异,与上述结论相符。有报道显示,乙型病毒性肝炎患者经PD-1/PD-L1抑制剂治疗后发生IMH情况无异于未感染乙型病毒性肝炎患者[18-19],本研究同样证明了乙型病毒性肝炎对使用PD-1/PD-L1抑制剂的肺癌患者IMH及重度IMH的发生无显著影响。此外,非小细胞肺癌患者在免疫治疗前若存在肺癌肝转移,会使IMH的发生率增高[20-21]。本研究中IMH发生率在肝转移与非肝转移患者间差异无统计学意义,可能与本研究样本数量较少有关。
总之,本研究阐明了肺癌患者接受PD-1/PD-L1抑制剂治疗后发生IMH和重度IMH的影响因素,可以帮助临床筛选IMH发生的高危人群,完善肺癌患者免疫治疗的个性化决策,并对高危人群的IMH发生进行合理预防。

