新型生物佐剂BC01 对机体免疫激活作用的初步分析
李军丽 ,付丽丽 ,杨阳 ,王国治 ,赵爱华
1.中国食品药品检定研究院结核病疫苗和过敏原产品室,北京 102629;2.国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629;3.国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室,北京 102629
20 世纪 80年代,科学家 SHIMADA 等[1]首次从牛型结核分枝杆菌中提取出具有抗肿瘤活性的DNA 片段MY-1,并合成了许多具有类似活性的不同序列寡脱氧核苷酸(oligodeoxynucleotide,ODN)。随着进一步的深入研究发现,病毒、细菌及无脊椎动物的DNA 中也广泛存在含有1个或多个回文序列的CpG 二核苷酸片段,且CpG 序列是否未甲基化或低甲基化是决定CpG-DNA 免疫活性的关键,这打破了以往认为DNA 免疫原性较弱,难以引起机体较强免疫反应的偏见。
CpG-ODN(CpG oligodeoxynucleotide)是人工合成的含有未甲基化胞嘧啶鸟嘌呤二核苷酸的寡脱氧核苷酸,长度为20 ~30个碱基对,能够模拟细菌CpG-DNA 的免疫刺激活性,作为一种病原相关分子模式(pathogen-associated molecular pattern,PAMP)与许多哺乳动物包括人体免疫细胞中的模式识别受体(pattern recognition receptors,PRRs),如 Toll 样受体 9(Toll-like receptor,TLR9)结合,直接激活 B 细胞和单核巨噬细胞,间接激活NK 细胞和T 细胞等多种免疫效应细胞,刺激细胞因子分泌,增强抗原的加工、提呈,诱导Th1 型免疫应答,产生较强的体液免疫和细胞免疫,从而增强机体固有和适应性免疫应答[2-6]。但CpG-ODN 易被核酸外切酶酶解,且生产过程中对核苷酸进行硫代硫酸酯修饰增加了合成成本。同时,单一的碱基序列导致CpG-ODN 存在明显种属特异性,这些均成为CpG-ODN 被广泛用作疫苗免疫佐剂的瓶颈。新型生物佐剂BC01(BCG CpG DNA compound combination adjuvant system 01)是一种源自卡介苗(Bacillus Calmette-Guérin,BCG)基因组,含 15.75% ~ 24.75%未甲基化 CpG 基序、3 000 ~10 000个碱基对的DNA 片段,其具有结构天然、稳定性强且无明显物种特异性等优点。我们前期研究发现,BC01 佐剂具有广谱佐剂特性,动物实验证明其对病毒抗原、细菌抗原、寄生虫抗原等均具有较好的免疫增强作用[7-10],与 COVID-19 DNA 疫苗配伍后也同样发现其具有很强的佐剂效应[11]。细胞实验也证明,BC01 佐剂通过TLR9 受体的介导激活固有免疫应答中核转录因子-κB(nuclear factorκB,NF-κB)和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,诱导巨噬细胞TNF-α 和MCP-1 产生及增强细胞表面分子MHC-Ⅱ、CD40、CD80 和 CD86 的表达[12]。此外,BC01 佐剂与A(lOH)3佐剂或Poly I:C 佐剂等配伍成复合佐剂,其成分也具有协同增强机体免疫应答的作用[13-15]。
尽管新型生物佐剂BC01 具有众多优势,但其在动物体内的作用机制研究较少。因此,本研究在前期体外细胞实验的基础上,进一步探讨BC01 佐剂经肌肉注射免疫后不同时间内对机体免疫的激活作用,通过对其在体内作用相关分子机制的深入研究以加快推进该佐剂的临床转化。
1 材料与方法
1.1 实验动物 SPF 级 C57BL / 6 小鼠,雌性,6 ~ 8周龄,体重18 ~20 g,购自中国食品药品检定研究院实验动物资源研究所,动物许可证号:SCXK(京)2017-0013。本研究中涉及的所有动物操作均遵循实验动物福利伦理审查指南,并得到本院伦理委员会批准。
1.2 主要试剂及仪器 BC01 生物佐剂由中国食品药品检定研究院结核病疫苗和过敏原产品室保存;RNA later 购自美国 Thermo Scientific 公司;Trans-Script One-Step gDNA Removal、cDNA Synthesis Super-Mix 试剂盒和 TransTap High Fidelity(Hifi)PCR SuperMixⅠ试剂盒购自北京TransGen Biotech 公司;Mouse Transcriptome Assay 2.0 基因芯片购自美国Affymetrix 公司。
1.3 动物分组及免疫 将C57BL / 6 小鼠随机分为4 组,每组6 只,各组小鼠分别肌肉注射75 μg BC01佐剂。免疫组分别于免疫后6 、12 和24 h 安乐死小鼠,对照组于BC01 佐剂注射后0 h 安乐死小鼠。解剖取各组小鼠脾脏,分为4 份,于-20 ℃预冷的RNA later 溶液中保存。
1.4 总RNA 提取及cDNA 合成 将小鼠脾脏经PBS洗涤2 次,充分剪碎,用1 mL Trizol 裂解研磨液研磨,将裂解物与200 μL 氯仿充分混匀,室温静置3 min;4 ℃,12 000 × g 离心 10 min,分离水相与有机相;吸取水相至新离心管中,按1 ∶1 比例将异丙醇加至水相中,颠倒混匀后-20 ℃放置2 h;4 ℃,12 000 × g 离心 10 min;收集总 RNA 沉淀,加入 1 mL 75%乙醇洗涤 2 次,4 ℃,7 500 × g 离心 5 min;弃上清,RNA 沉淀室温干燥 5 ~ 10 min 后,溶于无 RNase水。采用 Nanodrop 分别计算 A260/280和 A260/230值,并分析纯化后总RNA 数量和质量。cDNA 合成按反转录试剂盒说明书进行。
1.5 基因芯片操作及数据分析 生物素标记片段化的 cDNA 后,用 GeneChip®Hybriding Oven 645 将标记的cDNA 与基因芯片45 ℃杂交16 h;杂交结束后,芯片经GeneChip®Fluidics Station 450 进行Streptavidin-phycoerythrin 洗染,用 GeneChip®Scanner 3000 7G 和 Affymetrix Command Console 软件扫描获取图像。基因芯片数据经Robust Multi-Array Average(RMA)算法归一化后,用Partek®GenomicsSuite®对每组4个独立样本的基因表达数据进行统计分析。显著差异表达基因(significantly differentially expressed gene,SDEG)进行基因本体分析(gene ontology,GO)或全基因转录组芯片数据进行基因集富集分析(gene set enrichment analysis,GSEA)。
1.6 qPCR 检测 无RNase 水调平反转录合成的cDNA模板浓度,按 20 μL 反应体系中 10 μL ChamQ SYBR qPCR Master Mix、6.5 μL 去离子水、3 μL 10 倍稀释的cDNA 模板和0.5 μL 引物进行目的基因的扩增,以β-actin 为内参基因,试验重复3 次。反应条件:95 ℃预变性 4 min;94 ℃变性 30 s,60 ℃退火30 s,72 ℃延伸 45 s,循环 35 次;72 ℃后延伸 10 min。引物采用Premier 5.0 软件设计并由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 不同生物过程相关上调基因qPCR 引物Tab.1 Primers for amplification of up-regulated genes related to different biological processes by qPCR
1.7 统计学分析 采用SPSS 16.0 软件进行统计学分析,结果以均数 ± 标准差()表示。不同实验处理组之间差异比较采用单因素方差分析,以P <0.05为差异有统计学意义。柱形图采用美国GraphPad Software 公司GraphPad Prism 8 软件制作。
2 结 果
2.1 小鼠全基因组转录谱整体分析 主成分分析(principal component analysis,PCA)显示,PC1、PC2和PC3 在X、Y 和Z 轴方差的可重复性分别为25.5%、22.2%和15.3%。BC01 佐剂免疫后,不同时间点小鼠组间数据集聚类彼此不同,组内生物学重复样本数据集聚类紧密,见图1A。进一步比较不同时间点免疫后小鼠转录谱总体变化,在调整原始背景信号参数后,通过One-way ANOVA 分析各微阵列中24 362个探针的表达值并制作火山图,见图1B ~D。以上下调倍数 ≥ 2 或P <0.05 为阈值,分别鉴定出80、386 和 1 544个 SDEG,其中相较于对照组,6、12 和24 h 免疫组中各有约 0.185%(45 /24 362)、1.481%(361 / 24 362)和 4.73%(1 153 / 24 362)的基因表达被上调,而约有0.144%(35/24 362)、0.103%(25 /24 362)和 1.60%(391 / 24 362)的基因表达被下调。GSEA 中GO 基因集分组归类分析显示,其中生物过程(biological process,BP)汇集 GO 条目数分别为 275、55 和 41,细胞成分(cellular component,CC)汇集GO 条目数分别为131、27 和25,分子功能(molecular function,MF)汇集 GO 条目数分别为 310、68和67。见表2。

图1 BC01 佐剂免疫后不同时间点小鼠全基因组转录谱整体分析Fig.1 Global transcriptome analysis of mice at various time points after immunization with BC01 adjuvant
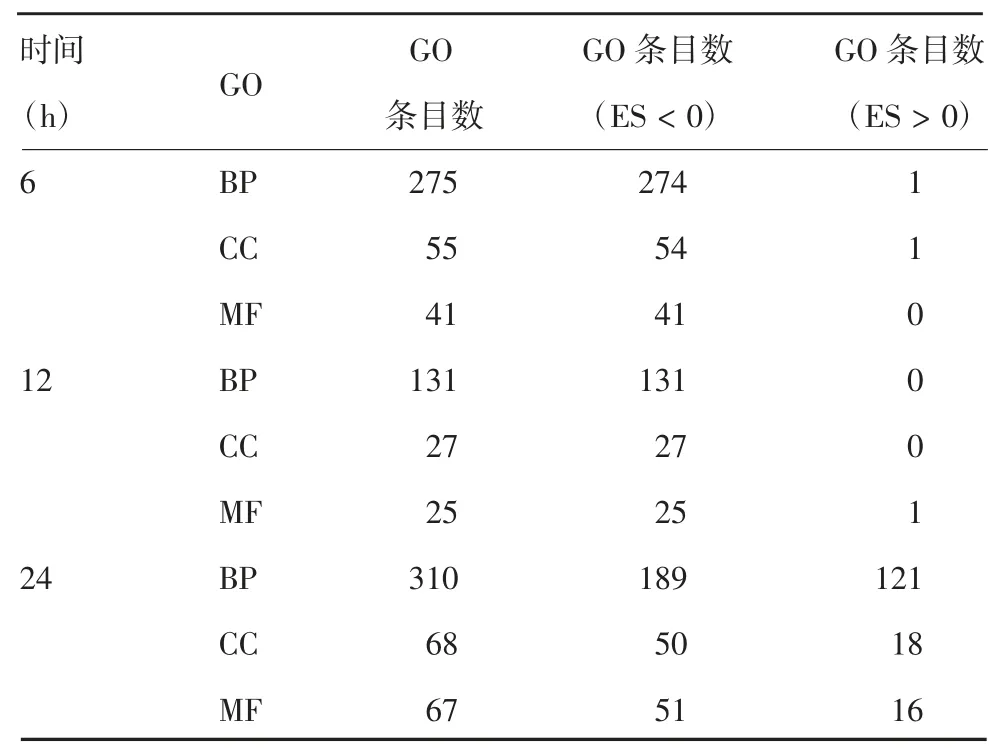
表2 GSEA 中GO 基因集分组归类基因富集结果Tab.2 Grouping and classification results of GO gene sets in GSEA
2.2 BC01 佐剂对免疫细胞活化的增强作用 BC01佐剂免疫小鼠后24 h,GSEA 分析发现,与对照组相比,细胞活化、细胞活化调控、细胞活化正调控、淋巴细胞活化及白细胞活化等生物学过程相关基因显著富集。ES 分别为 0.33、0.38、0.36、0.33 和 0.34,校正后的富集分数(normalized enrichment score,NES)分别为 1.65、1.88、1.69、1.56 和 1.65,且名义 P 值(nominal P value,NOM P-value)和错误发现率(false discovery rate,FDR q-value)均 < 0.05。基因集所富集基因数分别为 440、344、214、272 和 324,且与对照组相比,基因集前 20个基因中,Ccl19、Cd3d、Lat、Ly6d、Cd3g、Rab27a、Atg5、Klrk1、F2rl1、Rpl22、Amica1、Tnfrsf4、Anxa1、Fas、Cd2 和 Lepr 基因在淋巴细胞活化和白细胞活化生物过程中均被上调表达。见图 2A ~ E。qPCR 进一步验证发现,Cd3d、Atg5、Rpl22、Tnfrsf4 和Fas 与对照相比均变化显著,且变化比率差异有统计学意义(F 分别为9.155、10.191、11.475、17.018 和 12.193,P 均 < 0.05),见图 2F。

图2 BC01 佐剂细胞活化作用GSEA 分析结果Fig.2 GSEA of activation of cells by BC01 adjuvant
2.3 BC01 佐剂对固有免疫和适应性免疫应答的活化作用 BC01 佐剂免疫小鼠后24 h,GSEA 分析发现,与对照组相比,免疫反应正调控、固有免疫反应及适应性免疫反应等生物学过程相关基因显著富集。ES 值分别为 0.31、0.31 和 0.41,NES 值分别为 1.57、1.54 和 1.84,且 NOM P-value 和 FDR q-value均<0.05。基因集所富集基因数分别为407、340 和161,且与对照组相比,基因集前20个基因中,Klrk1基因在3个生物过程中均被上调表达;Igj、Rab27a和Klrk1 基因在固有免疫反应及适应性免疫反应中被上调表达。见图3A ~C。qPCR 进一步验证发现,Klrk1、Igj 和Rab27a 与对照相比均变化显著,且变化比率差异有统计学意义(F 分别为11.079、10.291 和12.083,P 均 < 0.05),见图 3D。

图3 BC01 佐剂活化免疫应答GSEA 分析结果Fig.3 GSEA of activation of immune response by BC01 adjuvant
2.4 BC01 佐剂对炎症相关反应的活化作用 与对照组相比,BC01 佐剂免疫小鼠后24 h,炎症反应及炎症反应正调控生物学过程相关基因被显著富集。ES 值分别为 0.36 和 0.47,NES 值分别为 1.76 和1.88,且 NOM P-value和 FDR q-value均 < 0.05。基因集所富集基因数分别为279 和186,且与对照组相比,基因集前 20个基因中,Ccr2、Mefv、Ccl5、Sema7a和Anxa1 基因在炎症反应和炎症反应正调控生物学过程中均被上调表达。见图4。

图4 BC01 佐剂活化炎症反应GSEA 分析结果Fig.4 GSEA of activation of inflammatory reaction by BC01 adjuvant
2.5 BC01 佐剂对免疫细胞迁移与趋化作用的激活情况 BC01 佐剂免疫小鼠后24 h,GSEA 分析发现,与对照组相比,白细胞迁移调控、白细胞趋化调控、中性粒细胞迁移调控及单核细胞趋化作用等生物学过程相关基因显著富集。ES 值分别为0.45、0.49、0.61 和 0.69,NES 值分别为 1.92、1.94、1.92 和 1.99,且 NOM P-value 和 FDR q-value 均 < 0.05。4个生物过程对应基因集所富集基因数分别为105、67、23和17,且与对照组相比,Ccl19 和Xcl1 基因均被上调表达 ;Ccl19、Grem1、Jam3、Ccr2、Ccl5、Klrk1、Pla2g7、F2rl1、Rarres2、Xcl1、Vegfc、Nbl1、Thbs4、C5ar1、Gas6和Ccr6 基因在白细胞迁移调控和白细胞趋化调控中均被上调表达,见图 5A 和 B;Ccl19、Jam3、Xcl1、Thbs4 和C5ar1 基因在白细胞迁移调控和中性粒细胞迁移调控中均被上调表达,见图5A 和C;而Ccl19、Ccl5 和Xcl1 基因在白细胞趋化调控和单核细胞趋化作用中均被上调表达,见图5B 和D。

图5 BC01 佐剂增强细胞迁移与趋化作用GSEA 结果Fig.5 GSEA of activation of cell migration and chemotaxis by BC01 adjuvant
2.6 BC01 佐剂对免疫细胞吞噬功能的增强作用BC01 佐剂免疫小鼠后24 h,GSEA 分析发现,与对照组相比,免疫细胞吞噬作用生物过程相关基因显著富集。ES 值为 0.37,NES 值为 1.64,且 NOM P-value和FDR q-value均<0.05,吞噬作用生物学过程基因集富集基因数为141,见图6A。qPCR 进一步验证基因集前 5个基因发现,Cd36、Brk1、Cd3g、Gsn和Cd247 与阴性对照相比均变化显著,且变化比率差异有统计学意义(F 分别为 13.032、9.273、7.791、12.091 和 15.066,P 均 < 0.05),见图 6B。
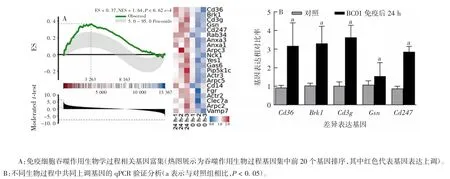
图6 BC01 佐剂增强免疫细胞吞噬功能GSEA 分析结果Fig.6 GSEA of activation of phagocytosis of immune cells by BC01 adjuvant
2.7 BC01 佐剂对 MAPK 和 ERK1/2 信号级联反应的激活作用 BC01 佐剂免疫小鼠后24 h,GSEA分析发现,与对照组相比,MAPK 信号级联反应调控、MAPK 信号级联反应正调控、ERK1 / 2 信号级联反应调控和G 蛋白偶联受体信号通路生物过程相关基因显著富集。ES 值分别为 0.33、0.34、0.36 和0.34,NES 值分别为 1.67、1.66、1.62 和 1.68,且NOM P-value和 FDR q-value均 < 0.05。4个生物过程基因集所富集基因数分别为468、328、157 和335,且与对照组相比,基因集前20个基因中,Ccl19、Cd36、Prkcdbp、Bmp4、Pla2g5、Ccl5、Klf4、Atf3、F2rl1、Ctgf 和Xcl1 基因在MAPK 信号级联反应调控和ERK1 / 2 信号级联反应调控过程中均被上调表达。见图7。

图7 BC01 佐剂增强MAPK 和ERK1 / 2 信号级联反应GSEA 分析结果Fig.7 GSEA of activation of MAPK and ERK1 / 2 signal cascade reaction by BC01 adjuvant
3 讨 论
疫苗佐剂是能够非特异性地改变或增强机体对抗原的特异性免疫应答、发挥辅助作用的一类物质。佐剂能够诱发机体产生长期、高效的特异性免疫反应,提高机体保护能力,同时又能减少免疫物质的用量,降低疫苗的生产成本。长期以来,由于传统灭活或减毒活疫苗具备较好的免疫原性,一般不需额外添加佐剂。因此,很长一段时间内免疫佐剂并未引起人们广泛的注意,其研究和使用也仅局限于较小的范围。随着现代生物医药技术的迅速发展,针对不同疾病已开展了各种新型核酸疫苗、基因工程疫苗、合成肽疫苗的研制,但这些疫苗普遍存在分子量小、免疫原性弱、难以诱导机体产生有效免疫应答等不足,从而需要某种物质来增强其免疫作用。因此,免疫佐剂尤其是新型免疫佐剂的研究就显得尤为迫切。
传统佐剂如铝盐佐剂作为抗原的储存库,缓慢释放抗原以延长诱导机体的免疫应答,但缺点是其仅诱导Th2 型免疫应答,抗体以IgG1 类型为主,细胞免疫反应较弱。弗氏佐剂和油乳佐剂虽然能明显提高机体免疫应答能力,但易出现注射部位肿胀、疼痛、发热或过敏等异常不良反应。为适应新型疫苗的需求,佐剂已从传统、单一的形式向新型、多元化形式发展,尤其用于黏膜疫苗、DNA 疫苗及肿瘤疫苗的佐剂研究成为了热点。CpG-ODN 作为一种新型佐剂以提高疫苗的免疫效果,其既可以单独使用也可与Al(OH)3佐剂或其他新型佐剂联合使用发挥协同作用,具有序列已知、用量低、副作用小等优点[13-15]。此外,其突破了传统佐剂主要是仓储、缓释的作用机理,具有很大的开发及应用前景。2017年底,Dynavax 公司CpG 佐剂乙肝疫苗HEPLISAV-B 成功获批上市,极有力地增强了以PRRs 天然配体或合成激动剂,特别是以CpG 作为疫苗免疫佐剂的信心。
本研究中,新型生物佐剂BC01 经肌肉注射给药途径免疫小鼠,分别于免疫后不同时间点解剖取小鼠脾脏并分离总RNA 进行全基因转录组分析。以上下调倍数 ≥2 或P <0.05 作为阈值时分别富集到6、12 和24 h 免疫组与对照组间的SDEG 数为80、386 和 1 544。SDEG 经 GO 分析和 KEGG(Kyoto Encyclopedia of Genes and Genomes)分析后发现,部分差异表达不显著却有重要生物学意义的基因被遗漏,一些基因调控网络之间的关系及基因功能等有价值的信息被忽略。因此,本研究采用不需要指定明确的差异基因阈值的GSEA 分析法。从GSEA 中GO 基因集分组归类情况来看,6 和12 h 免疫组中生物过程、细胞成分和分子功能基因集下富集到的GO 条目中ES >0 的数量较少,而免疫后24 h 其生物过程相关GO 条目被大量富集。进一步分析发现,该生物过程中细胞活化、固有免疫和适应性免疫应答调控、炎症反应调控及活化、免疫细胞迁移与趋化调节、细胞吞噬功能活化等相关基因被大量富集,表明BC01 佐剂免疫24 h 后,其对机体具有较强的免疫激活作用。
CpG 序列经内吞的形式进入细胞,并进一步与内体融合,最终与受体TLR9 结合。CpG 序列进入内体的酸性环境后,可引发细胞内的2 条信号转导途径的激活:一条为NF-κB 激活途径,另一条为MAPK途径[16]。NF-κB 激活途径中,TLR9 与配体 CpG 序列结合后,将衔接子蛋白MyD88 募集至IRAK-4 的TIR 结构域,导致IRAK-1 磷酸化,通过涉及TRAF-6等一系列反应导致 NF-κB 激活[17-18]。NF-κB 从细胞质转运至细胞核,调节参与各种细胞过程(如细胞活化、增殖和促炎性细胞因子调节等)的基因表达[19]。此外,TLR 传导信号还可诱导包括p38 激酶、c-Jun-N 端激酶(SPAK / JNK)和 ERK1 / 2 等分子在内的蛋白发生磷酸化[18,20],最终通过宿主免疫细胞中的各种转录网络直接或间接激活MAPK 信号通路[21-22]。而本研究中BC01 佐剂免疫后24 h,MAPK 和ERK1 /2 信号级联反应相关基因均被显著富集,这与前期研究结果一致[12]。
综上所述,本研究结果表明,新型生物佐剂BC01作为一种有效的TLR9 激动剂,在机体免疫后24 h,能显著上调免疫细胞活化、迁移与趋化、吞噬作用调节等固有免疫和适应性免疫相关功能基因,具有明显的免疫激活作用。这些研究结果为更好地了解BC01 佐剂在体内的免疫调节机制,加速该佐剂的临床应用提供了数据支撑。

