奇异变形杆菌脂多糖抗原的制备及其对小鼠免疫原性、毒性、安全性和保护性评价
杨文腰,韩镌竹,廖辉,修雪亮,张建,侯雅丹,周荔葆
1.辽宁成大生物股份有限公司,辽宁 沈阳 110179;2.辽宁省检验检测认证中心,辽宁 沈阳 110016
变形杆菌属是革兰阴性机会致病菌,属于肠道细菌科,广泛分布于自然环境及人类和动物的肠道中[1]。当患者免疫功能低下、术后及烧伤时,临床上常见的条件致病菌就会引起相关细菌感染,尤其是奇异变形杆菌(Proteus mirabilis,PM)引起的败血症,病死率较高,也是泌尿系统感染的主要病原菌[2]。
近些年,随着广谱及超广谱β-内酰胺类抗菌药物在临床上广泛大量使用,导致变形杆菌的耐药性日趋严重,耐药率也逐渐呈上升趋势,给临床治疗感染性疾病带来很大困难。于波心等[3]对医院临床分离获得的266 株PM 进行分布及耐药性分析,样本主要来源于尿液(57.89%),阳性检出率为19.92%。陆玉婷等[4]对250 株PM 进行耐药性分析,药敏结果显示,PM 对氨苄西林、复方新诺明、头孢呋辛、环丙沙星耐药率较高,且大部分具有多重耐药现象。抗生素的使用不能预防感染,长期使用抗生素可能引起菌群失调,引起细菌多重耐药性的生产[5]。
脂多糖(lipopolysaccharide,LPS)是构成革兰阴性菌细胞外壁的特有成分之一,具有种属特异性,在革兰阴性菌感染和疾病演化过程中也具有重要作用,是造成全身性炎症综合征的主要原因[6]。本研究通过对经纯度检定、种属鉴别合格的31 株PM 进行菌株耐药性、毒力、LPS 抗原免疫原性、安全性及毒性等检测,初步获得候选株,同时进一步对其LPS多价抗原开展保护性研究,评价候选株是否适用于疫苗的生产,为后续疫苗生产工艺的研究提供试验基础和技术支持。
1 材料与方法
1.1 菌株 PM 样本由中国医科大学附属盛京医院从我国华南、东南、西北、西南及东北5个地域的三甲医院收集,经纯度检测、种属鉴别合格后确定31株样本符合试验要求。
1.2 主要试剂及仪器 革兰染色试剂盒购自美国Sigma 公司;Tergitol-7、营养琼脂、替卡西米、头孢噻肟、庆大霉素、环丙沙星、四环素、氯霉素、亚胺培南药敏纸片及M-H 培养基均购自英国Oxoid 公司;API20E 购自法国梅里埃公司;酪蛋白、酵母浸粉、葡萄糖、胰酶等无机盐购自国药控股有限公司;发酵罐购自德国贝朗医疗(苏州)有限公司;超滤膜包购自美国Millipore 公司。
1.3 实验动物 SPF 级昆明种小鼠,3 周龄,体重16 ~18 g,雌雄各半,购自湖南斯莱克景达实验动物有限公司,动物合格证号分别为43004700012102、43004-700014310、43004700018079、43004700030707 及43-004700031315;SPF 级豚鼠,体重 260 ~ 280 g,雌雄各半,购自北京维通利华实验动物技术有限公司,动物合格证号为11400700105438。本实验均以科研为目的对实验动物进行养殖和使用,且按照2006年9 月13 日科技部颁布的《关于善待实验动物的指导性意见》中动物伦理相关规定进行(国科发财字[2006]398 号)。
1.4 抗生素耐药性测定 选择7 种常规抗生素对31株PM 进行抗生素耐药性试验,获取菌株抗生素耐药性谱图。分别将预增菌后的含有PM 的营养肉汤划线接种于营养琼脂平板上,37 ℃培养18 ~24 h。采用K-B 法对上述菌株进行耐药性测定,将菌悬液涂布于M-H 平板,贴上上述药敏纸片后放置于37 ℃培养箱中培养16 ~18 h,测定抑菌圈直径,结果评价依据 Clinical and Laboratory Standards Institute(CLSI)(2012)参考标准确定菌株属于敏感(S)、耐受(R)或介于两者之间(I)。
1.5 菌株毒力测定 通过小鼠半致死量(lethal dose,50%,LD50)对筛选获得的13 株具有多重耐药性的PM 进行 LD50测定。初始浓度为 8.0 × 109/ mL,用无菌0.9% NaCl 溶液冲洗含有菌株的斜面培养物,倍比稀释(1 ∶2、1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128、1 ∶256 和 1 ∶512);取昆明种小鼠 936 只,经腹腔注射,0.5 mL / 只,每组 8 只,共 9 组,连续记录5 ~7 d,统计小鼠死亡情况,并计算LD50,根据菌株LD50大小确定候选菌株(LD50越小,毒力越大)。
1.6 LPS 抗原的制备
1.6.1 大规模发酵罐培养 取确定的PM 进行大规模发酵培养,发酵培养液为霍廷格培养基,菌株生产工艺相同。向反应器中加入7 ~8 L 培养基,接种细菌密度为 2.0 × 107个 / mL,共 200 mL,设定主要发酵参数:37 ℃,pH 7.2,200 r / min,溶氧 30%。培养至对数生长后期,细菌密度达稳定后停止培养。
1.6.2 LPS 抗原收获时间的优化 采用盐酸羟胺在位萃取法获得 PM LPS 抗原[7]:按 1 L 菌液中 1 ×109个 /mL 加入 60 μg 盐酸羟胺,在 56 ℃条件下设定通气量 2 L / min、转速 100 r / min、pH 7.2,每隔 6 h取样,检测LPS 抗原含量,确定最佳萃取时间。
1.6.3 LPS 抗原的纯化 在位消化后,采用低温高速离心法分离菌体,收获上清液中LPS 抗原、经超滤、两步沉淀法(分别在pH 5.5 和pH 4.3 用75%预冷乙醇沉淀LPS 抗原)、冷冻干燥等技术获得固体抗原,残留水分不高于5%。
1.7 LPS 抗原含量测定 采用蒽酮-硫酸法测定PM LPS 抗原多糖含量。以葡萄糖溶液为标准溶液,取6.25、12.5、25.0、50.0、100.0、200.0 μg / mL 6个不同浓度葡萄糖溶液各1 mL,分别与5 mL 蒽酮溶液混合,冰浴和沸水浴各10 min,冷却后作为标准品绘制浓度标准曲线,在波长620 nm 处记录吸光度值。
1.8 LPS 抗原活性测定
1.8.1 免疫原性测定 分别取候选菌株LPS 抗原冻干品,用无菌生理盐水配制成 300、30、3、0.3 μg /mL,取昆明种小鼠360 只,10 只/组,对照组为生理盐水,经腹腔注射,0.5 mL / 只,免疫 7 d 后进行攻菌试验,攻菌剂量为 6 LD50,注射途径同上,0.5 mL / 只,观察5 ~7 d,记录小鼠死亡数,并计算ED50,应低于10 μg / mL。
1.8.2 安全性测定 分别取候选菌株LPS 抗原冻干品,用生理盐水稀释至 250 μg / mL。取豚鼠 18 只,每组注射 2 只,0.5 mL / 只,经腰部两侧皮下各注射0.25 mL。注射后1 周内每日称量豚鼠重量并观察局部反应,1 周后3 日称重并记录局部反应,结束观察期。7 d 内豚鼠体重下降不超过10%,且观察期结束时体重明显增长即可判定该受试品安全性合格。
1.8.3 毒性测定 分别取候选菌株LPS 抗原冻干品,用无菌生理盐水配制成 4、2、1、0.5 mg / mL。取昆明种小鼠 360 只,经腹腔注射,0.5 mL /只,10 只 /组,观察5 ~7 d,统计不同浓度组的死亡情况,并计算LD50值,应不低于 0.6 mg / mL。
1.9 同一性试验(Dienes) 采用 Dienes 试验[8]对1.8.3 项试验选择的PM 进行分型研究,选择的PM分别交叉配对,每2 株细菌间隔一定的距离点种于同一营养琼脂平板上,共计15 组,经37 ℃培养18 ~24 h,观察结果。菌株相互蔓延生长至相近处两菌苔出现明显分界线,即细菌产生拮抗,进一步说明菌株不是同一菌株。
1.10 LPS 多价抗原保护性试验
1.10.1 侯选菌株保护性试验 分别取1.8.3 项选择的候选菌株LPS 抗原冻干品,按1 ∶1 比例混合并调节终浓度为50 μg / mL。取昆明种小鼠 120 只,随机分为试验组和对照组,每组60 只。试验组注射LPS 多价抗原,对照组注射生理盐水。7 d 后分别经腹腔注射对应菌株,攻菌剂量为3 LD50,每组10 只,观察5 ~7 d,记录小鼠死亡数,并计算多价抗原对候选株的保护性,应不低于70%。
1.10.2 其他菌株保护性试验 分别取1.8.3 项选择的候选菌株LPS 抗原冻干品,按1 ∶1 比例混合并调节终浓度为 50 μg / mL。取昆明种小鼠 360 只,随机分为对照组和试验组,每组180 只。对照组为生理盐水,试验组经腹腔注射 LPS 多价抗原,0.5 mL / 只。免疫7 d 后分别用同种属其他菌株(18 株)进行攻击,攻菌剂量为2 LD50,观察5 ~7 d,记录小鼠死亡数,并计算多价抗原对其他菌株的保护性,应不低于50%。
1.11 数据分析 采用 Excel 2007 软件对实验数据进行分析。
2 结 果
2.1 抗生素耐药性 大多数PM 对7 种抗生素具有耐药性,尤其对四环素和氯霉素耐药性较高,分别为83.87%和87.09%,对替卡西林、庆大霉素、环丙沙星的耐药性分别为58.06%、51.61%和45.16%,但对亚胺培南、头孢噻肟敏感,耐药性仅为3.23%和29.03%。PM 具有多重耐药性,选择至少耐受4 种抗生素的菌株,共 13 株:PM13、PM15、PM28、PM43、PM62、PM66、PM92、PM100、PM104、PM105、PM107、PM109、PM110,见表 1。

表1 PM 候选菌株抗生素耐药性筛选结果Tab.1 Screening of candidate PM strains by antibiotic resistance
2.2 菌株毒力 13 株PM 毒力大小顺序为:PM15 >PM28 > PM92 > PM43 > PM62 > PM13 > PM109 >PM100 > PM104 > PM107 > PM105 > PM110 > PM66,见表2。选择9 株毒力较强的菌株,分别为:PM13、PM15、PM28、PM43、PM62、PM92、PM100、PM104、PM109。

表2 PM 候选菌株LD50 检测结果Tab.2 Determination of LD50 of candidate PM strains
2.3 在位消化不同时间对LPS 抗原含量的影响 在620 nm 波长下,经蒽酮-硫酸法测定多糖含量标准曲线为:y = 0.007 9 x + 0.049 9,R2= 0.995 7。LPS抗原随消化时间延长,含量逐渐增加,在66 ~72 h基本达到稳定,见表3。

表3 在位消化不同时间的LPS 抗原含量Tab.3 LPS antigen contents after in-situ digestion for various hours
2.4 LPS 的抗原活性
2.4.1 免疫原性 9 株PM 的ED50有一定差异:PM100 > PM104 > PM15 > PM92 > PM43 > PM13 >PM62 > PM28、PM109,均符合试验要求,见表 4。

表4 9 株PM LPS 抗原的ED50Tab.4 ED50 for LPS antigen of nine PM strains
2.4.2 安全性 不同候选菌株LPS 抗原注射后,开始2 d 豚鼠体重有所减轻,但不明显,1 周后体重恢复至观察期且均呈增长趋势,且注射部位无结块、坏死等现象发生,因此,9 株菌均符合要求。
2.4.3 毒性 不同菌株LPS 抗原的毒性有一定差异:PM15 > PM100 > PM13 > PM43 > PM62 > PM109 >PM92 > PM28 > PM104,其中 PM15、PM100、PM109 毒性较大,LD50分别为 0.379、0.594 和 0.424 mg / mL,PM104 毒性最小,为max,见表5。根据LD50不低于0.6 mg /mL 的要求,应选择菌株 PM13、PM28、PM43、PM62、PM92 和 PM104。

表5 不同PM LPS 抗原的LD50Tab.5 LD50 of LPS antigen of various PM strains
2.5 同一性试验 Dienes 试验结果显示,PM13、PM28、PM43、PM62、PM92、PM104 均不属于同一株菌株,部分试验结果见图1。

图1 PM Dienes 试验结果Fig.1 Dienes test result of PM
2.6 LPS 多价抗原的保护性
2.6.1 侯选菌株保护性 LPS 多价抗原对6 株侯选菌株的保护率均在70%以上,均符合要求,见表6。

表6 LPS 多价抗原对候选菌株的保护性Tab.6 Protective effect of polyvalent LPS antigen on candidate strains
2.6.2 其他菌株的保护性 LPS 多价抗原对18 株PM 的保护率在20% ~90%之间,具有一定差异,其中保护率 ≥ 50%的占77.78%,表明PM LPS 多价抗原能广泛性预防PM 其他菌株的感染。见表7。
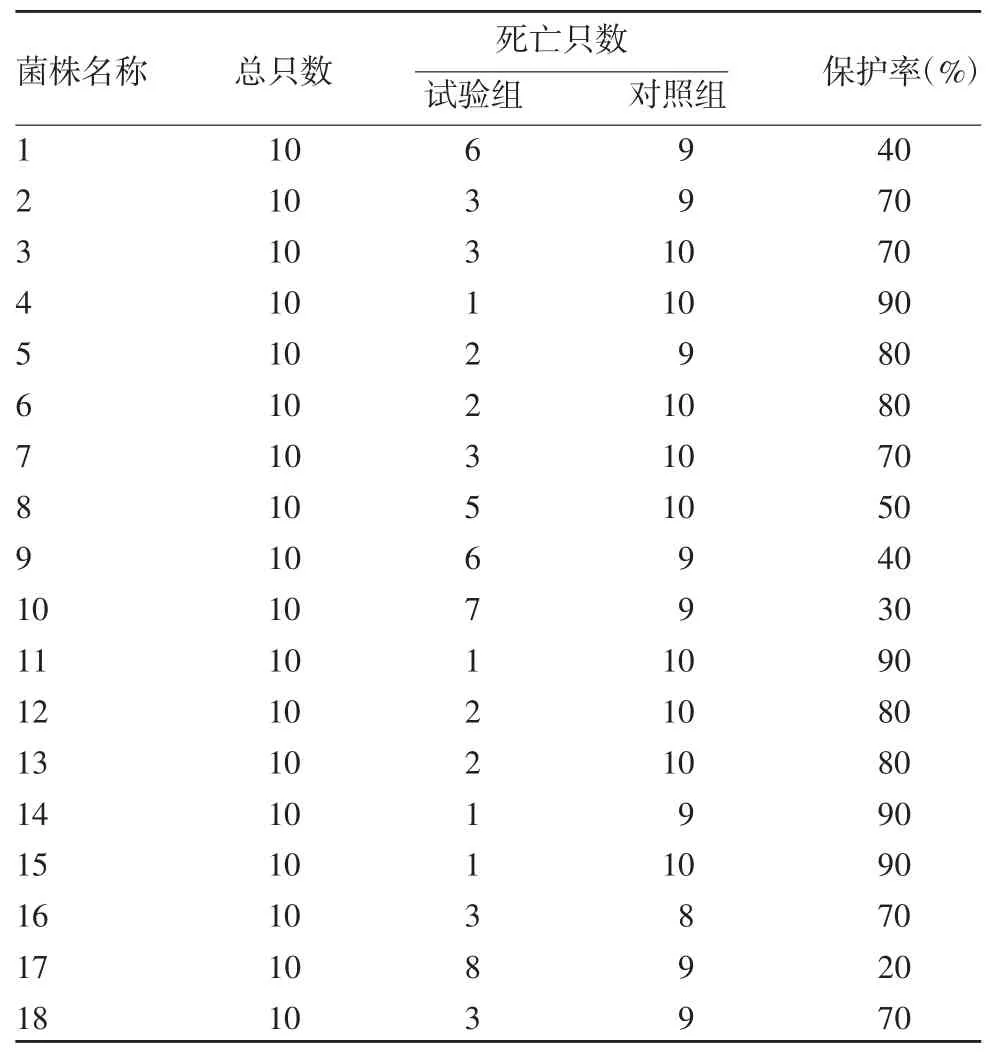
表7 LPS 多价抗原对同种属其他菌株的交叉保护性Tab.7 Cross-protective effect of polyvalent LPS antigen on the other PM strains
3 讨 论
为了减少临床抗生素使用及术后感染风险,为预防用疫苗的制备生产提供生产用菌株,本研究通过抗生素耐药性和菌株毒力试验从31 株PM 中筛选出9 株候选菌株,又通过对9 株菌株LPS 抗原的免疫原性、毒性及安全性试验,获得6 株免疫原性高、毒性小且安全性强的候选菌株,分别为PM13、PM28、PM43、PM62、PM92、PM104。耐药性试验结果表明,PM 均具有多重耐药性,尤其对四环素和氯霉素耐药性较高,分别为96.30%和88.89%,但对亚胺培南、头孢噻肟较为敏感,耐药性仅为3.23%和29.03%,这与文献报道基本一致[9]。因此,医院应加强对抗生素使用的管理及使用,除此之外,可寻求其他有效的预防途径。
近些年来,全菌体疫苗、减毒疫苗[10]及DNA 疫苗[11]相继得到研究,但由于全菌体疫苗除保护性抗原外,还有许多与免疫保护不相关或有毒的成分,毒副反应大,在人体内的使用受限,DNA 疫苗在体内随机重组,存在安全性问题。因此,与免疫有关的各种组分疫苗愈来愈受到研究者的关注。PM 的致病性主要来源于病毒溶血素(hemolysins,HpmA)[12]、鞭毛(flagella)[13]、菌毛(fimbriae)[14]、外膜蛋白(outer membrane protein,OMP)[15]及 LPS[16-17]等。LPS 作为构成革兰阴性细菌的外层细胞膜,是其最可变的成分。LPS 被认为在尿路感染过程中起重要作用,影响膀胱和肾结石的形成[6,18]。LPS 的制备方法包括热酚水法[19]和冷酚水法[20]、酚 / 氯仿抽提法等。由于苯酚和氯仿存在毒副作用,本研究采用盐酸羟胺萃取法提取PM LPS 抗原,通过优化在位消化反应,获得最佳萃取时间为72 h,经检测,LPS 含量达1.15 mg / mL。
本研究选择6 株PM 制备LPS 多价抗原,分别对候选株和同种属其他菌株进行交叉免疫保护性检测,评价各菌株是否适合用于生产研究。试验结果表明,该LPS 多价抗原对候选株具有完全的保护作用(≥70%以上),对同种属其他菌株攻击的交叉保护作用在20% ~90%之间(保护性 ≥ 50%的占77.78%),其中对部分菌株的保护效果较低,可能是由于其与候选株之间不是同一亚型或亲缘关系较远,在后续试验中可重点考察对这几株PM 的保护性,以期达到对同种属其他菌株的预期保护效果。本研究旨在制备初步选择的6 株PM LPS 多价抗原,可作为预防用疫苗,对医院条件致病菌感染的治疗及预防流行病研究具有重要意义。由于LPS 具有较强的毒副作用,后续仍需继续开展类脂A 去除及工艺放大研究,为实现PM LPS 抗原企业化生产提供技术支持。

