直接热解法制备棒状二氧化锆粉体
宋健清,李玉虎*,张敏,孙亮
(江西理工大学,a.材料冶金化学学部; b.赣州市绿色冶金与过程强化工程技术研究中心,江西 赣州 341000)
二氧化锆(ZrO2)因具有优良的半导体性、敏感功能性和增韧性等理化特性,被用于电子陶瓷、功能陶瓷、结构陶瓷以及耐火材料、陶瓷颜料等新材料的制备,随着高新技术产业的蓬勃发展,其在化工、电子、陶瓷等领域的发展日趋广泛,这使得ZrO2特种粉体的制备研究备受关注[1]。田利萍等研究了钙稳定氧化锆质材料的高温电性能,随着CaO 掺杂量的增加,试样中立方相氧化锆含量增加,单斜相含量明显减少;不同相组成使氧化锆材料在高低温区电导率存在差异,其中立方相含量的增加有助于电导率的提高[2]。目前,ZrO2粉的制备方法主要有化学法[3-5]、溶胶-凝胶(Sol-Gel)法[6-9]、水热法[10-12]、电熔法[13-16]、微波热处理法[17-19]、喷雾热解法[20]等,其中以湿法制备ZrO2粉体为主。高啟蔚等采用溶剂热工艺合成氧化锆前驱体,随着容弹温度的升高,前驱体中氧化锆晶体的发育也越来越好;容弹温度为120 ℃时,能够获得大量平均长径比达15 且沿[001]方向生长的单斜氧化锆晶须[21]。赵志龙等以八水氧氯化锆为原料,以氨水、氢氧化钠溶液为沉淀剂,采用溶胶-凝胶法制备纳米级氧化锆粉体,对前驱体加入不同的稳定剂,通过吸滤、干燥、煅烧等工艺,得到以四方晶相为主、不同粒度组成、不同四方相含量的氧化锆样品[22]。刘健敏等采用非水解溶胶-凝胶工艺结合熔盐法制备氧化锆晶须,以回流工艺下获得的干凝胶粉为反应前驱体,优选热处理温度为900 ℃、热处理时间为5 h,能够制得平均直径为110 nm,平均长径比大于18 且沿[010]方向生长的单斜氧化锆晶须[23]。YAO 等采用预制聚苯丙烯酸(PSA)作为模板球体,在混合溶剂中制备出单分散微米空心氧化锆球[24]。除了湿法制备工艺外,热解法也备受关注。周竹发等采用蒸发热解法,通过调整和控制锆盐溶液的浓度、溶剂、雾化量、温度等工艺参数,制备出0.4~1.5 μm 的超细高纯ZrO2粉体[25]。戴遐明等将氧氯化锆配制成水溶液,利用双流体雾化器将其喷成雾状并由压缩空气载入由30 kW、4 MHz的RF 电源产生的等离子尾焰中,使其发生热解反应,从而获得超细ZrO2粉末[26]。SANDRA 等以甘氨酸作为模板剂,硝酸锆和硝酸铈为原料,利用超声波喷雾热解制备出壁厚为5 nm,直径为100 nm 的超薄空心铈锆氧化物纳米球[27]。HWANGBO 等在锆盐超声喷雾热解过程中引入柠檬酸盐,制备出粒度、形貌可控的纳米氧化锆粉[28]。王霞等采用溶胶-凝胶-喷雾热解法,通过控制溶胶浓度和喷雾温度,制备出亚微米级球形中空氧化锆粉体[29]。
尽管科研工作者针对ZrO2粉体制备开展了广泛研究,并取得了显著的进展,但这些研究主要以湿法、喷雾热解法为主,存在流程长、能耗高、效率低的缺点,尤其是这些研究多用于超细球形或空心氧化锆颗粒的制备,对有关棒状、纤维状ZrO2的制备研究较为欠缺,特别是采用直接热解法制备棒状、纤维状ZrO2的研究报道很少。
考虑到当前对直接热解法制备氧化锆粉体的研究较少,本文开展了以氧氯化锆为原料,采用热解法直接制备氧化锆粉体的研究。通过研究,查明氧氯化锆在高温场中的反应规律,揭示氧化锆粉体的形成机制,为短流程制备棒状氧化锆粉体提供技术和理论支持。
1 实 验
1.1 实验原料及设备
实验所用锆源为高纯ZrOCl2·8H2O,来自广东翁江化学试剂有限公司; 实验过程所用其他原料如纯O2、纯N2、乙醇等,均为分析纯,实验用水均为高纯水。
实验采用上海黔通仪器科技有限公司的开启式管式气氛炉,型号为QKF1200-60,温度控制精度为±0.5 ℃。
1.2 实验方法
称取一定量的ZrOCl2·8H2O 于刚玉坩埚中,将其置于干燥箱中,分别在80、120、160、200 ℃条件下进行恒温脱水,得到结晶水系数分别为6.40、3.84、2.23、0 的热解前驱体。然后将所得前驱体置于管式炉中,升温至目标温度450 ℃并保温2 h。反应结束后,冷却至室温,称量焙烧产物重量,计算失重率,并取样进行XRD 和SEM 表征。
1.3 分析表征
采用X 射线衍射仪 (RINT-2000X,CuKa 辐射,40 kV,扫描速度10(°)/min,扫描范围10°~90°)表征热解产物的物相组成,测定晶粒尺寸;采用扫描电子显微镜(FEI-Prisma-E X130)观测热解产物微观形貌和粒度分布特征; 采用热重差热分析仪(TG/DTA 6300)解析ZrOCl2·8H2O 的热行为。
2 结果与讨论
2.1 ZrOCl2·8H2O 的热分解过程热力学计算
由ZrOCl2·8H2O 的性质可知,其在高温下先发生脱水反应,生成ZrOCl2,进而发生脱氯反应。为进一步解析ZrOCl2在高温热场中的行为,对ZrOCl2的热分解过程进行了热力学计算[30],结果如图1 所示。由图1 可以看出,不论是ZrOCl2,还是中间态Zr2O3Cl2的热分解反应,其生成吉布斯自由能较低,表明在高温场中有氧气或水蒸气存在时,均可分解为ZrO2。相对于水蒸气气氛,ZrOCl2和Zr2O3Cl2在氧化气氛下的分解趋势更大。在单一反应气氛(氧化气氛或水蒸气气氛)时,在分解温度较低的条件下,ZrOCl2直接分解反应与间接分解反应的生成吉布斯自由能差别不大,均有发生的可能性。随着分解温度的升高,ZrOCl2直接分解为ZrO2的反应趋势更强。综上所述,氧氯化锆在氧化或水蒸气气氛中均能够分解,生成氧化锆。
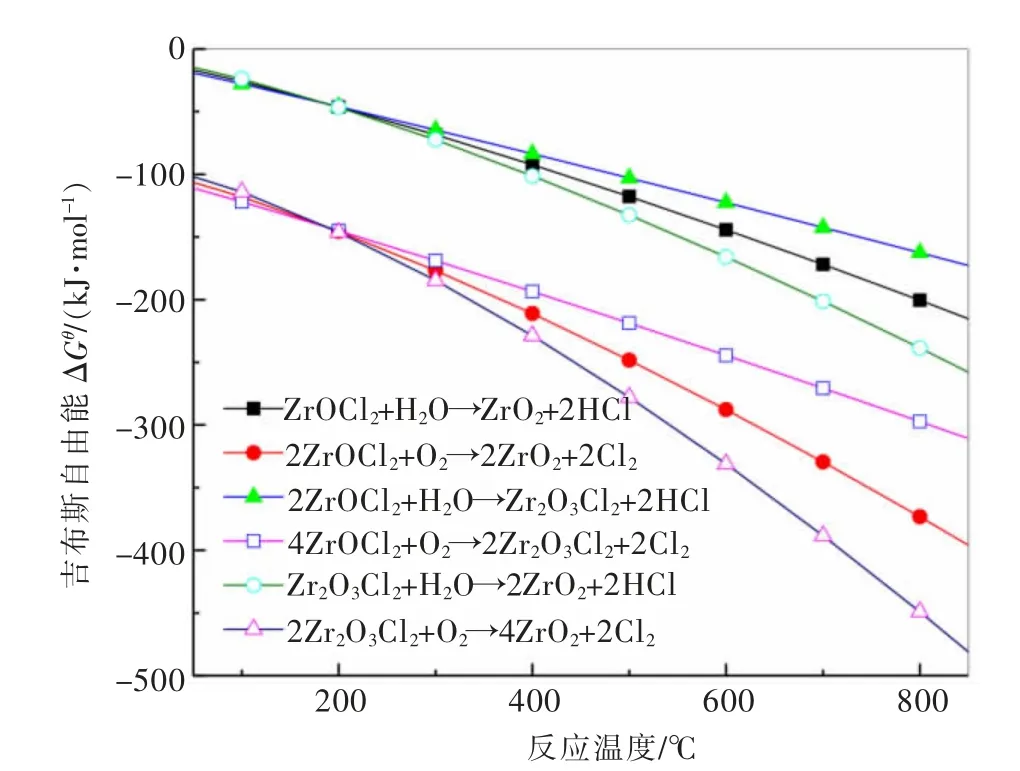
图1 ZrOCl2·8H2O 的焙烧热力学曲线Fig.1 Thermodynamic diagram of roastingZrOCl2·8H2O
2.2 ZrOCl2·8H2O 热行为研究
图2 所示为ZrOCl2·8H2O 在空气中的TGA 曲线。由图2 可以看出,ZrOCl2·8H2O 的失重过程大致分为4 个阶段: 在29.6~146.3 ℃发生第一个阶段失重,失重率为16.90%,与之对应的失重反应是失去3 个结晶水(理论失重率16.77%);在146.3~227.6 ℃发生第二阶段失重,失重率为25.57%,与之对应的失重反应是失去4.5 个结晶水 (理论失重率25.15%);在227.6 ~382.3 ℃发 生第三阶段失重,失重率为11.34%,与之对应的失重反应是分解反应,即脱去0.5 个H2O 和1 个 氯(理论失重率11.33%);在382.3~812.2 ℃发生第四阶段失重,失重率为8.43%,与之对应的失重反应是脱氯反应 (理论失重率8.53%)。因此,由ZrOCl2·8H2O 的热重表征结果,可以推断出ZrOCl2·8H2O 在热场中反应历程为:
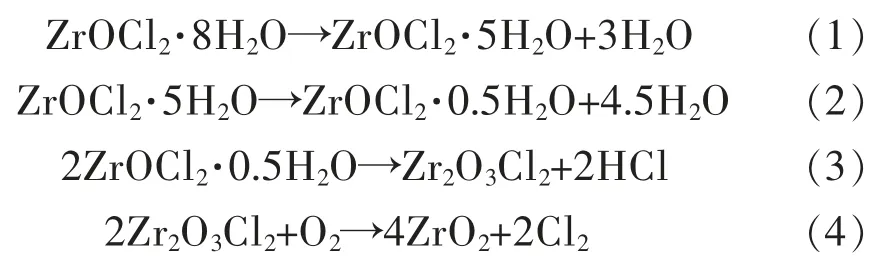
图2 ZrOCl2·8H2O TGA 曲线Fig.2 TGA curve of ZrOCl2·8H2O
2.3 氧氯化锆热解实验研究
2.3.1 前驱体的影响
通过恒温干燥制备了结晶水系数分别为8、6.40、3.84、2.23、0 的氧氯化锆,以其作为热解前驱体,考察不同前驱体对产物形貌和物相的影响,结果如图3 和图4 所示。由图3 可以看出,尽管前驱体不同,但所得产物均为ZrO2,且为单斜相 (PDF#86-1451)和四方相(PDF#79-1769)的混合物,特征峰较为尖锐,产物结晶度较好。
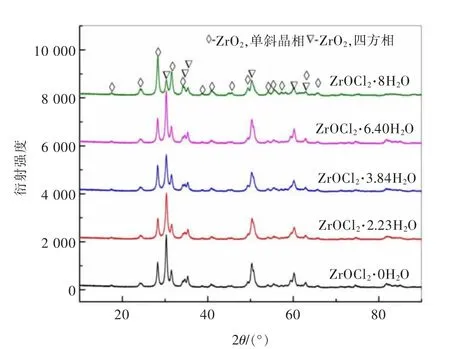
图3 不同前驱体热解所得产物XRD 图谱Fig.3 XRD patterns of thermolysis products of different precursors
由图4 可以看出,结晶水含量对产物形貌和粒度影响较为显著。当前驱体为ZrOCl2·0H2O 时,所得产物颗粒形貌以短棒状为主,颗粒粒度分布较宽,除了30~40 μm 的大颗粒外,还存在一些微米级的小颗粒; 前驱体为ZrOCl2·2.23H2O 或ZrOCl2·3.84H2O时,所得产物形貌未发生明显变化,但产物中大颗粒粒度明显减小。但是,当前驱体结晶水系数增加至6.40 时,所得产物再次出现大量短棒状颗粒,且粒度较为粗大,粒度分布变宽。当前驱体为ZrOCl2·8H2O时,所得产物中棒状颗粒减小,不规则颗粒增多,但颗粒粒度分布变窄。这可能是由于结晶水对氧氯化锆热解反应历程不同造成,在低结晶水时,氧氯化锆主要通过氧化反应进行,结合图1 可以知,氧氯化锆的氧化反应趋势强于水解反应,这使得氧氯化锆分解体系易于形核,大量形核导致晶核凝聚并长大,形成棒状大颗粒;而高结晶水时,氧氯化锆主要以水解反应进行。
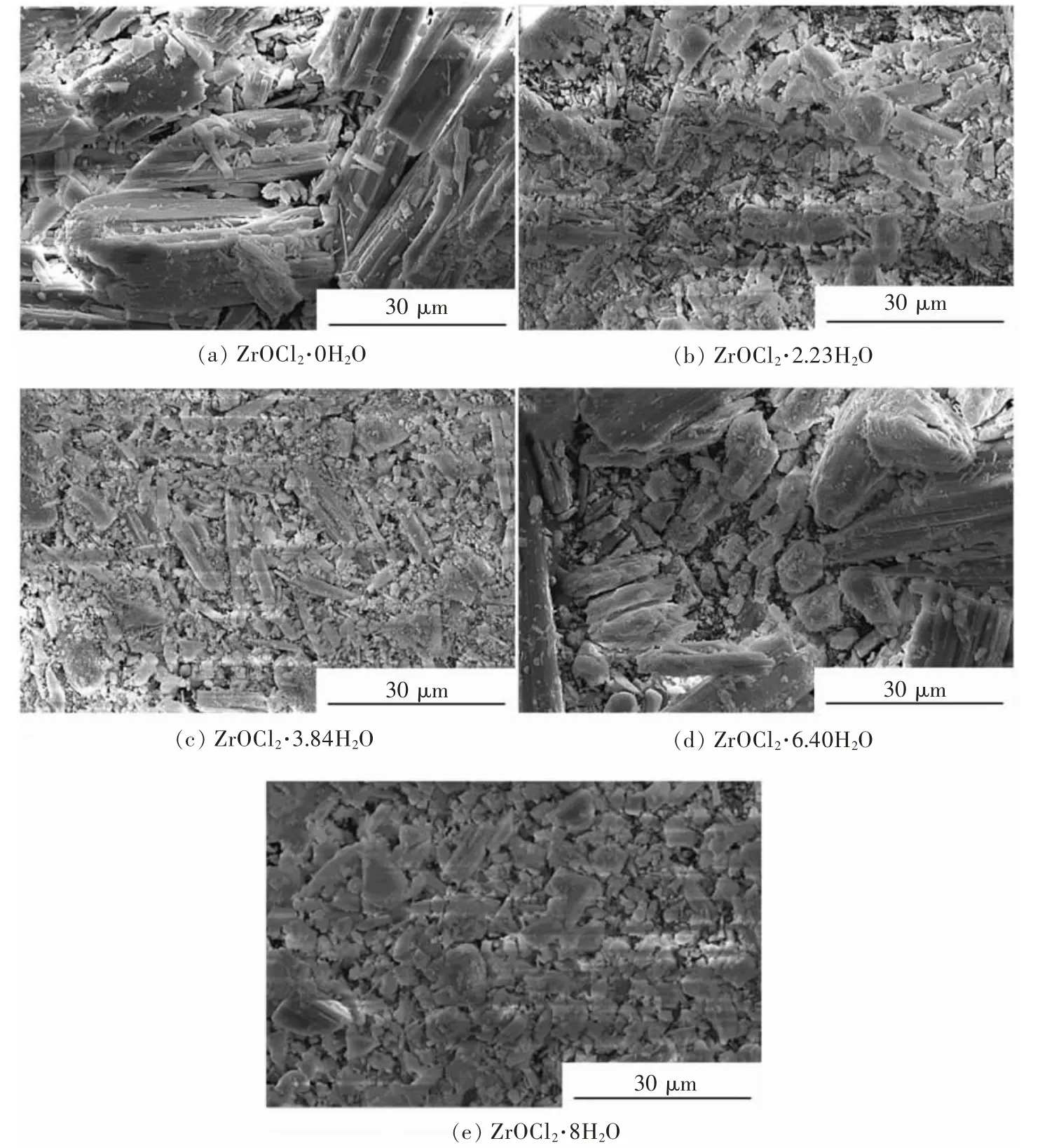
图4 不同前驱体热解所得产物SEM 像Fig.4 SEM photos of thermolysis products of different precursors
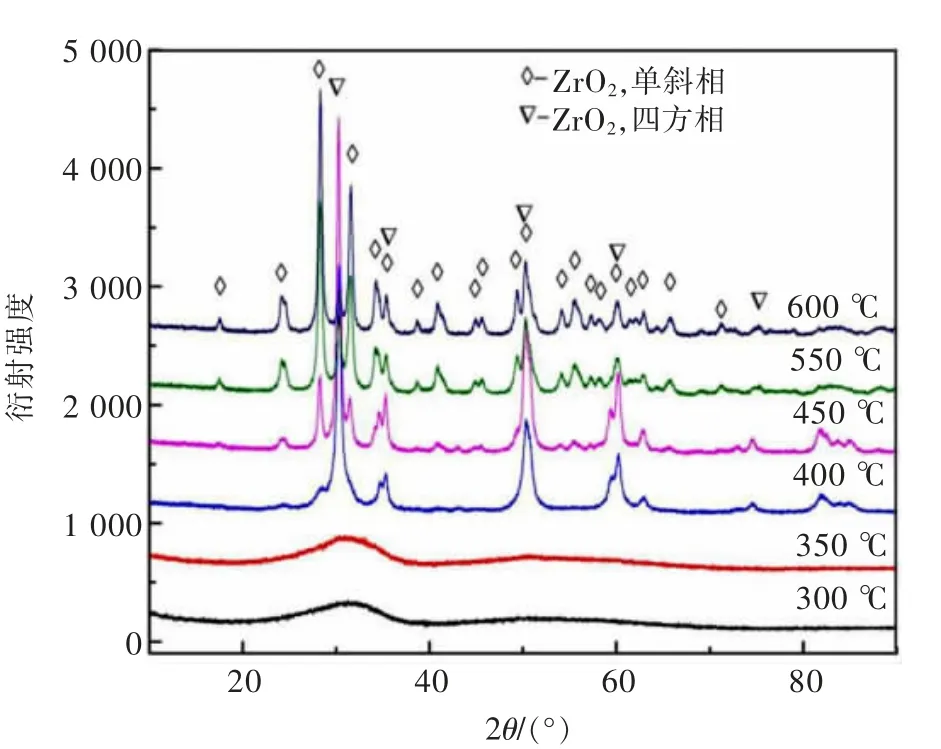
图5 不同焙烧温度下所得产物的XRD 图谱Fig.5 XRD patterns of products obtained at different calcination temperatures
2.3.2 热解温度的影响
以ZrOCl2·3.84H2O 为实验原料,考察了在分解温度为300~600 ℃范围内,分解温度对ZrOCl2·3.84H2O分解产物物相、形貌的影响,结果如图5 和图6 所示。在350 ℃和600 ℃时分解产物的失重率分别为53.76%和56.63%,两者相差不大,因而,从失重率来看,当热解温度超过350 ℃后,热解反应已基本完成。上述结果可从分解产物的XRD 图谱得到证实,即当温度超过350 ℃,产物中仅见二氧化锆的衍射特征峰,未见其他杂相。不同热解温度所得二氧化锆的晶型不同。由图5 可以看出,当分解温度低于400 ℃时,所得产物为非晶物质,样品中无结晶物相生成;当分解温度为400 ℃时,所得产物为四方相二氧化锆;而当温度超过450 ℃时,所得产物为四方相和单斜相二氧化锆的混合物;当热解温度继续增加时,四方相二氧化锆衍射特征峰强度降低,同时单斜相二氧化锆衍射特征峰强度增加,这表明分解温度对产物的物相和晶型影响较为显著。由文献[31]可知,随着焙烧温度的改变,不同晶型二氧化锆可发生晶型转化,因而,可以通过调控热解温度制备出不同晶型的二氧化锆产物。
焙烧温度对产物氧化锆形貌的影响如图6 所示。由图6 可以看出,焙烧温度对产物形貌影响较为显著。当焙烧温度低于450 ℃时,随着焙烧温度增加,产物中棒状颗粒数量增多,且棒状颗粒的长径比逐步增加;当焙烧温度为450 ℃时,所得二氧化锆主要以棒状颗粒存在,颗粒较为光滑,但存在少量的裂纹和孔洞,棒状长度为100~200 μm,直径为30~50 μm;当焙烧温度超过550 ℃后,所得二氧化锆中棒状颗粒减少,类球形颗粒数量增加。这两类颗粒粒度相差较大,棒状颗粒较为粗大,颗粒表面较为光洁,粒径为30~50 μm,且长径比较小,而类球形颗粒粒度大多在微米量级。
2.3.3 热解气氛的影响
由理论计算可知,氧氯化锆在高温热场中的热解途径有2 种:高温水解和氧化还原反应,不同反应途径可能会得到不同物性的产物。为查明这一影响,以ZrOCl2·3.84H2O 为实验原料,分别在N2-H2O 和O2气氛下开展了热解实验,实验结果如图7 和图8 所示。由图7 可以看出,尽管氧氯化锆在N2-H2O 和O2气氛中的热解机理不同,但所得产物均为二氧化锆,且为四方相和单斜相的混合相,产物未见其他杂相。

图6 不同反应温度下所得产物SEM 照片Fig.6 SEM photos of products obtained at different reaction temperatures
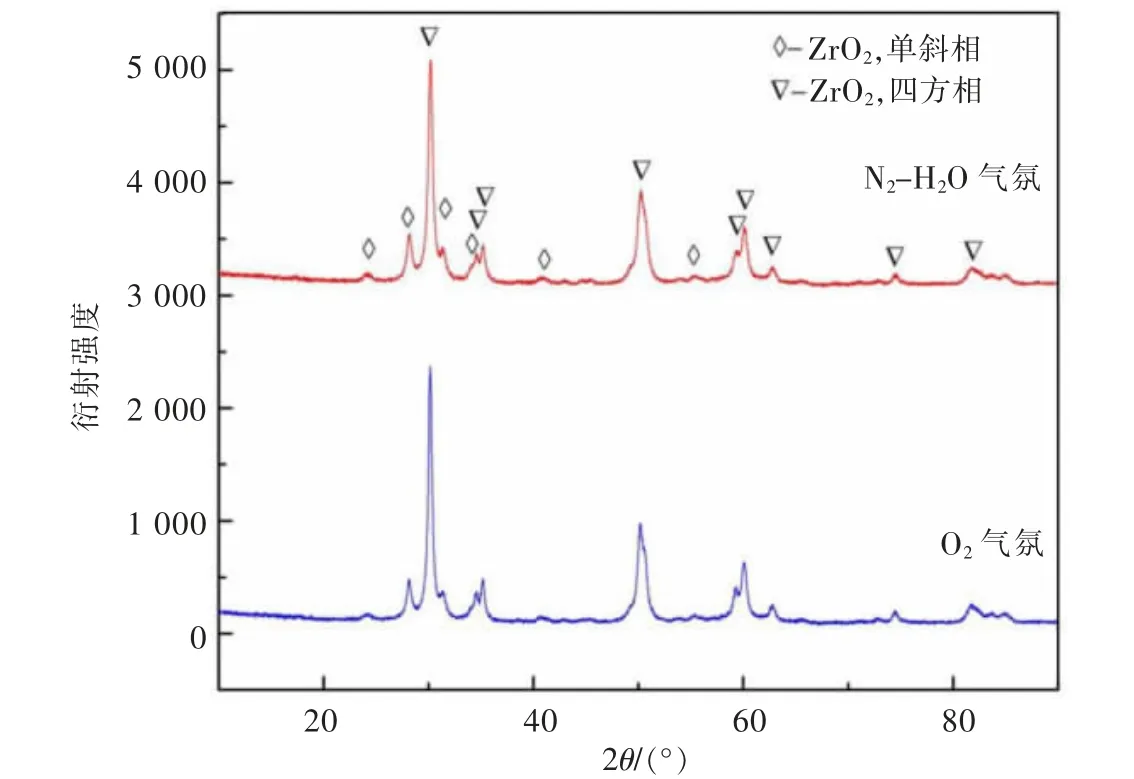
图7 不同反应气氛下所得产物XRD 图谱Fig.7 XRD patterns of products obtained in different reaction atmospheres

图8 不同反应气氛条件下所得产物SEM 照片Fig.8 SEM photos of products obtained under different reaction atmosphere conditions
尽管产物物相一致,但两种不同热解气氛下所得二氧化锆的形貌和粒度有一定的差异。在N2-H2O 气氛中,所得二氧化锆颗粒形貌主要以棒状为主,粒度较为均匀,长径比约为4~6,且颗粒表面较为光洁,无明显的孔洞缺陷;而在O2气氛中,所得二氧化锆除了棒状颗粒外,还存在一些不规则片状颗粒,且粒度分布较宽,既有长度达500 μm 的棒状颗粒,也有长度不足10 μm 的棒状颗粒。此外,在O2气氛下得到的二氧化锆颗粒表面较为粗糙,存在一定量的裂纹和孔洞。这可能是由于两种气氛下晶核的形成和生长条件不同所致。由图1 的氧氯化锆焙烧热力学可知,相对于H2O 气氛,在O2气氛下的反应吉布斯自由能更低,这意味着该反应体系的形核驱动力更强,形核速率更高,使得不同时期形成的晶核生长期不同,从而导致颗粒粒度分布较宽。
3 结 论
1)热力学计算表明,氧氯化锆在空气和水蒸气气氛中均可完成热解反应,DTG 分析结果进一步证实了氧氯化锆直接热解制备氧化锆的可行性。
2)用不同结晶水的氧氯化锆进行热解反应,均可得到氧化锆,但结晶水含量对产物形貌影响较为显著,这与氧氯化锆热解反应途径有关,当结晶水含量较低时,分解反应主要以氧化反应的模式进行;当结晶水含量较高时,分解反应主要以水解反应模式进行。
3)热解温度低于400 ℃时,产物为非晶物质;热解温度为400 ℃时,产物为四方相二氧化锆; 超过450 ℃时,产物为四方相和单斜相的混合物。热解温度低于550 ℃时,形貌以短棒状为主;超过550 ℃后,棒状颗粒减少,类球形颗粒增加。
4)在N2-H2O 气氛下,氧氯化锆热解产物形貌主要以棒状为主,粒度较为均匀,无明显孔洞缺陷;在O2气氛下,除棒状颗粒外,还存在一些不规则片状颗粒。

