Li4SiO4基CO2吸附材料研究进展与趋势
胡希璇,潘 登,薛天山,黄 亮,王 强
(1.北京林业大学 环境科学与工程学院,北京 100083;2.武汉凯迪水务有限公司,湖北 武汉 430000;3.中国环境科学研究院 大气环境研究所,北京 100012)
0 引 言
自工业革命以来,空气中温室气体日益增加,温室效应加剧,危害人类健康[1-2]。其中CO2被认为是最主要的温室气体,随着水泥、钢铁和燃煤电厂等工业的快速发展,人为源CO2排放量快速增加,导致全球气候变化[3]。为降低气候变暖带来的生态风险,控制大气中CO2含量是首要研究课题。在全球CO2排放中,能源消费排放量占80%以上[4],考虑到清洁能源代替化石资源需要时间,同时部分行业(如水泥、航空等)几乎无法从能源结构调整上实现CO2净零排放,在全球碳中和背景下,世界能源组织(IEA)称CCUS是不可或缺的技术[5-7]。不论CO2利用还是封存,捕集都是必要前提,因此,工业源CO2捕集受到重视。目前,唯一被应用于工业的CO2捕集技术是液胺吸收法,该工艺利用有机胺溶液吸收工业尾气中的CO2经加热完成CO2脱附,实现气体分离。但由于有机胺易挥发,吸收液在使用过程中不断损耗,且胺溶液具有较强的腐蚀性,会造成设备结垢等一系列问题。另一种CO2捕集技术——膜分离法在CO2捕集领域也有较广阔的应用前景,但CO2分离膜成本较高,且稳定性和选择性有待进一步提升,目前处于基础研究阶段[8-10]。相比前2种方法,固体吸附法由于吸附剂种类多样,不同固体材料可适配各类CO2捕集工况,具有较宽的应用温度窗口,是唯一适用于高温CO2捕集的技术方案。同时固体吸附材料成本相对较低、且其循环使用过程中不会出现材料大量损失的现象,第2代低能耗固体吸附剂的开发成为研究热点,固体吸附材料在吸附增强型产氢工艺等中高温反应中也表现出巨大的应用潜力。
对于甲烷蒸汽重整产氢工艺,反应温度在600 ℃ 以上,若在反应工况下对产生的CO2直接高温吸附,可减少CO2排放,避免降温捕集过程带来的能量消耗,同时还能推动反应平衡右移,提高H2产率,该反应成功的关键是开发合适的高温CO2捕集材料。传统CO2吸附材料,如多孔碳、沸石、MOFs等,对CO2捕集主要基于物理吸附,吸附量随温度升高而降低,应用温度一般小于100 ℃。对于高温捕集,吸附材料一般通过与CO2发生化学反应实现对其固定。目前广泛关注的高温CO2吸附剂主要包括CaO[11]、碱金属硅酸盐[12]、碱金属锆酸盐[13]、碱金属钛酸盐[14-15]等。其中CaO具有成本低、来源广泛和理论吸附量高等优点,但CO2吸脱附循环中吸附容量衰减严重是最大问题[16-17]。这是由于CaO的塔曼温度较低,在高温中易发生烧结导致吸附剂颗粒变大,随CaO吸附CO2反应的进行,材料表面形成的产物层过厚导致CO2扩散困难,吸附反应不完全。目前通过掺杂等手段引入惰性分隔材料可减轻CaO烧结现象[18-20],但在较高吸附温度下,CaO吸附材料还存在失活问题,这也是其在商业应用中面临的巨大挑战之一。碱性陶瓷是另一类高温CO2吸附材料,具有吸附容量高、吸附速率快、循环稳定性较好等优点,其中Li2ZrO3和Li4SiO4是目前主要的碱性陶瓷吸附剂。21世纪初期Li2ZrO3引起关注,关于碱金属元素掺杂[21-22]、Li原子替代[23-25]等改性工作研究较多[26-27],但近几年,这种吸附剂研究热度有所下降[28]。相比之下,Li4SiO4基吸附材料具有高吸附容量(理论吸附容量为36.67%)、较高热稳定性、更快吸脱附动力学和较低再生温度[29-31],使其备受关注。虽然与Li2ZrO3相比,Li4SiO4成本较低,但仍存在许多问题[32-34],如对低浓度CO2吸附能力较差、吸附活性有待进一步提升、存在烧结问题等。同时,锂电池行业的快速发展导致Li4SiO4生产成本增加,因此原料价格也是Li4SiO4面向工业应用中必要的考虑因素。
为解决上述问题,推动Li4SiO4基CO2吸附材料的工业化应用,关于Li4SiO4材料合成、改性、成型、机理解析等研究工作较多。笔者总结了近3 a Li4SiO4基CO2吸附材料的最新研究进展,综述了Li4SiO4基CO2吸附材料在吸附机理、制备方法、改性方案和成型及应用情况等,助力Li4SiO4材料后续工业化应用。
1 Li4SiO4吸附CO2机理研究
Li4SiO4对CO2的捕集通过化学反应实现,一般认为CO2与Li4SiO4的反应主要分为快速吸附和缓慢扩散2个阶段,分别受表面化学反应和扩散动力学控制[34-35]。首先,CO2与Li4SiO4吸附剂在表面发生反应形成产物壳层,产物壳层可能是由Li2CO3和Li2SiO3混合组成的单壳层结构,或由内到外依次为未反应的Li4SiO4、Li2SiO3壳层和Li2CO3壳层组成的双壳层结构,如图1所示[6]。表面吸附反应结束后,反应进入扩散控制阶段,此时,CO2、Li+和O2-的扩散成为吸附过程的决定因素[36]。ZHANG等[37]使用密度泛函理论(DFT)对Li4SiO4吸附CO2过程进行模拟,通过计算吸附能和模型结构的变化确定了CO2在Li4SiO4上的吸附机理为化学吸附,这与CO2与Li4SiO4形成Li2CO3壳层的试验研究一致[38],反应过程[39]为
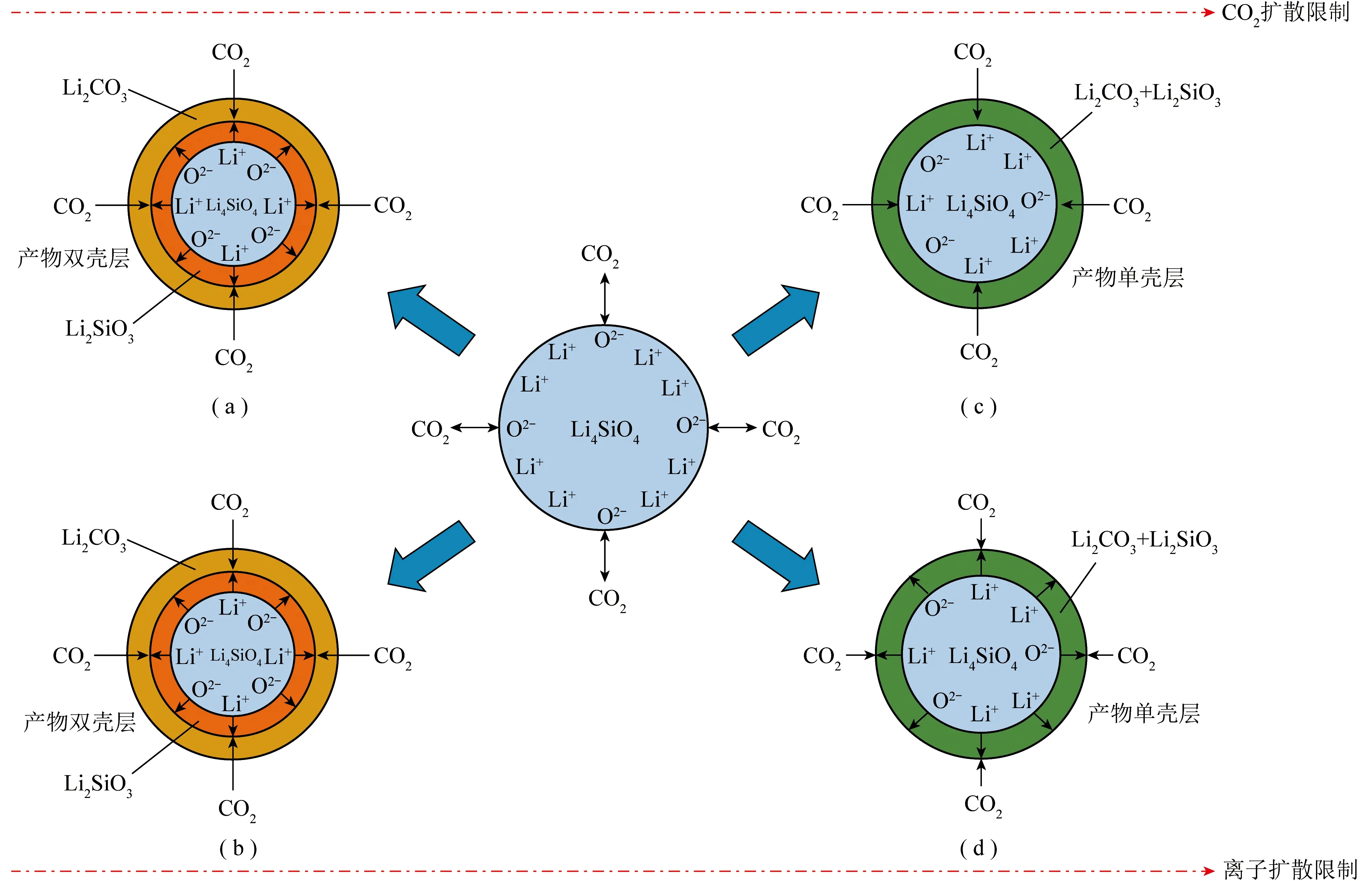
图1 Li4SiO4吸附剂的不同吸附模型[6]Fig.1 Different adsorption models on Li4SiO4 sorbents[6]

(1)
通过分析Li4SiO4吸附动力学模型更有利于理解Li4SiO4捕获CO2的反应机理,为吸附剂和吸附环路系统的设计提供依据和指导[40-41]。为解析Li4SiO4吸附CO2的化学吸附过程和扩散控制过程,PELTZER等[42]使用双指数模型对Li4SiO4吸附曲线进行拟合,双指数模型是一种动力学模型,能准确反映吸附反应中发生的2种过程,其表达式为
y=Aexp (-k1t) +Bexp(-k2t)+C。
(2)
其中,y为被吸附CO2的质量分数;t为吸附时间,s;k1、k2分别为Li4SiO4吸附过程和扩散过程的速率常数,s-1;指前因子A、B为2个阶段的过程控制系数;C为Li4SiO4材料的最大吸附量。PELTZER等[42]研究发现化学吸附阶段的速率常数k1比扩散控制阶段的速率常数k2高出一个数量级,且二者都随吸附温度的增加而变大,但k1始终远大于k2。这说明Li4SiO4吸附CO2过程的速率由CO2扩散决定,吸附温度的升高有利于CO2向Li4SiO4内部扩散,但扩散过程仍是该材料吸附过程的决速步骤[13,43]。而RODRGUEZ-MOSQUEDA等[44]和NAMBO等[45]认为Li4SiO4吸附CO2的扩散过程是离子向外扩散的过程而非CO2向内扩散。通过改变CO2流量分析其对吸附过程的影响,并使用双指数模型对该吸附过程进行拟合,证明了离子扩散过程是材料吸附过程的决速步骤,扩散阶段的吸附速率与CO2流量无关。
2 Li4SiO4基吸附剂制备方法
虽然对于Li4SiO4吸附CO2过程的决速步骤是CO2扩散还是离子扩散存在争议,但普遍认为通过调控Li4SiO4材料的粒径结构有助于提高其CO2吸附活性。这是因为Li4SiO4材料通常结构致密,颗粒尺寸较大,导致Li4SiO4内部难以与CO2反应,影响材料的吸附活性。较大的颗粒还会导致Li4SiO4吸附反应中形成过厚的碳酸盐壳层,从而影响CO2向内部扩散(图2)[34]。

图2 CO2在Li4SiO4上吸附/解吸过程的双壳机制[34]Fig.2 Double-shell mechanism for the CO2 sorption/desorption process on Li4SiO4[34]
此外,Li4SiO4材料还面临烧结问题,易造成其CO2吸附活性随吸脱附循环的进行而持续降低。为解决上述问题,可选用合适的制备方法,调控合成Li4SiO4材料颗粒大小及孔道结构。目前已有多种合成方案,包括固相法[46-47]、溶胶凝胶法[39,48]、沉淀法[49-50]、溶液等离子体法[45]、喷雾干燥技术[51]和燃烧法[52]等被用于Li4SiO4的制备。
2.1 固相法制备Li4SiO4基吸附剂
固相法是一种将Li源和Si源机械混合并经过高温煅烧制备Li4SiO4基吸附剂的方案,具有生产率高、成本低、操作简单等优点,是一种最常见的Li4SiO4合成技术,所制备吸附剂的物理化学特性主要由Li源和Si源的选用、反应温度、反应时间以及混合均匀程度决定。近年来,关于固体法制备Li4SiO4的研究有很多,BELGAMWAR等[46]通过优化Li源选择、合成温度和煅烧时间等,发现Li∶Si物质的量比为4.66∶1.00时,通过物理混合LiNO3和树枝纤维状纳米硅,一般情况下Li∶Si理论物质的量比应为4∶1,但为补偿Li在煅烧过程中的升华损失,Li源通常会被过量添加。研究发现在空气中、650 ℃下热处理6 h合成的Li4SiO4纳米片具有最高的CO2吸附活性和较快的CO2吸附动力学,这是由于Li4SiO4纳米片本身的特殊结构,使CO2高效扩散并与Li位点发生相互作用,最优吸附剂的CO2捕集能力接近Li4SiO4吸附理论值。吸脱附循环过程中,Li4SiO4纳米片既未形成碳酸盐外壳,也未出现烧结现象,循环稳定性优异。YANG等[47]以Li2CO3和SiO2为前驱体,采用传统固相法合成了Li4SiO4材料,并在此基础上通过两步法对其进行丙酸酸化和Na掺杂(图3)。结果表明,2种改性方法均有助于提高Li4SiO4吸附剂的性能。研究还发现丙酸酸化主要改善了吸附剂的孔隙结构,扩大了吸附剂的比表面积。而掺杂的Na2CO3可与吸附产物Li2CO3组成共晶熔融态软壳,CO2更易通过液态壳层,从而有助于提升材料的CO2吸附量。丙酸酸化和Na掺杂改性的Li4SiO4吸附剂经多次CO2吸脱附循环后,转化率能保持在87%以上。在传统固相法的基础上,多使用球磨法对Li源和Si源混合。相比人为研磨,该方法具有耗时少、人为干扰小和混合均匀度高等优点。SUPRIYA等[53]采用行星球磨机对LiOH和SiO2进行机械混合,并于700 ℃下焙烧制备了Li4SiO4。经高频率球磨合成的Li4SiO4吸附剂颗粒近似为球形,对CO2的吸附容量可达30.5%,循环10次后仍能保持稳定的吸附能力。分析该吸附剂的形貌和比表面积发现材料表面呈致密的片状形态,具有较小的粒径和丰富的孔道结构。吸附剂与CO2反应后,其表面微观形貌由片状变为长方体,而CO2解吸后,Li4SiO4吸附剂又恢复为原有的片状结构。通过对吸附前后和再生后的材料进行XRD分析发现材料的吸附态和解吸态之间可以完全转化,这种可逆的变化特征使得该材料表现出良好的循环稳定性。
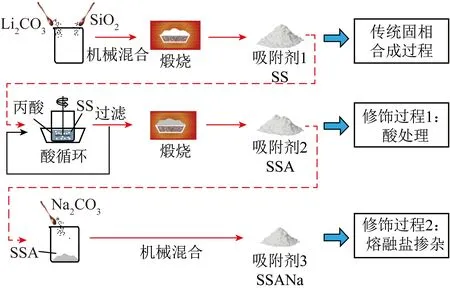
图3 两步法改性Li4SiO4吸附剂的制备工艺示意[47]Fig.3 Schematic sketch of the preparation process of the two-step modified Li4SiO4 absorbents[47]
2.2 溶胶凝胶法制备Li4SiO4基吸附剂
Li4SiO4的溶胶凝胶法合成通常包括3个步骤(图4)[39]:① 将Li和Si的前驱体(在液相中)均匀混合,通过水解和缩合化学反应形成稳定的透明溶胶体系(通常是含有高度化学活性成分的化合物);② 凝胶化颗粒缓慢聚合形成三维网状结构的凝胶,且凝胶网络中充满失去流动性的溶剂;③ 通过烘干、煅烧凝胶,最终得到Li4SiO4材料。与固相法相比,溶胶凝胶法中Si源和Li源混合更均匀,有利于形成均一的空间网络结构,从而使Li4SiO4合成反应更易进行,温度通常较低。ZUBBRI等[48]以LiNO3和正硅酸乙酯(TEOS)为前驱体,采用溶胶凝胶法合成Li4SiO4,对Li、Si物质的量比、煅烧温度和煅烧时间等参数进行优化,并对优选材料进行多次CO2循环吸脱附试验。研究发现700 ℃为Li4SiO4材料的最佳合成温度,最佳煅烧时间为5 h。所合成材料在700 ℃时的CO2吸附量可达理论吸附值的93%。但吸附剂的循环稳定性较差,10次循环后,CO2吸附能力下降16.2%。WANG等[54]以气相法制备的SiO2、LiOH和柠檬酸为原料,采用溶胶凝胶法合成了Li4SiO4吸附剂,研究了金属元素掺杂对Li4SiO4的影响。通过对该吸附材料进行结构分析和性能测试,发现Ce、Cr和K掺杂后的Li4SiO4颗粒变小,比表面积和孔径均有所提高,通过动力学模拟发现其吸附量和吸附速率相对于未掺杂的Li4SiO4有极大提升,尤其以Ce掺杂表现最好,其速率常数较纯Li4SiO4提升了1倍。
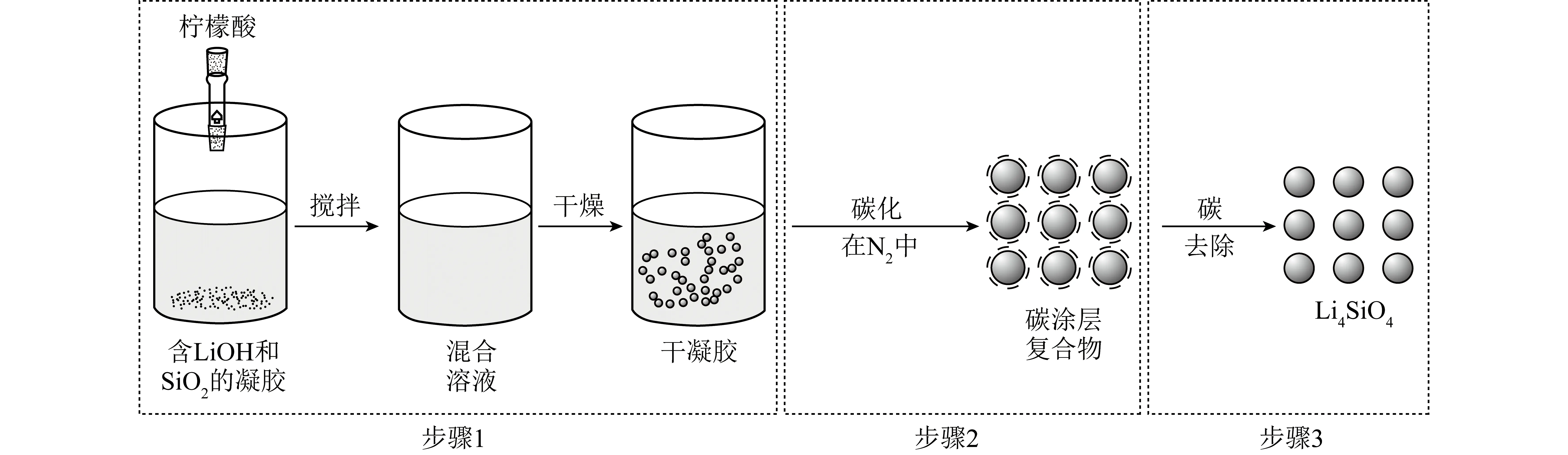
图4 柠檬酸基溶胶凝胶法结合碳包覆法合成示意[39]Fig.4 Schematic sketch of citric acid sol-gel method combined with carbon coating method[39]
2.3 沉淀法制备Li4SiO4吸附剂
沉淀法是一种将含有Si源与Li源的溶液混合,所得悬浮液在高温下搅拌、干燥,最后煅烧得到Li4SiO4吸附剂的制备方法。由于制备过程中各组分分散在液体中,与固相法相比,沉淀法合成过程中Si源和Li源混合相对均匀,通过该方法获得的Li4SiO4粒径可低至3 μm,仅为固相法制备材料的1/10[55],因此沉淀法合成的Li4SiO4颗粒通常具有更强的吸附能力和更快的吸附速率[49]。SHAN等[49-50]以硅藻土为Si前驱体,采用浸渍沉淀法合成了Li4SiO4基吸附剂,并与以硅藻土和SiO2为原料使用固相法合成的Li4SiO4吸附剂进行CO2吸附性能比较。吸附温度700 ℃、吸附时间100 min时,通过浸渍沉淀法合成的Li4SiO4的CO2最大吸附量达到29.89%,高于固相法合成的以SiO2为Si源合成的Li4SiO4样品(11.34%)和以硅藻土为Si源合成的Li4SiO4样品(24.23%)。此外,通过浸渍沉淀法合成的材料吸附15 min后,其吸附容量可达到最大吸附量的96%,且经过15次循环后,CO2吸附量仅下降了1.05%,材料具有快速的吸附速率和良好的循环稳定性。YANG等[52]利用SiO2溶胶和2种不同的有机Li(无水醋酸锂和乳酸锂),通过浸渍沉淀法制备了Li4SiO4。该吸附剂表面粗糙,有助于增加其CO2吸附活性点位数量,从而使材料表现出更高的CO2捕集容量。测试该材料的CO2循环吸脱附性能发现,CO2体积分数15%时,其吸附量约为固相法制备Li4SiO4的8倍,且在40次循环吸脱附测试中,该材料的CO2吸附量持续增加(图5),这主要是由于CO2脱附过程促进了Li4SiO4材料形成微孔。

图5 Li4SiO4吸附剂合成工艺及吸附性能[52]Fig.5 Synthesis process and adsorption performance of Li4SiO4 adsorbent[52]
2.4 其他方法制备Li4SiO4吸附剂
除固相法、溶胶凝胶法、沉淀法外,近年来,其他新的合成方法陆续被报道,如溶剂等离子体法、喷雾干燥法和燃烧法等。其中溶剂等离子体法仅需1 min即可合成Li4SiO4吸附剂,大幅缩短合成时间,这是由于等离子体火焰中产生的自由基和离子对Li4SiO4相的快速成核和生长动力学起关键作用;喷雾干燥法可通过减少Li4SiO4前驱体烘干过程所用时间,达到降低能耗的要求;而燃烧法可通过降低煅烧温度减少Li源损失以制备纯Li4SiO4相,提高活性组分含量。NAMBO等[45]对混合后的吸附剂前驱体进行等离子体氧化成功合成了Li4SiO4纳米线(图6),纳米线吸附剂比表面积达10.2 m2/g,平均孔径为11.5 nm,其CO2吸附量在3 min内即可达到25%,CO2吸附速率非常快,经160 min吸附,其饱和吸附量可达35%。然而,这种Li4SiO4纳米线的再生性能较差,仅经过1个吸脱附循环后,其CO2吸附容量便从33%降至25%。对于大多数Li4SiO4合成方法,干燥步骤通常在烘箱或水/油浴中进行,消耗能量且过程缓慢。为实现快速高效制备,HU等[51]采用喷雾干燥技术对Li4SiO4前驱体进行雾化并与热空气接触后被迅速干燥,从而节省了传统合成方法中烘干过程所需时间。该吸附剂具有CO2吸附量高和循环稳定性好等特点,在体积分数15%的CO2气氛下循环吸脱附50次后,CO2吸附量仅从27.5%降至24.8%,这主要归功于其细小的粒径、较高的比表面积、大孔容和丰富的孔隙率。此外,RAO等[56]通过溶液燃烧法以甘氨酸作为燃料,硅酸和LiNO3为前体合成了Li4SiO4纳米粒子。燃料氧化剂比例对燃烧过程和合成演化影响较大,通过对其进行调控,合成温度700 ℃时制备出纯度较高的Li4SiO4,平均粒径为72 nm,比表面积为26.7 m2/g,700 ℃时其CO2吸收容量可达30.7%。但溶液燃烧法制备的Li4SiO4粉末更易发生烧结,燃烧至900 ℃时,线性收缩率为11.1%,而固相法制备的Li4SiO4粉末线性收缩率为4.67%,说明溶液燃烧法更易导致材料在吸脱附循环过程中的球团化。

图6 溶剂等离子体合成方法示意[45]Fig.6 Schematic of the solvo-plasma synthesis method[45]
合成路线对Li4SiO4吸附剂的粒径、孔隙率、比表面积等特性有重要影响,而这些特性又影响吸附剂的CO2吸附性能。从合成温度来看,生产Li4SiO4通常需要较高的煅烧温度,这意味着材料生产能耗高。此外,高温煅烧易导致Li源损失和材料孔道结构坍塌。而溶胶凝胶法、沉淀法等能保证前驱体中Li和Si分布更均匀,从而降低Li4SiO4材料合成温度、缩短合成时间。从CO2吸附容量看,溶胶凝胶法、沉淀法和燃烧法所得的Li4SiO4吸附剂粒径相对较低,因此CO2吸附性能普遍较好(通常在30%左右)。但考虑经济效益,固相反应法相比其他工艺,材料生产过程简单,合成成本更低,仍是合成Li4SiO4吸附剂的主要途径。但传统固相法衍生的Li4SiO4吸附剂的CO2吸附性能还有待提升。因此,综合考虑生产成本、合成材料的CO2捕集活性、循环稳定性等因素,针对现有方法进行改进或开发新型低成本合成技术,高效生产Li4SiO4吸附材料,对推动固体吸附剂捕集CO2的工业应用具有重要意义。
3 Li4SiO4基吸附剂的改性研究
虽然优化制备方法可合成具有较高比表面积和孔隙率的Li4SiO4吸附剂,但由于所制备的吸附剂对吸附温度及CO2浓度要求较高,仍未充分发挥其理论潜力。考虑到Li4SiO4基吸附剂可在火电厂烟气中及一些可逆反应(如水煤气变换反应和蒸汽甲烷重整)中原位去除CO2,其温度通常控制在450~700 ℃,CO2体积分数在4%~20%[57-58]。在相对较低的吸附温度和CO2浓度下,Li4SiO4吸附剂的吸附活性、吸脱附速率和循环稳定性都需进一步提高[57,59-61]。因此研究人员使用不同制备方法合成Li4SiO4吸附剂的过程中对材料进行改性,主要包括改进吸附剂的微观结构、优化吸附剂前驱体、掺杂金属离子和负载熔融盐等手段。
3.1 微观结构优化
固体Li4SiO4吸附剂对CO2捕集是一种气固反应,固体材料的粒径、表面结构和孔隙率等对其吸附活性影响很大,大多研究通过合成Li4SiO4纳米材料提高其CO2捕获容量[45,62-64],这是由于纳米颗粒中CO2和离子等扩散路径比传统微米级团聚体短,缓解了Li4SiO4基吸附剂在扩散控制阶段动力学受限问题。此外,Li4SiO4纳米结构粉体在吸脱附循环中也表现出更好的可逆吸附活性,更适用于实际工程中CO2捕获。而WANG等[65]使用葡萄糖对吸附剂前驱体进行轻微燃烧以改性吸附剂结构。首先将吸附剂前驱体和葡萄糖混合并在500 ℃和纯N2气氛下进行热解,最后在700 ℃空气中煅烧4 h,合成了一种具有明显高孔隙状纳米团簇(50~100 nm)形貌的Li4SiO4吸附剂,有利于CO2在材料表面的快速吸附(图7,透明孔代表大孔)。吸附过程中,Li2CO3层上存在一种纳米级的Li2SiO3覆盖层,这种特殊的结构可加速CO2迁移和熔融层上Li+和O2+的扩散,增强了吸附材料对CO2的吸附速率。YANG等[47]使用丙酸处理合成的Li4SiO4,发现酸化过程可显著减小吸附剂晶粒尺寸,促进其孔隙形成并增大了材料比表面积。这是由于酸化过程中,丙酸填充了Li4SiO4吸收剂本身存在的裂缝或孔隙,进而在煅烧过程中,丙酸迅速分解释放出丰富的气体,气体压力冲击使吸附剂形成大量微孔,这种多孔材料更有利于CO2吸附反应的发生。LI等[66]发现经木醋酸处理后的Li4SiO4表面呈波纹状,具有较高的比表面积,这有利于其对CO2的吸附。通过吸附性能测试发现,处理后的Li4SiO4不仅具有相对较高的吸附容量,还具有优良的循环稳定性。而YANG等[67]为降低改性成本,向Li4SiO4吸附剂中加入等量水并通过球磨机进行机械化学活化,所制备吸附剂的活性明显提升,这是由于该活化过程产生了层状纳米LiOH颗粒,有效增大了吸附剂的比表面积和孔隙率。一般认为较大的比表面积有利于Li4SiO4基吸附材料的吸附动力学,但GRASSO等[68]发现室温下比表面积较大的Li4SiO4会出现老化现象,空气中水蒸气会促使比表面积较大的Li4SiO4活化生成Li2O和Li2SiO3,随后Li2O出现羟基化,形成的LiOH和LiOH·H2O会覆盖在Li4SiO4表面,降低Li4SiO4吸附量,但老化后的Li4SiO4吸附容量可通过高温煅烧恢复。

图7 Li4SiO4双壳反应机制示意[65]Fig.7 Schematic of double-shell mechanism occurred in Li4SiO4[65]
3.2 Si源和Li源的选择
一般来说,含Li盐类都可作为Li源用于合成Li4SiO4吸附剂,目前利用较多的主要有LiNO3、LiOH、Li2CO3及有机Li源等。FANG等[69]分析了无机Li源对Li4SiO4吸附剂结构和CO2吸附/解吸性能的影响,发现以LiNO3为原料,在较低温度下合成可以减缓材料烧结,提高其比表面积。合成材料的CO2初始吸附量高于Li2CO3制备的Li4SiO4吸附剂。经过15次循环后,LiNO3制备的Li4SiO4表现出优异的循环稳定性,而LiOH合成的Li4SiO4循环后吸附量下降了80%。这是因为LiNO3衍生Li4SiO4表现出较高的比表面积和孔隙率,且其比表面积会随循环继续增加。虽然LiOH制备的Li4SiO4孔道结构丰富,但其在吸脱附过程中出现了烧结问题,导致循环吸附活性下降。而由Li2CO3合成的Li4SiO4材料比表面积较低,在CO2吸附/解吸过程中活性较低,循环前后其形貌和表面积几乎没有变化。除无机Li源,有机Li盐被认为更有利于制备具有高孔隙率的Li4SiO4颗粒,HU等[70-71]研究了多种有机Li源制备的Li4SiO4吸附剂,发现较传统吸附剂,有机Li制备的Li4SiO4在低CO2浓度下的循环吸附性能更优,其中由Li2C2O4合成的Li4SiO4吸附剂在CO2体积分数15%、经100个循环后,其吸附量仍达27.14%。为降低Li源成本,TONG等[72]开辟了一条从废弃锂电池中获得Li源的路线,并成功合成了Li4SiO4。对比可知其合成成本仅为Li4SiO4常规合成成本的1/20~1/3。通过吸脱附循环测试发现,CO2体积分数15%、经42个循环后,该材料的吸附容量稳定在19%左右。由于可选Li原料相对有限,与探索Li源相比,研究人员更关注选用不同Si源以直接调控吸附剂颗粒的形貌。在合成过程中SiO2将形成Li4SiO4骨架,对其孔隙结构影响更大,直接决定了材料的吸附活性。由于分子筛具有丰富的孔隙率和较高的比表面积,与普通SiO2粉末相比,与Li+接触更充分,有望制备出更高活性的Li4SiO4吸附剂[73]。PAN等[74]以SBA-15为原料成功合成了Li4SiO4。优化后,材料的CO2捕获能力高达36.3%,远高于传统SiO2合成的Li4SiO4,达到其理论吸附量的99%。该材料也表现出较高的循环稳定性,15次循环后其容量损失仅为1%。SUPRIYA等[75]研究了多种有机Si合成的Li4SiO4材料,发现甲基三甲氧基硅烷所合成的Li4SiO4在10个CO2吸脱附循环中,吸附能力保持在31%,说明可水解的脂肪族有机Si是较好的Li4SiO4吸附剂制备前驱体。随着工业界对CO2捕集技术需求日益增加,吸附剂合成成本受到关注,天然含硅矿物[76-78]和含硅废料[79-80]开始作为合成原料。天然矿物中Si质量分数在45%~70%,Si含量决定了Li4SiO4基吸附剂纯度,从而影响其吸附活性。此外,矿石中还存在杂质组分,可能造成活性组分含量降低,但也有部分杂质元素能促进材料的CO2吸附过程[76]。NI等[77]选用膨胀珍珠岩作为Si源制备了Li4SiO4材料,极大提升了其在500~650 ℃温度窗口的吸附活性。这是由于与SiO2合成的Li4SiO4相比,膨胀珍珠岩制备的吸附剂颗粒尺寸更小、表面更粗糙,这主要基于膨胀珍珠岩的多孔结构。此外,该吸附剂还表现出了良好的CO2吸脱附稳定性,这可能得益于矿石中惰性组分的支撑作用。YANG等[81]发现以天然硅灰石为原料合成Li4SiO4基吸附剂,在体积分数15%的CO2气氛下吸脱附循环过程中,吸附容量可达17.5%,证明天然硅灰石中存在的CaO在吸附反应中可与Li2SiO3发生作用生成Li2CaSiO4,可促进Li4SiO4吸附反应,同样,Li4SiO4也可与CaCO3生成Li2CaSiO4以促进CaO吸附反应。但该材料循环稳定性较差,主要是由于吸附剂中CaO的存在易导致材料发生烧结。LI等[82]以典型农林废弃物甘蔗渣为Si源,制备了具有优异CO2吸附性能的Li4SiO4基吸附剂。认为甘蔗渣灰中杂质元素的存在会导致吸附剂制备过程中产生复杂的副反应,从而降低吸附剂的吸附性能。为克服这种负面影响,首先对甘蔗渣进行酸洗,去除样品中的金属离子(Ca2+、Fe3+等)及水溶性杂质(K、P、S等)。经酸洗后甘蔗渣合成的吸附剂最大吸附量约32%,且循环10次以上后仍能保持良好的吸附性能。ALCNTAR-VZQUEZ等[80]使用钢铁渣为原料合成Li4SiO4基吸附剂。研究发现在高温和低CO2浓度条件下,该吸附剂相比纯Li4SiO4具有更高的吸附容量、更快的吸附速率和更高的吸脱附循环稳定性。此外,LI等[79]使用煤渣合成的Li4SiO4吸附剂在650 ℃,CO2体积分数100%吸附条件下吸附容量为36.3%,但材料循环稳定性较差。
3.3 金属离子掺杂
研究发现Li4SiO4合成过程中使用一些异质元素替换部分Li+,在降低材料合成成本的同时还获得了比纯Li4SiO4具有更好CO2吸附性能的Li4SiO4基材料。HIRAI等[83]对Li3NaSiO4的CO2吸附性能进行评价,发现Li3NaSiO4对CO2的吸附和脱附反应可逆,即使在较低CO2浓度下,Li3NaSiO4仍能进行较快的表面反应,且其反应速率高于Li4SiO4。KWON等[84]也得到了相似结论。除Na掺杂,K掺杂Li4SiO4已被证明是提升材料CO2吸附活性的有效手段。SALAZAR HOYOS等[85]发现K掺杂后吸附剂的吸附能力对温度的依赖性降低,在500 ℃、CO2体积分数50%气氛下其吸附容量远高于未掺杂的Li4SiO4吸附剂,吸附量相差10%左右。研究发现K+会替换Li4SiO4中部分Li+生成KLi3SiO4,该物相的存在有利于提高吸附剂的吸附速率[54,85-87]。研究发现在Li4SiO4吸附剂中添加某些金属杂质元素可缓解材料在吸附/解吸循环过程中出现的烧结问题[88]。因此,为了提高Li4SiO4在高温条件下的稳定性,加入热化学稳定的第二相是解决方案之一。ZHANG等[37]通过DFT计算对B、Al和Ga的掺杂,并研究其在Li4SiO4表面的促进作用,发现B、Al和Ga的掺杂对Li4SiO4与CO2相互作用的影响主要取决于被替换元素的类型。B、Al和Ga被负载在Li4SiO4晶格表面或替换Li进入晶格时,元素掺杂抑制了材料对CO2的吸附过程,促进了吸附后材料的解吸,而当Si作为被替换原子时则显现相反机制。此外,Al元素掺杂还可提高Li4SiO4吸附剂的循环稳定性[89]。而LIU等[90]持相反观点,使用含有Ti4+和Al3+的硅源制备Li4SiO4基吸附剂时,发现该Li4SiO4基吸附剂的吸附速率高于纯Li4SiO4吸附剂,研究认为Li4SiO4样品中均匀分布的Ti4+和Al3+会取代Li4SiO4晶格中的Li+,增强Li+和O2-的扩散,从而促进晶粒外表面与CO2的反应(图8)。YANG等[91]采用石墨模压法一步制备了掺Nd的Li4SiO4吸附剂颗粒(图9),结果表明,Nd掺杂对制备的球团具有三重效应,包括合成Li4SiO4球团的煅烧过程中,Nd(NO3)3掺杂剂分解释放出大量气体,会在球团内部形成新的孔隙和缝隙,有利于增大球团的孔隙率和CO2吸附能力;掺Nd后的大部分Li4SiO4颗粒之间形成了惰性Nd2O3骨架,可有效缓解Li4SiO4球团在高温再生过程中的烧结现象,从而提高了球团的循环稳定性;少量Nd可转化为纳米级的Nd颗粒覆盖在Li4SiO4晶格表面,并引起晶格压缩和缺陷,提高了吸附剂球团对CO2的吸附性能。上述作用使掺杂Nd后的Li4SiO4具有较高的稳定容量,CO2体积分数为15%时,经过20次吸附循环后的吸附剂吸附容量可达20%,且掺杂后的吸附剂转化率提高了13.63%。GONG等[92]通过试验证明Al的掺杂替换了Li4SiO4中部分Si。此过程增加了Li4SiO4的晶格畸变,从而降低了晶粒生长的活化能,明显提高了Li4SiO4的抗压强度和导热系数。WANG等[54]比较了K、Mg、Cr、Ce等金属元素掺杂对Li4SiO4的影响。XRD结果表明,在相同条件下,Ce比其他金属元素更难掺杂到Li4SiO4晶格中,但Ce的掺杂更有效抑制了晶体聚集。Ce掺杂后的Li4SiO4吸附解吸过程更快,吸附容量更高,这主要是由于CeO2在Li4SiO4吸附剂中阻止了颗粒烧结,因而Ce-Li4SiO4在10次吸附/解吸循环后仍保持良好的吸附性能。但CeO2作为一种惰性添加剂,不参与CO2吸附,CeO2添加量过多时,会导致材料吸收能力下降。WANG等[93]使用NaBr对Li4SiO4吸附剂进行修饰,发现Na+和Br-均可被掺杂到Li4SiO4结构中。而Br-的掺杂使Li4SiO4吸附剂颗粒具有更小的尺寸及更丰富的孔道结构,这些都有利于化学吸附,证明了非金属离子改性的可行性。
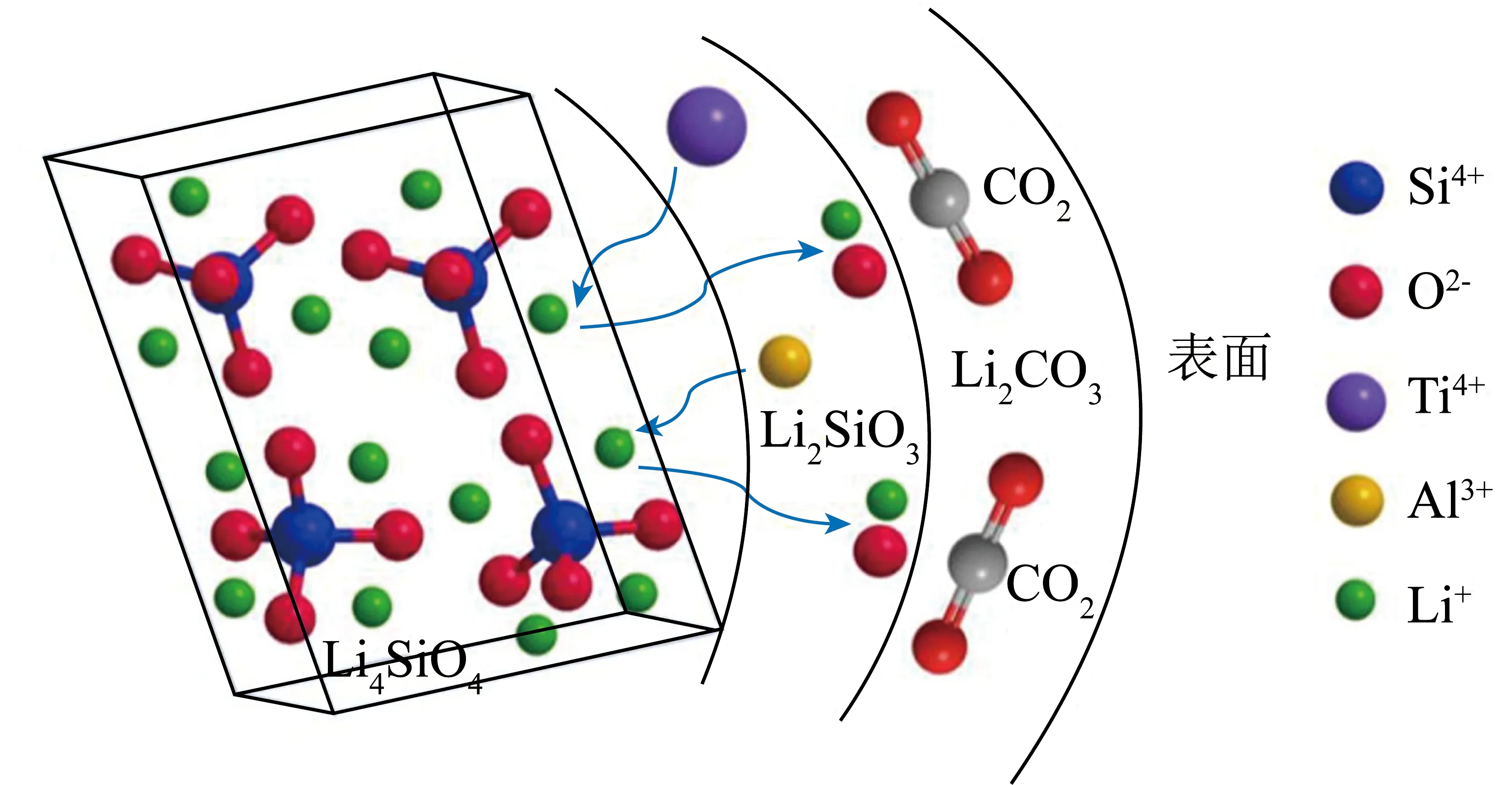
图8 金属掺杂后的Li4SiO4材料的吸附机理示意[90]Fig.8 Schematic of adsorption mechanism of metal doped Li4SiO4 material[90]
3.4 熔融盐负载

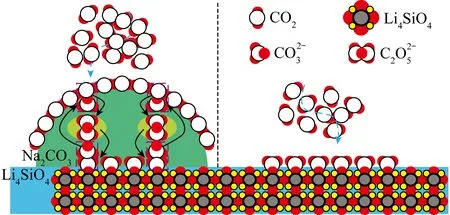
图10 有无Na2CO3负载对Li4SiO4不同CO2捕获过程示意[94]Fig.10 Schematic drawing of different CO2 capture processes by Li4SiO4 with or without Na2CO3 load[94]
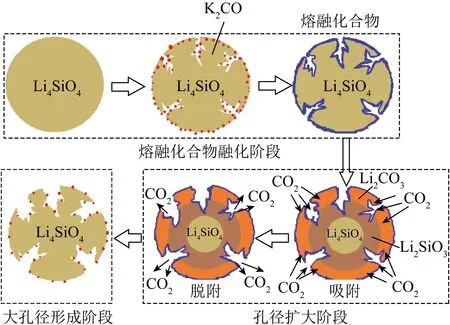
图11 K2CO3负载Li4SiO4吸附剂的孔核模型示意[96]Fig.11 Schematic of proposed pore-core model for K2CO3 loaded with Li4SiO4 sorbent[96]
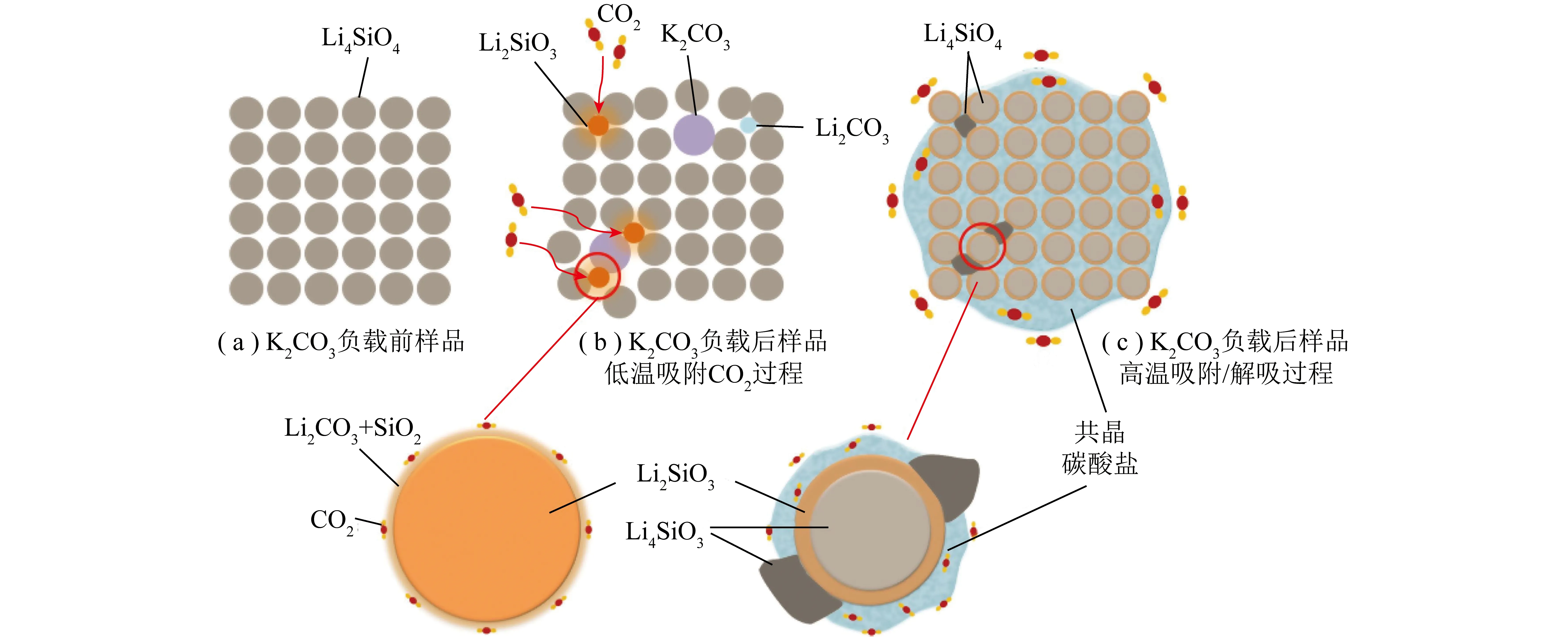
图12 负载K2CO3后的Li4SiO4吸附剂对CO2的吸附示意[97]Fig.12 Schematic of CO2 adsorption on K2CO3 loaded with Li4SiO4 sorbent[97]
目前低CO2浓度下的动力学限制是Li4SiO4吸附剂面临的主要问题。Li4SiO4吸附CO2的吸附速率由扩散控制,提高材料比表面积和孔隙率是解决该问题的有效途径。表面处理方法可改变吸附剂结构,进而提高材料吸附活性。Li4SiO4改性策略及最终循环捕集容量见表1,可知Li源和Si源作为参与合成Li4SiO4反应的主要物质,其性质直接影响吸附剂的粒径和微观结构,达到调控Li4SiO4的CO2吸附性能的目的。此外,通过调控材料吸附过程中表面生成的Li2CO3壳层也能提高CO2扩散速率,一般通过负载碳酸盐形成混合盐体系,使Li2CO3壳层形成熔融态混合盐,以增加Li4SiO4吸附活性。Li4SiO4材料的CO2吸附活性可通过多种方法改善,负载碱性碳酸盐最常见,但可能加剧循环设施结垢结渣等。
4 Li4SiO4基吸附剂的成型及应用
通过优化合成条件、改性等手段可以得到具有较高CO2吸附活性和循环稳定性的Li4SiO4材料,但是目前研究报道多集中于粉末吸附剂,而非成型材料实际应用中淘析、压降过大等问题。因此,Li4SiO4投入工业应用前,吸附剂的成型是关键步骤。常见的成型方法有机械挤压法、挤压滚圆法、涂覆法等,一般根据吸附工艺所需应用场景选用不同的造粒技术获得具有特定形貌的吸附材料。对于成型吸附剂,除了考虑其CO2吸附活性外,机械强度也是评价其性能的重要指标。Li4SiO4作为高温CO2吸附材料,还可以被用于吸附增强型产氢反应的CO2捕获分离[98],但缺少应用实例。因此,对于Li4SiO4在蒸汽重整制氢反应中的CO2捕集、放大试验等也是研究重点。
4.1 成型研究
机械挤压法是传统的吸附剂成型手段,有学者通过挤出机[99-100]和机械压机[101]生产出圆柱形Li4SiO4颗粒,但非球形颗粒在流化床中易磨损,造成吸附材料损失。对此,研究人员通常利用滚圆等手段制备球形Li4SiO4吸附剂,以契合流化床的应用。HU等[102]使用挤压滚圆法制备了Li4SiO4球团,该颗粒具有良好的机械强度,可以承受3 N挤压力。但挤压成型过程通常会造成材料被压实,吸附剂比表面积下降,导致其CO2吸附性能明显下降。为了解决该问题,在吸附剂造粒过程一般会加入造孔剂,以增加材料比表面积(表2)。NI等[77]和LI等[103]向合成的Li4SiO4基吸附剂球团中添加琼脂优化其孔道结构,造孔剂在高温煅烧过程中会产生大量气体使得球团产生丰富的孔隙结构,增大了比表面积,从而改善吸附剂球团的吸附性能,与未添加造孔剂的材料相比,吸附性能分别提升了3.65%和2.10%。MA等[104]利用聚乙烯作为造孔剂,使合成的Li4SiO4吸附剂球团形成了多孔的微观结构。与未使用造孔剂的材料相比,其吸附性能提升了19%。所制备颗粒材料的CO2吸附容量经4个循环后稳定在31%,同时具有一定的抗压强度和耐磨性。而HU等[105]使用低成本的稻壳作为成孔剂,研究发现稻壳成孔剂不仅能够改善Li4SiO4微球结构,稻壳中含有的碱性成分在吸附过程中还会与Li2CO3形成熔融相从而降低CO2扩散阻力,促进该吸附剂微球对CO2的吸附,其吸附量几乎是未使用造孔剂材料的2倍。但研究同时也发现高温燃烧后的稻壳灰会堵塞吸附剂微球的部分孔隙,从而降低了材料的比表面积。此外,YANG等[107]采用石墨成型法直接合成Li4SiO4吸附剂球团,所制备的吸附剂球团粒径比较均匀,在2.0~2.5 mm,吸附剂微球50次循环后的吸附容量达到22%,循环吸脱附2 000次后的吸附量损失仅为6.72%。YANG等[91]将合成、造粒和掺杂相结合,一步制备出高性能Nd掺杂的Li4SiO4基吸附剂球团。除了将Li4SiO4基吸附剂造粒外,SUBHA等[108]通过涂覆得到了以多孔碳板为载体支撑的成型Li4SiO4吸附剂。通过性能测试发现该成型吸附剂的吸附容量为21.4%,经8次循环后,吸附量不变。此外,该成型材料的CO2吸附速率提升至37.5 mg/(g·min)。
4.2 Li4SiO4吸附剂的应用
对于Li4SiO4高温CO2捕集应用,HU等[6]提出了Li4SiO4环路系统的概念(图13),该系统主要由一个吸附反应器和一个解吸反应器组成。待处理气体流经吸附反应器时,CO2组分与活性Li4SiO4吸附剂发生反应从而被固定。吸附后的材料(Li2CO3、Li2SiO3)被送入脱附反应器实现再生,而后被运回吸附反应器实现循环吸脱附。同时,在解吸反应器出口处可得到浓缩CO2,进一步用于运输和储存。值得注意的是,尽管上述过程可以在填料床反应器中通过变压吸脱附(PSA或VSA)实现材料循环利用[109],但目前多通过调控循环流化床反应器温度使吸附剂再生,称为变温吸附(TSA)。虽然Li4SiO4吸附剂并未投入实际CO2捕集应用,但越来越多的研究开始关注材料吸附CO2的工程能耗评测,为吸附剂的实际应用奠定理论基础。SALEH等[110]通过工程模拟评估了基于Li4SiO4的环路系统与天然气联合循环(NGCC)发电厂结合后的热集成,发现吸附材料的性能和再生温度对该应用路线的发电效率和能量损失影响较大。由塔曼温度与熔点成正比可知,Li2SiO3和Li2CO3塔曼温度低于Li4SiO4,而操作温度高于塔曼温度时,材料发生烧结,这说明Li2SiO3和Li2CO3相比Li4SiO4更易发生烧结。而解吸过程中,CO2的存在会阻碍解吸反应进行,加剧材料烧结情况,从而导致吸附剂在循环过程中CO2吸附量降低[66,111]。研究认为使用改性后的Li4SiO4吸附剂,即具有高活性且低再生温度的材料,可进一步降低该工程能耗。考虑到烟气中可能存在SO2、NOx、O2等气体,YUAN等[112]发现在有氧条件下,Li4SiO4吸附剂极易发生硫酸化。该反应会降低Li4SiO4基吸附剂的CO2捕获性能,因此CO2捕集装置应设置在烟气脱硫脱硝之后。

图13 基于Li4SiO4吸附剂的TSA再生循环CO2捕集过程示意[6]Fig.13 Schematic of the cyclic CO2 capture process based on Li4SiO4 sorbents by TSA regeneration[6]
吸附增强型产氢工艺通过将CO2捕集与蒸汽重整过程结合,使蒸汽重整反应的化学平衡向产氢方向进行[113]。QIAO等[114]利用农业废弃物稻壳作为Si源制备Li4SiO4基吸附剂,并将其应用于吸附增强型乙醇蒸汽重整过程中。通过建立固定床系统模型来评估系统能耗,研究发现添加Li4SiO4会降低重整能耗同时提高H2产率。温度600 ℃,蒸汽流速0.2 m/s,乙醇与水的物质的量比为1∶6时,该过程的H2产率可达99.54%。而WANG等[115]利用2个平行固定床反应器交替进行吸附增强型乙醇蒸汽重整反应,测试K改性的Li4SiO4基吸附剂在重整反应中的CO2捕集性能。研究发现前40 min,重整产物始终只有H2和CH4,此时产生的CO2被完全吸附,即使反应时间延长至400 min,重整生产的H2纯度仍保持在95%以上。DOMENICO等[116]发现相比CaO,使用Li4SiO4更有利于煤气化反应,Li4SiO4不仅可作为CO2吸附剂促进产氢,在煤气化反应中还存在催化效应,这与Li4SiO4吸附CO2后生成的Li2CO3有关。煤气化反应中,生成的Li2CO3在高温下被还原为Li,单质Li可作为催化剂降低气化反应的活化能。同时气化过程又可促进Li2CO3生成,加强催化反应。在吸附和催化作用的协同下,煤气化反应速率提高了10倍以上。此外,对CO2吸附材料进行捕集/催化转化一体化是其另一个应用方向,该过程可对CO2进行捕获随后转化为高附加值化学品。KIM等[117]以CaO为CO2吸附剂、Ni/MgO-Al2O3为催化剂,将2种材料按质量比1∶1混合作为集吸附催化一体的多功能材料,使用CH4在720 ℃下对吸附后材料再生,可在反应器中直接释放捕获的CO2,并将CO2还原成H2和CO。该系统中CO2转化率可达96.3%,经10个循环后转化率降至95.3%。ZHOU等[118]制备了2D层状Ni-MgO-Al2O3纳米片,用于集成CO2捕集和甲烷化。该过程共分为2步:第1步可以吸附CO2,第2步可在H2吹扫下转化为CH4。这一过程中,被吸附的CO2直接作为原料转化,可避免传统CCUS途径中解吸能耗。对于恒温吸脱附,长时间循环测试发现该过程几乎100%去除CO2,为传统TSA和PSA技术效率提升提供了解决方案。但对于Li4SiO4吸附剂,其在CO2原位转化方面研究较少,基于MgO、CaO等的捕集/催化转化技术可为Li4SiO4吸附剂的应用提供借鉴。
Li4SiO4吸附剂的成型是其工业化应用的前提,越来越多研究开始关注Li4SiO4吸附剂的造粒成型技术。对于成型颗粒,机械强度是重要指标,传统方法通过添加黏合剂提高颗粒的抗压强度,但黏合材料过量又会造成吸附剂CO2捕集性能下降。为提高成型材料的吸附活性,造孔剂常被用来改善颗粒的孔道结构,但会影响颗粒的机械强度。同时具有高吸附活性和高机械强度的球形Li4SiO4吸附剂制造技术仍有待开发。此外,为了考察Li4SiO4吸附剂对工业CO2捕集应用的可行性,许多研究开始关注放大试验、工艺能耗、工程模拟等,说明Li4SiO4基吸附剂已开始从基础研究向工程应用过渡,但还存在较多问题。其中,开发低CO2浓度下具有高吸附动力学和优异循环稳定性的成型Li4SiO4吸附剂仍是主要任务。
5 结语与展望
分别从Li4SiO4制备方法、改性方法和成型及应用3方面梳理了Li4SiO4吸附剂在高温CO2捕集领域中的最新研究进展。目前合成Li4SiO4吸附剂的制备方法较多,其中固相法更具有经济性并适用于大规模生产,但得到的吸附剂活性有待提升。溶胶凝胶法、沉淀法和燃烧法所得Li4SiO4吸附剂的吸附效果优良,但生产成本高、合成工艺复杂,不适于工业生产。低CO2浓度下的动力学限制被认为是Li4SiO4吸附剂面临的主要挑战。为提高吸附材料在低CO2浓度下的吸附性能和循环稳定性,可通过碱性碳酸盐负载和惰性元素掺杂等方式,还可利用部分天然矿石及废弃物中存在的杂质组分制备具有高活性的Li4SiO4吸附剂。此外,吸附剂成型及适配工艺开发也备受关注,表明Li4SiO4基吸附剂已从基础研究向工程应用过渡。
但对于工业化应用,目前还需重点解决以下问题:
1)研究人员通过各种方法制备了不同形貌的Li4SiO4吸附剂,但目前尚无可直接使用的吸附剂材料,因此开发高活性和高循环稳定性的Li4SiO4吸附剂是首要问题。此外,Li4SiO4吸附剂的生产成本也需考虑,虽然已有研究证明使用廉价矿石或工业废料成功合成Li4SiO4吸附剂可有效降低其生产成本,同时原料中的杂质组分还能提高Li4SiO4吸附活性和循环稳定性,但目前Li源的低成本替代方案极少,寻找廉价的Li源或替代元素是碱金属硅酸盐材料研究的重点方向之一。
2)目前成型Li4SiO4颗粒生产已有大量研究报道,为保证颗粒材料的机械强度,造粒过程中对材料进行压实,不仅破坏了材料的孔道结构,也减小了材料比表面积,导致成型Li4SiO4的CO2吸附性能劣于粉末材料。通过寻找高效的成孔剂、黏合剂以及开发新型造粒技术,制备兼具高吸附活性和机械强度的成型Li4SiO4颗粒也是急需解决的关键问题。
3)为推进CCUS技术,服务我国“双碳”重大战略目标,将开发的吸附材料应用于工业CO2捕集场景是该领域的重点课题。对于Li4SiO4基吸附材料,设计合适的反应器(流化床、移动床等)和吸脱附工艺、降低材料的吸脱附能耗等还有待进一步优化。
4)对于捕集后CO2的处理处置也是CCUS技术成功的关键,目前大规模CO2利用与封存仅限于CO2驱油或地质储存等,但在全球近300亿t/a CO2排放现状下,对多路径CO2利用技术需求迫切。目前已有大量工作关注CO2热催化[119]、电催化[120-122]、光催化[123-124]及协同催化[125],制备高附加值燃料或化工原料。但我国CO2转化技术起步较晚,高效CO2还原及规模化CO2转化技术有待进一步开发。

