CRISPR/Cas 技术在动物疫病诊断中的应用
尚佳静,罗娟,王帅,张富友,邓春冉,于晓慧,刘华雷,刘冠慧,李阳
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056038;2.中国动物卫生与流行病学中心,山东青岛 266032;3.茂名市动物疫病预防控制中心,广东茂名 525000)
成簇规律间隔短回文重复序列及其相关蛋白(clustered regularly interspaced short palindromic repeats/CRISPR associated proteins,简称CRISPR/Cas),是原核生物中的一种适应性抗病毒免疫系统,存在于大多数细菌中[1]。1987 年,Ishino等[2]首次在大肠杆菌中检测到了第一个CRISPR。2002 年,Jansen等[3]将重复的DNA 序列命名为成簇的规则间隔短回文重复序列(CRISPR)。此后,世界各地学者对其进行了广泛研究。2013 年,CRISPR 技术作为一种基因编辑手段首次应用于哺乳动物和人类细胞的基因编辑[4]。2017 年,Chen等[5]提出了名为DNA 内切酶靶向CRISPR 反式报告(DETECTR)的CRISPR-Cas12a 诊断工具。该工具已被用于检测人乳头状瘤病毒(HPV),检测时间只需1 h[6]。2018 年,Kellner[7]等和Gootenber等[8]共同开发了基于CRISPR-Cas13a 系统的诊断工具——SHERLOCK,其在检测寨卡病毒、登革热病毒以及各种病原菌中都具有较高的敏感性。迄今为止,CRISPR/Cas 系统已被广泛用于微生物、植物和哺乳动物的基因组编辑[9-12]、分子诊断[13-14]、代谢工程[15]、基因功能挖掘[16]等基础研究和生物技术领域。本文简要介绍了CRISPR/Cas系统,重点阐述其在动物疫病诊断中的应用,旨在为动物疫病检测及防控提供技术支撑。
1 CRISPR/Cas 系统简介
1.1 系统基本结构
CRISPR/Cas 系统主要由CRISPR 基因座、前导序列、编码Cas 相关蛋白的基因和反式激活crRNA(tracrRNA)组成,其中基因座部分由许多短且保守的重复序列区(repeats)组成,这些重复序列由短的独特间隔序列(spacers)间隔开(图1)。重复序列区由众多高度保守的基因序列组成,能使转录岀的RNA 二级结构保持稳定;间隔区由细菌捕获的外源DNA 序列组成,作为细菌对抗病毒再次入侵的抗原[17],可激活CRISPR 相关蛋白的记忆功能。上游的前导序列(leaders)被称为CRISPR 序列的启动子[18]。Cas 基因家族负责编码多种具有特定功能的Cas 蛋白。Cas 蛋白具有聚合酶、解旋酶和核酸酶等活性,参与crRNA(CRISPR RNA)前体的加工剪切和成熟,当机体再次识别外源DNA 后,会激活Cas 蛋白核酸酶功能,完成对外源DNA 的降解[19]。tracrRNA 位于Cas 蛋白编码基因以及前导序列-重复-间隔序列的反方向,用以介导非编码前体crRNA(pre-crRNA)的成熟,以获得crRNA(也被称为向导RNA,gRNA)[20]。
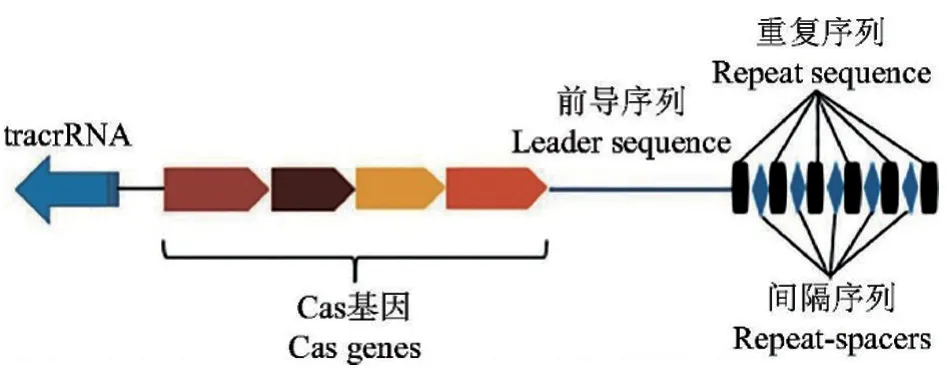
图1 CRISPR/Cas 系统基本结构组成[21]
1.2 系统分类
根据效应蛋白的组织结构和数量不同,CRISPR/Cas 系统可分为两大类:第1 类可分为I、III 和IV 型3 种类型,需要利用多蛋白效应复合体;第2 类可分为II、V 和VI 型3 种类型,仅需要单个效应蛋白发挥作用。这两类系统又可细分为33 个亚型,其中第1 类16 种、第2 类17种[22]。第2 类系统仅需要单个效应蛋白即可发挥作用,作用机制相对简单,被广泛应用于人类病原体的基因组编辑和核酸检测分析,特别是CRISPRCas9、-Cas12a 和-Cas13a。CRISPR/Cas9 系统由Cas9 蛋白和gRNA构成。gRNA包括crRNA 和tracrRNA,可以指导Cas9 蛋白靶向切割DNA 或RNA,从而发挥基因编辑作用[23]。Cas12a 利用富含T 的原间隔邻近基序(PAM 位点)对DNA 进行干扰,并在单一crRNA 的介导下切割DNA 产生5'突出黏性末端。CRISPR-Cas13a 是目前CRISPR/Cas 家族中唯一只靶向单链RNA 的蛋白,具有连带剪切活性[24]。
1.3 系统作用机制
CRISPR/Cas 系统通过适应、crRNA 成熟和干扰3 个过程发挥免疫作用[25]。在适应阶段,将来自入侵遗传物质的新间隔物插入CRISPR 阵列之间;在crRNA 成熟阶段,CRISPR 阵列被转录为前体crRNA,随后被加工成包含部分重复序列和间隔区的成熟crRNA;干扰阶段是成熟crRNA 与单个或多个Cas 蛋白形成复合体,识别入侵核酸上的间隔区互补序列(protspacer),并对它进行剪切使其表达沉默,从而实现免疫功能。CRISPR/Cas 获得性免疫过程见图2[26]。以Cas9 为例,病毒首次入侵时,细菌将病毒入侵的小片段 DNA 序列整合到CRISPR 序列的间隔区,产生PAM;病毒第二次侵入时,前导区将CRISPR 序列转录成由多个crRNA 组成的pre-crRNA,与tracrRNA 配对后,被RNaseIII 等酶加工成含有与病毒靶标序列匹配的tracrRNA-crRNA 复合物,即gRNA,最终Cas9 蛋白在gRNA 引导下发挥核酸内切酶活性,可以特异性定位到目标位置,并切割目标序列,从而实现单个或多个基因的敲除、基因插入或DNA修饰等[17,27]。除了基因组编辑应用外,Cas12a、Cas12b、Cas13a 和Cas14 这些效应蛋白具有并列切割目标序列和非特异性ssDNA/ssRNA,以及方便使用信号读出(侧向流动或荧光信号读出)的能力[28],具有开发为下一代核酸检测技术的潜力。

图2 CRISPR-Cas 获得性免疫阶段
2 CRISPR/Cas 在动物疫病诊断中的应用
目前,动物疫病给全球养殖业的健康发展带来了严重威胁。因此,病原的快速诊断,对于控制疫病传播至关重要。根据世界卫生组织的标准,理想的病原体诊断方法应该是廉价、灵敏度高、特异性强、方便、快捷、无需大型设备的。常用的聚合酶链式反应(PCR)、实时荧光定量PCR(qPCR)、等温扩增等检测方法费时、费钱,敏感性和特异性较低,并且需要特定且昂贵的设备,不能满足快速检测需求。CRISPR-Cas 系统为原核生物抵御外来入侵发挥了适应性免疫系统的作用。CRISPRCas系统,尤其是CRISPR-Cas12a 和CRISPRCas13a,以灵敏、特异、高碱基分辨率和核酸识别可编程性为特点,被用于分子诊断,彻底改变了原有的病原检测方式。
2.1 病毒性疾病诊断
目前,病毒的检测方法很多,包括传统的血清学中和试验、免疫组织化学方法、酶联免疫吸附试验(ELISA)和逆转录-聚合酶链式反应(RT-PCR)方法[29]。然而,这些检测方法耗时长,对仪器和人员要求高,不适合在现场或基层实验室使用。因此,寻求一种快速、准确、高效、直观的病毒检测方法迫在眉睫。CRISPR-Cas 系统因其敏感度性和特异性强,被广泛应用于病毒性疾病诊断。
牛病毒性腹泻(BVD)由牛病毒性腹泻病毒(BVDV)引起,在牛等反刍动物中流行。该病引起多种临床症状,给养殖业造成了重大经济损失[30]。Yao等[31]建立了一种基于CRISPR-Cas13a 系统的检测方法,用于检测BVDV 核酸,检出限为103pmol/L。为了快速检测流感病毒,Liu等[32]利用CRISPR-Cas13a 建立了一种H7N9 流感病毒常温检测系统,可以检测到1 fmol/L 的RNA,且检测H1N1 和H5N1 等亚型病毒时有良好的特异性,检测时间与qPCR 相比,由2 h 降低至50 min。Chang等[33]建立了一种CRISPR-Cas13a 结合逆转录环介导等温扩增(RT-LAMP)的猪繁殖与呼吸综合征(PRRS)检测方法,检出限为172 拷贝/μL,与猪细小病毒、猪瘟病毒、伪狂犬病病毒无交叉反应,特异性较好,临床样本荧光检测结果与RTqPCR 结果一致,表明Cas13a 荧光检测方法可用于临床标本检测。Zheng等[34]将重组酶聚合酶扩增(RPA)与CRISPR-Cas12a 相结合,建立了一种可视化的传染性法氏囊病毒(IBDV)检测方法,为家禽IBDV 的直观、快速和定点分子诊断提供了便利。Ren等[35]开发了一种基于RPA-CRISPR/Cas13a 的狂犬病早期诊断方法,可在大鼠感染3 d后检测到从脑脊液(CSF)病毒颗粒释放的狂犬病病毒基因组RNA,检测限也由常规PCR 和qPCR的10 拷贝/μL 降低至单拷贝病毒RNA。Li等[36]开发了迄今为止基于CRISPR/Cas 系统最简单的RNA 平台,称为第2 版1 h 低成本多用途高效系统(HOLMESv2)检测平台,在1 h 内即可快速检测乙型脑炎病毒。坦布苏病毒(TMUV)给家禽养殖业造成了巨大经济损失,He等[37]对此建立了一种基于RPA-CRISPR-Cas13a 的快速检测方法,检出限为102拷贝/μL,其检测性能与RT-qPCR 相当。
CRISPR/Cas 系统不仅可以检测RNA 病毒引起的疾病,还可以检测DNA 病毒疾病。2018 年,非洲猪瘟传入我国,给我国养猪业造成巨大经济损失。张雨杭等[38]建立了稳定、简单、成本低廉的CRISPR/Cas-非洲猪瘟病毒(ASFV)核酸检测方法,并结合侧流层析试纸实现了可视化判定,摆脱了对荧光设备的依赖,检测时间也由1 h 缩短至30 min。侧向流动检测是免疫反应最常用的技术之一。Bai等[39]将重组酶介导等温核酸扩增技术(RAA)和CRISPR/Cas12a 结合,将ASFVp72基因检测水平降低至10 amol/L,实现了ASFV的现场检测。Wang等[40]将侧向流层析试纸条与CRISPR/Cas9 系统结合开发了CASLFA(CRISPR/Cas9-mediated lateral flow nucleic acid assay),可以在短时间内完成临床样品的ASFV 检测。牛结节性皮肤病(LSD)是由牛结节性皮肤病病毒(LSDV)引起的一种传染性强的牛痘病。Jiang等[41]建立了一种新的基于ORF068基因的RPA-CRISPR-Cas12a技术,其灵敏度高于PCR 低于qPCR,操作简单,只需水浴或培养箱,仅需15 min 即可完成检测,比qPCR 和PCR 花费的时间要少得多,同时通过肉眼可以看到荧光信号,实现了LSDV 的现场快速检测。Wei等[42]将酶促重组酶扩增(ERA)和CRISPR/Cas12a 系统结合起来,建立了一种可视化的猪细小病毒检测方法。
2.2 细菌性疾病诊断
目前,国际标准中用来检测细菌的方法主要是生化试验和血清学试验,实验室常用PCR、划线分离和ELISA 等方法。然而,这些方法检测时间长,存在交叉反应[43],不能快速检测病原体。近年来,随着技术的发展,CRISPR/Cas 系统逐渐被用于细菌病原体检测。
布鲁氏菌病是一种全球性人兽共患传染病,由布鲁氏菌属细菌引起[44],主要影响反刍动物,导致其流产和不孕[45]。Wu等[46]建立了一种基于CRISPR/Cas13a 鉴定布鲁氏菌的方法,其敏感性和特异性可达100%,检测下限为1 拷贝/μL,对布鲁氏菌不同生物型均可诊断,实现了快速鉴定布鲁氏菌的需求。Wang等[47]开发了一套基于CRISPRCas12a 的炭疽杆菌检测系统,整个检测过程无需通电,且具有单拷贝级灵敏度。康月茜等[48]将CRISPR/Cas9 检测系统应用于细菌体内,并引入了荧光报告基因mCherry,可肉眼直接观察特征菌落产生,避免了常规方法对gRNA 的诱导表达。
Bonini[49]将CRISPR/Cas12a 系统与电化学阻抗谱(EIS)测量相结合,建立了一种无标记生物传感检测大肠杆菌和金黄色葡萄球菌的方法,检测限为3 nmol/L,检测时间约为1.5 h,这是第一个基于CRISPR/Cas12a 无标记阻抗分析的生物传感器。Xiao等[50]建立了一个基于CRISPR-Cas12a/sgRNA 的核酸检测平台,用于鉴别结核分枝杆菌和非结核分枝杆菌感染,既不需昂贵的仪器又可实现早期诊断和治疗。Shen等[51]利用变构探针(AP)识别目标病原体,建立了一种被称为APC-Cas13a的检测方法,实现了沙门氏菌检测,与传统的qPCR 相比,具有更高的灵敏度和准确性。RPA 和CRISPR/Cas12a 的结合可以高精度地完成沙门氏菌毒力基因和耐药基因的双重检测[52]。CRISPR/Cas14a1 与不对称核酸扩增相结合,可以在牛奶中检测多种致病菌[53]。
葡萄球菌是动物体表及上呼吸道的常见菌,耐甲氧西林金黄色葡萄球菌(MRSA)因其多重耐药的特征日益成为动物和公众健康的主要威胁,其诊断通常使用PCR 和培养法,但这些方法不适用于快速即时检测。Li等[54]将RPA 与CRISPR/Cas12a 系统集成到一个试管中,结合侧向流动试纸和荧光实现了对MRSA 的检测,荧光方法的灵敏度为10 拷贝,侧向流动试纸的灵敏度为10~100拷贝,此过程可在20 min 内完成。
创伤弧菌(Vibrio vulnificus)是一种重要的人兽共患病原菌和水生动物病原体,可引起人和水生动物(特别是鱼类和虾类)的弧菌病。Xiao等[55]建立了一种RAA 结合CRISPR/Cas12a 的方法来检测创伤弧菌,无需精密仪器即可在40 min 内快速检测出2 个拷贝的创伤弧菌基因组DNA,在水产养殖中弧菌病的早期诊断和现场检测方面具有很大潜力。鸭疫里默氏杆菌给养鸭业带来严重经济损失。Zhu等[56]将高通量测序技术和CRISPR-Cas 系统结合,进行鸭疫杆菌的比较基因组分析,首次揭示了鸭疫杆菌CRISPR-Cas 系统的结构特征,这有助于研究CRISPR 介导的获得性免疫等生物学功能。
2.3 寄生虫病诊断
虾肝肠孢子虫(EHP)是肠细胞虫科中的一种寄生虫,主要感染斑节对虾、太平洋白对虾等,可导致虾类生长迟缓,大小分布不均匀,已成为亚洲对虾养殖业的主要威胁。Kanitchinda等[57]建立了一种以RPA 和CRISPR-Cas12a 相结合来检测EHP的方法,实现了EHP 的快速准确检测,检测限低至50 个DNA 拷贝,整个过程可在37 ℃ 1 h 内完成,同时通过结合侧向流动试纸条,使肉眼可视化成为可能。隐孢子虫是一种肠道原生动物寄生虫,可感染人类及脊椎动物[58],已证明是引起儿童腹泻和死亡的第二大病因,仅次于轮状病毒[59]。在隐孢子虫所有亚型中,IId 亚型具有流行普遍和高毒力的特点。为了及时准确诊断隐孢子虫病,Yu等[60]整合RAA 和Cas12a/crRNA 反式切割系统(称为ReCTC),通过在蓝光下用肉眼观察荧光读数,使用侧向流动条生物传感器即可进行现场诊断,灵敏度可检测到单个拷贝,并且特异性良好,临床样本检测结果与常规 RT-PCR 测序方法一致。此外,Li等[61]报告了一种适用于隐孢子虫检测的超灵敏CRISPR/Cas12a 驱动的免疫传感方法,通过抗体-DNA 偶联物将基于抗体的识别与基于CRISPR/Cas12a 的荧光信号放大联系起来,可检测到4 μm 大小的微小隐孢子虫卵囊,最高灵敏度为每个样本1 个卵囊。
弓形虫是一种广泛分布于世界各地的病原体,给畜牧业造成重大经济损失。Lei等[62]开发了一种便携式的“一锅法”弓形虫检测方法,将冷冻干燥的RPA 试剂和Cas12a/crRNA 试剂预存在1 个EP 管中,避免了逐级添加组分的缺点,检测下限为3.3 拷贝/μL,且对弓形虫B1基因扩增片段的选择性高于其他寄生虫,使其成为一种具有前景的基层检测弓形虫工具。疟疾是由疟疾原虫引起的人兽共患病,主要通过蚊虫叮咬传播,严重影响动物和人类的健康。Lee等[63]建立了一种基于CRISPR的诊断方法,将核酸检测平台SHERLOCK 和侧向流动试纸条结合,对恶性疟原虫、间日疟原虫、卵形疟原虫和疟疾进行检测区分,结果特异性良好,与这些病原无交叉反应,能够检测到每微升血液中的寄生虫。这为非恶性疟疾物种和低寄生虫密度恶性疟原虫感染的快速临床诊断提供了技术支持。Cunningham[64]等利用一种基于CRISPR 的诊断方法SHERLOCK,用于疟原虫检测、物种分化和耐药基因分型,灵敏度接近常用的qPCR 检测方法。
2.4 其他病诊断
钩端螺旋体病是一种影响全球健康的人兽共患病,每年有超过100 万例病例,其中58 900 人死亡[65]。该病病原体可以广泛适应哺乳动物宿主和环境[65-66]。钩端螺旋体病的临床症状与登革热、败血症等传染病相似,往往难以诊断[67]。Jirawannaporn等[68]开发了一种与RPA-CRISPR/Cas12a 相结合的侧向流动检测方法,检测限为102个细胞/mL,与恙虫病、全身性细菌感染、流感等其他急性发热性疾病无交叉反应,与qPCR 相比,具有特异性高、灵敏度强的特点,能够提高钩端螺旋体病的诊断速度和准确性。
猪支原体肺炎是由肺炎支原体引起的一种接触性慢性呼吸道传染病,被认为是最常发生且经济意义重大的猪病之一。Li等[69]将RPA 与CRISPRCas12a 相结合,建立了一种快速检测肺炎支原体的方法,对201 份临床样本评估后发现,该方法与qPCR 法相比敏感性为99.1%(107/108),特异性为100%(93/93),一致性为99.5%(200/201)。
3 存在的问题
尽管CRISPR/Cas 技术在核酸检测领域取得了巨大成就,但其仍存在许多局限性。首先,基于抗原的检测平台敏感性和选择性较低,要确认感染的病原体是细菌还是病毒,若为细菌,则有必要了解其耐药性[70]。其次,CRISPR/Cas 系统存在脱靶风险,sgRNA 正确识别靶点需要PAM 序列,虽然这增加了系统的特异性,但也降低了靶区选择和相应sgRNA 设计的灵活性,对同一病原的不同亚型鉴定存在影响[71],但可以通过在线软件选择靶序列以帮助降低脱靶结合的概率。最后,由于RNase无处不在,RNA 非常脆弱,其对核酸的检测结果有一定影响。因此,应确保CRISPR/Cas 系统中用于核酸检测信号扩增的sgRNA 不会被RNase 缩短或降解,从而减少检测结果假阴性的概率[72]。
4 总结与展望
传统的动物疫病检测方法耗时长,步骤复杂,对仪器设备要求高,不适用于基层监测和初步筛查。因此,开发一种简便易行的现场快速检测技术尤为重要。CRISPR/Cas 系统具有敏感性高、特异性强以及碱基分辨率高、成本低、效率高等优点。近年来,科研人员开发了一系列基于CRISPR/Cas 系统的核酸检测技术,展现了该系统在动物病毒性疾病、细菌性疾病、寄生虫病等动物疫病诊断领域的巨大发展潜力。同时,CRISPR/Cas 系统已被应用于人类健康领域,如SARS-CoV-2 检测试剂盒被应用于新冠病毒大流行控制,CRISPR/Cas13 被应用于抑制人类免疫缺陷病毒(HIV)感染和肿瘤疾病的治疗。可见基于CRISPR 的诊断技术可能很快就会被应用于临床实践中。此外,CRISPR/Cas 也被用于改进植物对抗破坏性病毒。CRISPR/Cas13a 用于工程化本氏烟草,以产生对萝卜花叶病毒(TuMV)的抗性[73],这为南方水稻黑条矮缩病毒产生抗性铺平了道路。利用CRISPR 系统破译植物与病毒的相互作用以及培育具有持久和广谱抗病性的植物对农业发展有重要意义。尽管还没有完全掌握CRISPR/Cas 系统平台的潜力,但这项技术代表着革命性进步。虽然CRISPR/Cas 存在脱靶效应以及检测结果假阳性问题,但不可否认,CRISPR/Cas 系统是目前最有前景的分子诊断平台之一,随着对Cas 蛋白研究的深入以及更多Cas 蛋白被发现,相信在不久的将来,CRISPR/Cas 系统将会更加广泛地被应用于动物疫病诊断领域。

