鸭星状病毒3 型RT-RAA 快速检测方法的建立
邓春冉,张富友,尚佳静,罗娟,于晓慧,蒋文明,刘华雷,王一新,刘冠慧,徐丽娜,李阳
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056038;2.中国动物卫生与流行病学中心,山东青岛 266032;3.山东农业大学动物医学院,山东泰安 271018)
禽星状病毒(avian astrovirus,AAstV)属于星状病毒科,包含多种亚型,是危害家禽养殖业的重要病原之一。AAstV 是一种无囊膜的单股正链RNA 病毒,直径25~35 nm,基因组全长6.1~7.9 kb,包括5'端非编码区、3 个开放阅读框(ORF1a、ORF1b 和ORF2)、3'端非编码区和1 个多聚腺苷酸尾巴[1]。鸭星状病毒(DAstV)是最早被发现的AAstV,早在1965 年研究人员就从患病毒性肝炎的鸭群中发现了DAstV。目前,已知的DAstV 基因型有4 种(DAstV-1~4)[2-4],其中DAstV-3 是近年来在我国鸭群中感染率较高的星状病毒,流行的范围也越来越广,可以引发鸭病毒性肝炎、产蛋下降等,给我国养鸭业带来了严重经济损失[5]。
目前,对于DAstV-3 的检测主要依靠传统RT-PCR、荧光RT-PCR 和血清学检测等方法,但这些方法耗时长,对设备要求较高,并不适用于DAstV-3 的现场快速检测。重组酶介导的等温扩增技 术(recombinase aided amplification,RAA)是一种利用重组酶、单链结合蛋白和DNA 聚合酶,在恒温条件下进行核酸扩增的新技术,相比于传统的PCR 检测方法,具有快速、简便、灵敏等优点,目前已被应用于乙型脑炎病毒[6]、新型冠状病毒[7]、鸡滑液囊支原体[8]等病原体的快速检测,在很大程度上为疫病防控提供了便利。本研究建立了一种DAstV-3 的RT-RAA 快速检测方法,以期为该病原感染临床快速诊断和流行病学调查提供技术支持。
1 材料与方法
1.1 材料
1.1.1 主要试剂 RT-RAA 核酸扩增试剂盒(荧光法),购自杭州众测生物科技有限公司;一步法RT-PCR 试剂盒(HiScript High Fidelity One step RT-PCR Kit),购自南京诺唯赞生物科技股份有限公司;病毒DNA/RNA 提取试剂盒,购自济凡生物科技(北京)有限公司;转录试剂盒(RiboMAXTMLarge Scale RNA Production System-T7),购自普洛麦格(北京)生物技术有限公司;纯化试剂盒(RNeasy Mini Kit),购自德国QIAGEN 有限公司;胶回收试剂盒,购自赛默飞世尔科技公 司;pEASY-Blunt Zero Cloning Kit 和Trans5α Chemically Competent Cell,购自北京全式金生物技术(TransGen Biotech)股份有限公司;LB培养基,购自青岛海博生物技术有限公司;DNA Marker,购自宝生物工程(大连)有限公司。
1.1.2 主要仪器 RAA-B6100 恒温振荡混匀仪、RAA-F1620 恒温核酸扩增检测仪,购自江苏奇天基因生物科技有限公司;miniAmp PCR 仪、Nano Drop 核酸定量仪,购自赛默飞世尔科技公司;涡旋振荡器,购自上海沃元科技有限公司。
1.1.3 病毒及临床样本 DAstV、H9 亚型禽流感病毒(H9-AIV)、鹅星状病毒(GoAstV)、新城疫病毒(NDV)、禽呼肠孤病毒(ARV)等,均由中国动物卫生与流行病学中心分离鉴定并保存。鸭拭子和组织样品,采集自广东、广西、福建、湖南等地,共计166 份。
1.2 方法
1.2.1 引物、探针设计与合成 依据DAstV-3 参考毒株CPH 株(GenBank:KJ020899)基因序列,利用Oligo 软件设计探针和引物,序列详见表1。所有引物及探针均由生工生物(上海)有限公司合成。
1.2.2 cRNA 标准品制备 以提取的DAstV-3 RNA 为模板,使用AAstV 通用引物(XZ-F/R)扩增DAstV-3的RdRp基因,回收目的片段后连接到T 载体上,通过热激将重组质粒转化进大肠杆菌感受态细胞DH5α 中;筛选阳性单克隆菌落并进行培养,使用SpeI 内切酶对阳性质粒进行单酶切;使用胶回收试剂盒对酶切后的质粒进行纯化,选择合适浓度的纯化产物作为模板,使用T7 转录试剂盒进行体外转录,再使用RNeasy Mini Kit 纯化试剂盒对转录产物进行纯化,以除去体系中的杂蛋白和各种离子;使用Nano Drop 核酸定量仪测量cRNA标准品浓度,通过公式计算拷贝数,并将cRNA 标准品10 倍倍比稀释至100copies/μL,-80 ℃保存。

表1 引物探针序列
1.2.3 RT-RAA 方法建立及优化
1.2.3.1 引物筛选 以1.2.2 制备的cRNA 为模板,将表1 中的8 种上游引物和6 种下游引物分别进行组合(共48 对),挑选起峰时间早、扩增曲线斜率高的引物组合作为最佳引物对。按照荧光RT-RAA 扩增试剂盒说明书配制反应体系(表2),在含有冻干粉的反应管中加入47.5 μL 上述混合液,在管盖上加2.5 μL B-Buffer(280 mmol/L 乙酸镁),小心盖好盖子,置于恒温振荡混匀仪中振荡混匀,再转移到恒温核酸扩增检测仪中,39 ℃反应20 min。

表2 RT-RAA 反应体系
1.2.3.2 反应条件和反应体系优化 对RT-RAA的反应温度、引物探针用量等参数设置梯度,分别设置反应温度为37、39、41 ℃,引物用量为2.0、1.6、1.2、0.8 μL,探针用量为0.6、0.4、0.2 μL。对比不同条件下的荧光扩增曲线斜率,确定最佳反应条件,同时设置阴性对照。
1.2.3.3 特异性试验 使用优化的RT-RAA 方法,分别对DAstV-3、H9-AIV、GoAstV、NDV、ARV等常见禽病毒进行检测,以验证该方法的特异性。
1.2.3.4 灵敏性试验 以拷贝数浓度为106~100copies/μL 的cRNA 标准品为模板,使用建立的RT-RAA 方法进行检测,测定模板的最低检出量,从而确定该方法的灵敏性。
1.2.3.5 重复性试验 以106~100copies/μL 拷贝数浓度的cRNA 标准品为模板,RNase-free water为阴性对照,利用优化的荧光RT-RAA 方法进行试验,设置8 个重复,并统计重复试验结果。
1.2.4 临床样品检测 利用建立的RT-RAA 方法和RT-PCR 方法同时对采集的166 份临床样品进行检测,验证该方法的临床适用性。
2 结果
2.1 RT-RAA 反应体系建立
2.1.1 引物筛选 选择起峰时间早、扩增曲线斜率高的引物为最佳组合。从48 对引物中挑选7 对引物组合作图。结果(图1)显示:F8/R1 组合扩增效果最好,因此选用此组合进行后续试验。

图1 部分引物筛选结果
2.1.2 反应体系优化 分别选择不同反应温度(37、39、41 ℃)、不同引物用量(2.0、1.6、1.2、0.8 μL)和不同探针用量(0.6、0.4、0.2 μL)进行RT-RAA 试验,对比不同条件下的荧光扩增曲线斜率。结果显示:3 种探针用量对RT-RAA扩增结果影响不大(图2);引物用量为2.0 μL和1.6 μL 时,RT-RAA 的扩增结果更好(图3);3 种反应温度对RT-RAA 扩增结果影响不大(图4~6)。综合考虑试剂盒说明书要求和试验成本,最终确定引物用量为2.0 μL,探针用量为0.4 μL,反应温度为39 ℃。
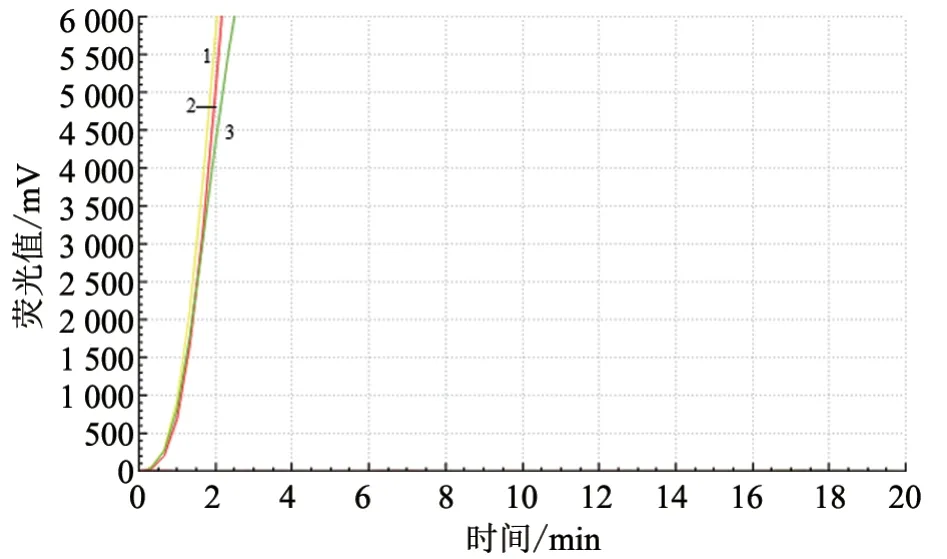
图2 不同探针用量下RT-RAA 反应结果

图3 不同引物用量下RT-RAA 反应结果

图4 37 ℃条件下RT-RAA 反应结果

图5 39 ℃条件下RT-RAA 反应结果

图6 41 ℃条件下RT-RAA 反应结果
2.1.3 特异性试验 利用优化的RT-RAA 方法分别对DAstV-3、GoAstV、H9-AIV、NDV、ARV 进行检测。结果(图7)显示:只有DAstV-3 出现特异性荧光扩增曲线,其他病毒均未出现扩增曲线。

图7 特异性试验结果
2.1.4 灵敏性试验 以10 倍倍比稀释的cRNA为模板,利用优化的RT-RAA 反应体系进行检测。结果(图8)显示:建立的RT-RAA 方法最低检测限为101copies/μL。

图8 灵敏性试验结果
2.1.5 重复性试验 使用建立的RT-RAA 方法进行重复性试验。结果显示:以106~103copies/μL 的cRNA 标准品为模板,8 次检测均出现扩增曲线;以102copies/μL 的cRNA 标准品为模板时,8 次检测中有6 次出现扩增曲线;以101copies/μL 的cRNA 标准品为模板时,8 次检测中有3 次出现扩增曲线;以100copies/μL 的cRNA 标准品为模板时,8 次检测均为阴性。
2.2 临床样品检测
利用建立的RT-RAA 方法和RT-PCR 方法分别对166 份临床样品进行平行检测。结果(表3)显示:RT-RAA 方法检测到40 份阳性样品,RT-PCR 检测到22 份阳性样品,其中两种方法均检测为阳性的样品有22 份。为验证RT-RAA 方法的准确性,对RT-RAA 结果阳性但RT-PCR 结果阴性的样品进行测序鉴定,证实均为DAstV-3。结果表明,RT-RAA 方法检测结果准确可靠,且具有更高的阳性检出率。

表3 RT-RAA 和RT-PCR 方法临床样品检测结果统计单位:份
3 讨论
AAstV 是近年来新发现的一种重要病原,既可通过水平和垂直传播,也可跨物种传播,除可感染鸡、火鸡、鸭等禽类外,也可感染哺乳动物[10],导致AAstV 感染的诊断与防控难度日益增大。作为一种潜在的人兽共患病毒,AAstV 对人类健康构成了严重威胁[11]。DAstV-3 在我国最早于2014年被发现并报道,其传播速度快,分布范围广,给我国养鸭业带来较大的经济损失[12]。目前,实验室常用的DAstV-3 检测方法主要有病毒分离培养、分子生物学检测、电子显微镜(EM)观察等[13],但鉴于DAstV-3 的分离培养较为困难,常规检测耗时长且操作复杂,电子显微镜对仪器设备要求较高等原因,以上方法均无法满足DAstV-3 的快速和大规模检测需求。因此,开发一种快速、特异、灵敏、操作简单的检测方法至关重要。
RAA 技术是近年来快速发展的一种新型等温扩增技术。该技术利用大肠杆菌酶将模板核酸链解螺旋后,在重组酶、聚合酶作用下对模板核酸进行重组和特异性扩增。恒温条件下,RAA 技术在20~30 min 内即可完成核酸快速扩增,具有特异性强、成本低、耗时短及结果判读简单直观等优势,已在多种动物病原检测中被广泛应用,具有广阔的发展前景。DAstV-3 作为新发病原,目前尚未见RT-RAA 检测方法的报道。在此背景下,本研究建立了一种基于荧光探针的DAstV-3 RT-RAA 快速检测方法。
DAstV-3的RdRp基因编码病毒核糖核酸聚合酶,该基因序列在不同DAstV-3 毒株中较为保守。本试验首先分析了GenBank 中登录的DAstV-3RdRp序列,根据保守序列设计了特异性引物及探针,验证确定最佳引物后,对该方法的反应条件进行了优化,并对其灵敏度、特异性和重复性进行了验证。结果表明,本试验所建立的荧光RT-RAA检测方法仅需20 min 即可完成样品的快速检测,与常见的禽病毒无交叉反应,其最低检测限可达101copies/μL。为进一步验证该方法的临床应用效果,采用该方法检测166 份临床样品,发现荧光RT-RAA 方法的阳性检出率高于常规RT-PCR 方法。同时,检测结果也提示,DAstV-3 在我国鸭群中感染率可能较高,需要持续关注该病毒的流行及其带来的危害。
综上,本研究建立了一种DAstV-3 RT-RAA 快速检测方法。该方法特异性强,灵敏度高,操作简单,为开展DAstV-3 的快速检测及流行病学监测提供了可靠的技术支撑,具有良好的应用前景。

