奶牛免疫布鲁氏菌A19 疫苗后的抗体变化和排菌情况监测
董浩,王宁,汪宇,吴同垒,张艳英,于建新,左海莉,王洪海,刘佐民
(1.中国食品药品检定研究院,北京 102600;2.中国农业大学,北京 100193;3.中牧实业股份有限公司,北京 100070;4.河北科技师范学院,河北秦皇岛 066000;5.包头市九原区畜牧水产服务中心,内蒙古包头 014060)
布鲁氏菌病(以下简称布病)是由布鲁氏菌感染引起的一种人兽共患病。全世界范围内有170多个国家和地区有人畜间布病发病的报道。患病的羊、牛等家畜是该病的主要传染源。家畜感染布鲁氏菌后主要表现为母畜流产和公畜不育。布鲁氏菌可以通过破损的皮肤黏膜、消化道和呼吸道等途径感染人,急性期病例以发热、乏力、多汗,肌肉、关节疼痛和肝、脾、淋巴结肿大为主要临床表现,而慢性期病例多表现为关节损害[1]。
近年来,随着我国家畜饲养量不断增加,动物及其产品流通频繁,部分地区布病流行呈持续上升势头,不仅严重影响畜牧业生产,也严重危及人民身体健康和公共卫生安全。2013—2017 年,国家动物布鲁氏菌病参考实验室对我国流产奶牛进行布病流行病学调查发现,在流产奶牛群体中,布病发生率处于高流行水平,其中一类地区5 个省市的流产畜群布病阳性检出率为13.8%~57.8%,二类地区4 个省的为54.4%~86.9%[2]。中国疾病预防控制中心的公开统计数据显示,2021 年我国新增人布病病例69 767 例,为历史最高。由此可见,布病在我国的流行较为严重,亟需开展切实有效的防控,减少其对畜牧业发展和公共卫生安全的危害。
疫苗免疫是家畜布病流行率较高地区防控布病的有效手段之一。目前,我国使用比较广泛的家畜布病疫苗有A19、S2 和M5 等疫苗。其中:A19 疫苗主要用于犊牛免疫,保护周期长;S2 疫苗使用最为广泛,可用于牛、羊、猪等多种动物的免疫,并且可用于怀孕动物的免疫;M5 疫苗主要用于羊免疫,由于其毒力偏强仅在西北少数省份使用[3-5]。
由于现在国内外使用的布病疫苗都是弱毒活疫苗,在进行疫苗免疫时应做好生物安全防护,否则容易对兽医人员和养殖者造成感染。在临床上,由于兽医人员使用布病疫苗不当,造成相关人员布病抗体阳转的案例时有发生[6],因此研究动物免疫布病疫苗后的排菌情况,对科学防范布病疫苗的潜在风险,保障养殖环节的生物安全具有较大意义。
早期的研究更多地关注动物免疫后的抗体消长规律和鉴别诊断等[7-10],而关于动物免疫后排菌情况的研究相对较少。本研究在陕西省某奶牛场选取30 头布病抗体阴性的3 月龄雌性奶牛,采用A19 疫苗进行颈部皮下注射免疫,然后监测奶牛免疫后的体温变化、抗体阳转以及血液、口鼻拭子和阴道拭子中的细菌残留情况,评价A19 疫苗的免疫特点和奶牛免疫后排菌情况,以期为奶牛布病免疫技术研究提供数据参考。
1 材料与方法
1.1 试剂和菌株
布鲁氏菌A19 疫苗,购自中牧实业股份有限公司;布鲁氏菌虎红平板凝集试验(RBT)抗原、试管凝集试验(SAT)抗原,布鲁氏菌阳性血清、阴性血清,购自中国兽医药品监察所国家动物布鲁氏菌病参考实验室;细菌基因组DNA 提取试剂盒(型号ZTLJX),购自西安天隆科技有限公司;GoTagProbe qPCR Master Mix,购自Promega公司;荧光定量PCR 所有引物探针,由生工生物工程(上海)股份有限公司合成;1×PBS 缓冲液(pH7.2~7.4),购自北京索莱宝科技有限公司。
1.2 主要仪器
GeneRotex 全自动旋转式核酸提取仪、Gentier 96E 全自动医用PCR 分析系统,均购自西安天隆科技有限公司;数显恒温水浴锅,购自苏州威尔实验用品有限公司。
1.3 试验动物
陕西省某奶牛场经RBT 检测为布鲁氏菌抗体阴性的3 月龄雌性奶牛30 头。由于在各个采样/监测时间点,无法对所有奶牛展开相关试验,因此根据牛场实际情况,将尽可能多的奶牛纳入相关试验。
1.4 免疫方法
按照A19 疫苗产品说明书,先以600 亿CFU/头的免疫剂量进行颈部皮下注射(首免);在配种前2 个月,再以60 亿CFU/头的免疫剂量进行颈部皮下注射(加强免疫)。
1.5 奶牛体温监测
在首免前以及首免后1~4 d,分别使用温度计测定奶牛肛温。
1.6 免疫抗体监测
在首免后2、6、13、30、60、90 d,以及加强免疫前和加强免疫后3、7、15、30、60、90 d,分别对免疫奶牛采血分离血清,采用RBT 和SAT检测奶牛抗体阳转情况。试验操作按照《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)进行。所有血清样品先用RBT 筛选,再对阳性样品用SAT进行确认。
综上所述,胃憩室为罕见疾病,一般情况下无特殊临床表现,而胃底憩室在影像学的表现上与左肾上肿物常难以鉴别,易导致误诊,故对于无临床症状的左肾上腺肿物且CT检查中肿物密度与胃内容物密度相似时,应考虑胃底憩室可能。必要时可行手术探查,可快速确诊并行进一步治疗。对于确诊为胃憩室的病例,憩室较大且开口狭小、具有腹部不适症状或憩室相关并发症的患者,腹腔镜下手术治疗胃憩室是安全且有效的方法。
1.7 拭子样品采集
在首免后2、6、13、30、60 和90 d,以及加强免疫前和加强免疫后3、7、15、30、60 和90 d,分别对免疫奶牛采集阴道和口鼻拭子。阴道拭子采集方法:取无菌棉拭子插入母畜阴道中旋转2~3 圈,刮取阴道分泌物,放入装有1 mL PBS 的15 mL离心管中;口鼻拭子采集方法:取无菌棉拭子依次插入母畜中鼻腔和口腔内旋转2~3 圈,蘸取鼻腔和口腔分泌物,放入装有1 mL PBS 的15 mL 离心管中。
1.8 核酸提取
根据《人间传染的病原微生物名录》规定,本研究中的样品处理与核酸提取均在BSL-2 级实验室进行。在生物安全柜中打开装有免疫奶牛抗凝血、阴道拭子、口鼻拭子样品的抗凝采血管或离心管,分别取250 μL 加入装有20 μL 蛋白酶K 的无菌EP 管中,颠倒混匀;放入56 ℃水浴锅中作用30 min 后,将全部溶液组分加入预分装的基因组DNA 提取试剂中,使用GeneRotex 全自动旋转式核酸提取仪提取核酸。
1.9 布鲁氏菌核酸检测
使用荧光定量PCR 方法,进行抗凝血和拭子样品的布鲁氏菌核酸检测。布鲁氏菌荧光定量PCR 方法参考Lotfi等[11]基于IS711 序列的布鲁氏菌核酸检测方法,使用Gentier 96E 全自动医用PCR 分析系统进行荧光定量PCR 扩增。上游引物序列为5'-cgctcgcgcggtggat-3',下游引物序列为5'-cttgaagcttgcggacagtcacc-3',探针序列为5'-FAMacgaccaagctgcatgctgttgtcgatg-BHQ1-3'。
荧光定量PCR 反应体系:GoTagProbe qPCR Master Mix 10.0 μL,10 μmol/L 的上、下游引物各0.6 μL,10 μmol/L 探针0.6 μL,DNA 模板2.0 μL,加入无核酸酶的水补齐至20.0 μL。扩增程序:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40 个循环,在每个循环第二步(60 ℃ 1 min)收集荧光信号。
1.10 统计学分析
使用GraphPad Prism 5 软件,对免疫后奶牛的体温进行t检验,当P<0.05 时差异有统计学意义。
2 结果
2.1 免疫前后奶牛体温变化
在首免前和首免后1~4 d,分别测量奶牛体温,初步评价A19 疫苗免疫对奶牛体温的影响。在免疫前,测量了23 头奶牛,发现奶牛平均体温为38.96 ℃,均在正常体温范围内(38.5~39.5 ℃)。免疫后1~4 d,奶牛平均体温依次为40.26、40.56、40.13、39.53 ℃,显示接种A19 疫苗后3 d 内奶牛体温出现升高现象,均显著高于免疫前的体温(P<0.05),免疫后4 d 体温基本恢复正常(图1)。
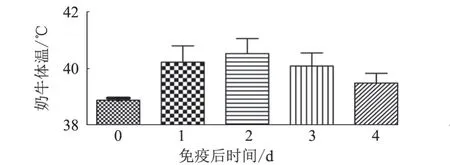
图1 A19 疫苗免疫前后奶牛体温变化
2.2 首免后抗体消长情况
分别在A19 疫苗皮下注射奶牛后2、6、13、30、60 和90 d 采集血清,使用RBT、SAT 进行抗体检测。结果(图2)显示:免疫后6 d,61.11%(11/18)的奶牛出现抗体阳转;免疫后13、30、60 和90 d 的抗体阳性率分别为82.14%(23/28)、27.59%(8/29)、3.85%(1/26)和3.33%(1/30)。在本次试验中,奶牛免疫A19 疫苗后6 d,一半以上开始出现抗体阳转,60 d 后绝大部分奶牛抗体转阴。
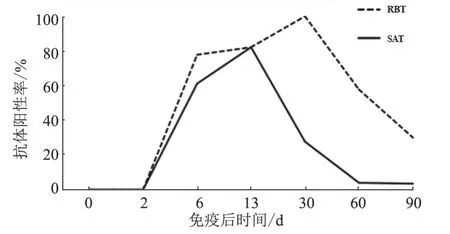
图2 首免后不同时间点的奶牛抗体变化
2.3 加强免疫后抗体消长情况
分别在A19 疫苗加强免疫前和加强免疫后3、7、15、30、60 和90 d 采集血清,使用RBT、SAT进行抗体检测。结果(图3)显示:加强免疫前16.00%(4/25)的奶牛抗体呈阳性,加强免疫后3、7、15、30、60和90 d,抗体阳性率分别为27.78%(5/18)、100%(19/19)、100%(17/17)、100%(23/23)、66.67%(12/18)和36.84%(7/19)。
2.4 抗凝血核酸检测

图3 加强免疫后不同时间点的奶牛抗体变化

表1 首免后奶牛抗凝血布鲁氏菌核酸检测结果
2.5 阴道拭子核酸检测
对首免后和加强免疫前后各个时间点采集的阴道拭子提取核酸进行荧光定量PCR 检测。结果(表2)显示:首免后2 d,在17.86%的奶牛(5/28)阴道拭子中检测到布鲁氏菌核酸,首免后6~90 d以及加强免疫前后各个时间点,均未从奶牛阴道拭子中检测到布鲁氏菌核酸。结果表明,颈部皮下注射免疫A19 疫苗会出现短时间的阴道排菌情况,但在阴道拭子可检出的时间点早于抗体产生时间。

表2 阴道拭子样品的布鲁氏菌核酸检测结果
2.6 口鼻拭子核酸检测
对首免后和加强免疫前后各个时间点采集的口鼻拭子进行核酸提取和荧光定量PCR 检测。结果显示,首免和加强免疫的各个时间点均未从奶牛口鼻拭子中检测到布鲁氏菌核酸。结果表明,颈部皮下注射免疫A19 疫苗基本不会从口腔和鼻腔途径排菌。
3 讨论
《畜间布鲁氏菌病防控五年行动方案(2022—2026 年)》对布病强制免疫工作作出了新部署,要求到2026 年免疫地区免疫密度常年保持在90%以上,免疫建档率达到100%,免疫奶牛场备案率达到100%,免疫评价工作开展率达到100%[12]。《国家动物疫病强制免疫指导意见(2022—2025 年)》[13]规定:对种畜以外的牛羊进行布病免疫,对种畜禁止免疫;各省份根据评估结果,自行确定是否对奶畜免疫,确需免疫的,养殖场(户)应逐级报省级农业农村部门同意后实施。目前,因布病导致的扑杀成本和损失较大,以致阳性奶畜持续存在或违法出售,散播布病的风险持续存在。
国内外的相关研究[14-16]也已证实,对奶牛使用疫苗进行布病防控是可行的,国内部分乳企通过免疫、检疫、扑杀相结合的措施最终成功实现了奶牛场的布病净化。鉴于当前奶牛布病流行形势较为严峻,加强新型布病疫苗和诊断技术研究,积极探索符合我国实际情况的奶牛布病防控技术迫在眉睫。
王苗苗等[17]对A19 疫苗通过眼部滴注、口腔喷注、阴道喷灌等3 种黏膜途径免疫奶牛的排菌程度及免疫反应进行了监测,结果发现使用选择性培养基在5 d 内能够从免疫部位分离到布鲁氏菌。虽然使用的方法不同,检测部位有差别,但是上述研究与本研究发现的免疫后2 d 从部分奶牛阴道拭子中能够检测到布鲁氏菌核酸的结果基本一致,都表明了犊奶牛免疫A19 疫苗后的排菌期较短。
王苗苗等[17]对10~12 月龄奶牛皮下注射免疫A19 疫苗,发现180 d 时抗体阳性率仍为35%;张锋刚等[18]对育成牛和泌乳牛皮下注射免疫A19 疫苗,发现8 个月后仍有10%的牛抗体为阳性;安尼瓦尔等[19]对牧区和农区的牛皮下注射A19 疫苗(600 亿CFU/头),发现90 d 后抗体阳性率仍超过60%。上述研究中奶牛的抗体持续期长于本研究中相关数据,这可能与免疫牛的日龄偏大以及群体中混有自然感染牛等原因相关。在本研究中,对3 月龄奶牛皮下注射A19 疫苗后60 d,96.15%的奶牛抗体转阴。造成本研究抗体持续期明显短于上述研究的主要原因可能是奶牛免疫时月龄偏小。根据A19 疫苗的使用说明书,应该对3~8 月龄的牛进行免疫,如果牛月龄过小,其免疫系统发育不完全,对疫苗免疫不敏感,就无法激发足够的保护力;如果牛月龄过大免疫A19,就可能会延迟抗体持续期并产生较大的应激反应;而对怀孕牛使用A19疫苗则会引起怀孕牛流产、乳汁排菌等不良反应。因此,在使用A19 疫苗时一定要注意牛的月龄,切忌对怀孕牛使用该疫苗免疫[20]。
除此之外,在本研究中,A19 疫苗免疫3 月龄犊牛后抗体仅持续60 d,但这并不意味着产生的保护期很短,因为布鲁氏菌疫苗免疫动物产生的免疫抗体与保护力并不是直接相关的,即使免疫抗体消失,免疫动物仍然具有保护力[21]。根据A19 疫苗的使用说明书,该疫苗的保护力可以长达72 个月。
据北京首农食品集团有限公司奶牛场布病净化经验表明:使用A19 疫苗免疫的犊牛,可以终生无需再次免疫该疫苗;对于超过12 月龄的奶牛,免疫时可选用S2 疫苗,但需要每年使用S2 疫苗免疫[22]。在做好养殖场内的生物安全防控措施,避免外源输入感染动物的前提下,连续免疫1~2 个世代(3~6 年),有望实现对奶牛场布病的有效控制。

