雷公藤红素联合米托蒽醌对肝癌细胞增殖和凋亡的影响
李雨晨,牟忠颜,刘玺玉,王洪波,吕剑涛
(1.烟台大学药学院,山东 烟台 264005;2.烟台市中医医院,山东 烟台 264100;3.滨州医学院药学院,山东 烟台 264003;4.滨州医学院烟台附属医院,山东 烟台 264100)
与癌症相关的死亡问题一直是全球健康关注的一个主要问题,当前,癌症死亡仍是世界范围内的主要死亡原因[1],而肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一[2]。HCC患者确诊通常都在晚期,肿瘤表现为肝内或远处器官转移,不适合进行手术治疗。化疗药虽是治疗肿瘤的主要方式,但是大多数化疗药物毒副作用强[3],且耐药性经常发生,这就需要确定增效剂来提高其生物利用度和治疗作用。有研究发现,一些天然药用植物的成分毒副作用较少,且高效、靶点多,可以作为传统或靶向治疗的辅助或者替代手段,克服或弥补化疗药物的劣势。萜类化合物是一类具有治疗活性的植物化学物质,已被用于治疗癌症、心血管和神经退行性疾病[4−5]。雷公藤红素(Celastrol,Cela)是从一种从卫矛科植物雷公藤(Tripterygium wilfordiiHook.f.)中提取的五环三萜类单体化合物,其呈现出广谱、高效的抗肿瘤活性,其抗癌作用已在多种肿瘤的治疗中得到证实,如前列腺癌、肝癌、胶质瘤和乳腺癌等[6−10]。化疗药物米托蒽醌(Mitoxantrone,MIT)具有很好的治疗效果,但其毒副作用和耐药性成为治疗的一大障碍,所以为了克服和弥补这一劣势,本研究选择将其与中药联合,筛选发现Cela与MIT联合使用,效果较佳,并能增强MIT的抗肿瘤活性,并减少了MIT的剂量。
1 材料
1.1 药品与试剂
Cela 标准品(CAS:34157-83-0,纯度 ≥ 98%),购于北京索莱宝科技有限公司,用细胞级DMSO 溶解成5 µmol/L 的储备液,分装于1 mL EP 管中,−20 ℃避光保存。MIT 标准品(CAS:70476-82-3),用细胞级DMSO 溶解成10 µmol/L 的储备液,分装于1 mL EP 管中,−20 ℃避光保存。胎牛血清购于Gibco 公司;DMEM 培养基购于Hyclone 公司;胰酶、四甲基偶氮唑盐试剂(MTT)、Annexin V-FITC/PI 凋亡试剂盒、GAPDH 抗体、二抗山羊抗鼠及山羊抗兔购于上海碧云天生物科技有限公司;抗体Bcl-2、Bax购于Santa Cruz公司。
1.2 细胞
人肝癌HepG2 细胞株,购于中国科学院上海细胞库。
2 方法
2.1 细胞培养
人肝癌HepG2 细胞株在含有10% FBS 和1%三抗(青霉素-链霉素-庆大霉素混合溶液)的DMEM 培养基里复苏培养细胞,并将细胞置于37 ℃、5% CO2的细胞培养箱中进行培养。
2.2 MTT实验
取对数生长期的HepG2 细胞用胰酶进行消化,用DMEM 培养基稀释,以细胞密度为5 × 103个/孔均匀接种于96 孔板中,于培养箱中培养24 h 后分别加入不同浓度的Cela 标准品(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)、MIT 标准品(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)以及含等体积的完全培养基为对照组,每组设5个复孔分别培养24、48 h后,每孔加入5 mg/mL的MTT 溶液20 µL,于培养箱中避光孵育4 h。弃掉上清液,每孔加入100 µL DMSO,于摇床上振荡10 min,用酶标仪570 nm 波长进行吸光度(A)检测,每组实验进行3次重复。按照公式(1)计算出48 h Cela药液抑制率为20%的浓度(即IC20),然后继续取对数生长期的HepG2细胞用胰酶进行消化,用DMEM培养基稀释,以细胞密度为5 × 103个/孔均匀接种于96 孔板中,每孔100 µL,置于37 ℃,5% CO2培养箱中培养,于24 h后分别加入不同浓度的MIT(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)单药组以及不同浓度的MIT(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)与48 h Cela的IC20联合作用组进行对照,每组设置5 个复孔。各组分别培养24、48 h,后面实验步骤同上,同样每组进行3次重复。根据上述操作,选择MIT的合适浓度(浓度最低且联合效果最好的浓度),然后继续取对数生长期的HepG2细胞用胰酶进行消化,用DMEM 培养基稀释,以细胞密度为5 × 103个/孔均匀接种于96孔板中,每孔100 µL,置于37 ℃,5% CO2培养箱中培养过夜。实验分为对照组、Cela 组(0.6 µmol/L)、MIT 组(0.4 µmol/L)、Cela 联合MIT 组(简称联合组。Cela 0.6 µmol/L+MIT 0.4 µmol/L),每组设置5 个复孔。各组分别培养24、48 h,后面实验步骤同上,同样每组进行3 次重复。用金氏公式(公式2)计算Cela 联合MIT是否具有协同作用。

其中,E(A+B)为药物联合的抑制率;EA、EB为单独药物组的抑制率。q> 1.15 为协同作用,q=0.85~ 1.15为相加作用,q< 0.85为拮抗作用。
2.3 细胞集落实验
取对数生长期的HepG2 细胞用胰酶进行消化,用DMEM 培养基稀释,以细胞密度为2 × 103个/孔均匀接种于6 孔板中,于培养箱中培养24 h 后分别加入上述MTT 溶液计算出药液抑制率为20%的浓度,即IC20,0.6 µmol/L Cela、0.4 µmol/L MIT 与联合组为实验组,含等体积的完全培养基为对照组,培养3~ 4 d后更换对应药液进行培养,操作重复3~ 4次后,弃去培养基,用PBS清洗2~ 3次后,每孔加2 mL 4%多聚甲醛进行固定,30 min后吸弃,再用PBS清洗2~ 3次,每孔加入2 mL结晶紫进行染色,30 min后吸取结晶紫进行回收,用PBS清洗残余的结晶紫染液,干燥后拍照计数。实验重复3次。
2.4 Annexin V−FITC/PI双染色法检测细胞凋亡水平
取对数生长期的HepG2 细胞用胰酶进行消化,用DMEM 培养基稀释,以细胞密度为2 × 105个/孔/mL 均匀接种于6孔板中,于培养箱中培养24 h后分别加入上述MTT 溶液计算出药液抑制率为20%的浓度,即IC20,0.6 µmol/L Cela、0.4 µmol/L MIT 与联合组为实验组,含等体积的完全培养基为对照组,作用24 h后,将培养液对应置于1 mL EP管中先存留,使用不添加EDTA的胰酶进行消化后吸弃,再将存留的培养液对应于每孔轻轻吹打,再对应置于EP 管中进行离心,弃上清,加PBS重悬后继续离心弃上清,重复操作1~ 2次后,每个EP 管加入对应试剂盒要求量的缓冲液,根据分组设置加入10 µL 的异硫氰酸荧光素(fluorescein isothiocyanate isomer,Annex V-FITC),10~ 15 min 和避光下加入5 µL 的碘化丙啶(propidium iodide,PI),10~ 15 min 后将EP 管里的液体使用滤膜对应加入96孔板中,使用流式细胞仪进行检测。
2.5 Western blot检测凋亡相关蛋白
取对数生长期的HepG2 细胞用胰酶进行消化,用DMEM 培养基稀释,以适宜的密度接种于直径为60 mm 的培养皿中,于培养箱中培养24 h。细胞贴壁生长融合度达到75%~ 80%后,分别加入上述MTT溶液计算出药液抑制率为20%的浓度,即IC20,0.6 µmol/L Cela、0.4 µmol/L MIT与联合组为实验组,含等体积的完全培养基为对照组,培养24 h 后,使用裂解液(试剂RIPA 与蛋白酶体抑制剂的混匀液体)在冰上裂解15~ 30 min,使其充分裂解后收集细胞,于4 ℃、13 000 r/min离心10 min 后提取蛋白样品,BCA 法定量蛋白浓度。取20 µg 蛋白样品进行上样、电泳、转膜、5%脱脂牛奶封闭2 h,分别加入兔源性Bax和鼠源性Bcl-2、GAPDH一抗(稀释度均为1∶1 000),4 ℃冰箱中孵育过夜。洗膜3 次,每次5 min,加入相对应的二抗(稀释度均为1∶1 000),室温下于摇床上孵育2 h,再次洗膜3 次 × 5 min,在暗室中加入显影剂进行显影。使用Image Lab软件分析条带灰度值。
目的蛋白表达相对强度=目的条带灰度值/GAPDH条带灰度值
2.6 统计学方法
数据采用GraphPad 软件进行统计学分析,数据以±s表示。组间差异的统计学意义采用t检验,P< 0.05为差异具有统计学意义。
3 结果
3.1 对肝癌HepG2细胞增殖能力的抑制作用
MTT 结果显示,不同浓度的Cela(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)处理HepG2 细胞24 h 后,与对照组比较,除0.2、0.4 µmol/L组外,其余各组的存活率显著降低(P< 0.05);处理HepG2 细胞48 h 后,与对照组比较,除0.2 µmol/L组外,其余各组的存活率显著降低(P< 0.05)。见图1。不同浓度的MIT(0.2、0.4、0.8、1.6、3.2、6.4 µmol/L)处理HepG2 细胞24 h 后,与对照组比较,除0.2 µmol/L组外,其余各组的存活率显著降低(P< 0.05);处理HepG2 细胞48 h 后,与对照组比较,其余各组的存活率显著降低(P< 0.05)。见图2。从Cela 的MTT 实验结果中,选择48 h 时Cela 的IC20(0.6 µmol/L)与MIT 各个浓度进行24 h 和48 h 的联合,选择联合后效果最佳且选出的MIT浓度相对较低,与对照组比较,均具有统计学意义(P< 0.05)。见图3。结果显示,MIT 浓度为0.4 µmol/L 时,其浓度最低,联合效果最好。见图4。Cela(0.6 µmol/L)与MIT(0.4 µmol/L)作用HepG2细胞24 h时,q值为2.1;作用HepG2 细胞48 h 时,q值为1.23。结果表明,Cela 能够协同MIT抑制肝癌HepG2细胞增殖。

图1 不同浓度的Cela作用于HepG2细胞24 h和48 h时细胞存活率比较

图2 不同浓度的MIT作用于HepG2细胞24 h和48 h时细胞存活率比较
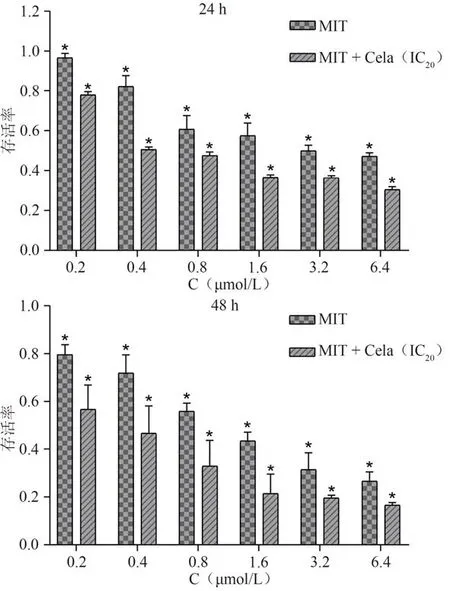
图3 不同浓度的MIT与48 h时Cela的IC20联合作用于HepG2细胞24 h和48 h时细胞存活率比较
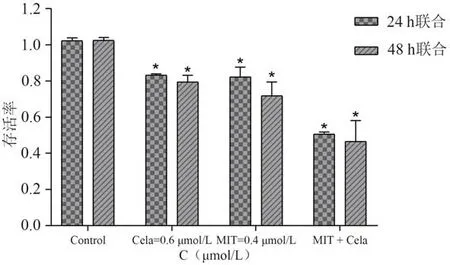
图4 0.6 µmol/L Cela与0.4 µmol/L MIT单独和联合作用于HepG2细胞24 h和48 h时细胞存活率比较
3.2 Cela、MIT 单独及联合用药对肝癌HepG2 细胞集落形成的影响
集落实验可进一步探究Cela、MIT 单独及联合用药对肝癌HepG2 细胞增殖的影响。结果显示,与对照组比较,Cela 组、MIT 组及联合用药组对应的细胞克隆数均减少,差异具有统计学意义(P< 0.05)。且联合组呈倍数减少,与各个单药组比较,差异具有统计学意义(P< 0.05)。见图5。

图5 0.6 µmol/LCela与0.4 µmol/LMIT单独和联合对HepG2细胞的细胞集落形成影响
3.3 Cela、MIT 单独及联合用药促进肝癌HepG2 细胞凋亡
流式细胞术实验研究Cela、MIT 单独及联合用药对肝癌HepG2 细胞凋亡的影响。结果显示,对照组、Cela 组、MIT 组及联合用药组的凋亡率分别为1.56%、16.7%、19.57%、30.17%,给药组与对照组比较,差异具有统计学意义(P< 0.05);且联合组与各单药组比较,差异具有统计学意义(P< 0.05)。见图6。

图6 0.6 µmol/L Cela与0.4 µmol/L MIT单独和联合对HepG2细胞凋亡的影响
3.4 Cela、MIT 单独及联合用药对肝癌HepG2 细胞凋亡相关蛋白表达的影响
Bcl-2、Bax蛋白是与细胞凋亡相关的两个蛋白,为了进一步探索Cela 与MIT 是否通过激活这两个蛋白发挥促凋亡作用,本研究通过Western blot分析其对凋亡相关蛋白Bcl-2、Bax的表达情况,结果见图7。与未经处理的对照组相比,Cela与MIT联合用药,能激活Bcl-2、Bax蛋白的表达,抗凋亡蛋白Bcl-2的表达水平明显下调(P< 0.05),促凋亡蛋白Bax的表达水平明显上调(P< 0.05)。Bcl-2/Bax比值决定着细胞凋亡的走向,其比值上调,抑制细胞凋亡;比值下调,促进细胞凋亡。本实验中Bcl-2/Bax比值下调,表明其可促进肝癌细胞的凋亡,且联合给药组比单独给药组结果更为显著(P< 0.05)。

图7 0.6 µmol/L Cela与0.4 µmol/L MIT单独和联合对HepG2细胞凋亡相关蛋白表达的影响
4 讨论
从天然资源中寻找新的抗肿瘤药物是癌症预防和治疗的重要途径之一,其与化疗药物联合使用降低化疗药物的毒副作用和耐药性也是近年来的研究热点。Cela 是一种从中药雷公藤的根皮中提取的活性化合物,与MIT 联合使用,在治疗肝癌方面,具有较好的协同作用,这一点首先在金氏公式中也得到了验证,表明二者联合具有协同作用。单独使用两者均可以抑制肝癌细胞的增殖,促进肝癌细胞的凋亡,但是两者联合使用,在抑制增殖和促进凋亡方面差异具有统计学意义,对相关凋亡蛋白的表达所显示出来的趋势差异具有统计学意义。
趋化因子受体CXCR4 是趋化因子基质细胞衍生因子-1(CXCL12)的特异受体,CXCR4 及其配体在许多恶性肿瘤的肿瘤进展、血管生成、转移和生存中起着关键作用[11]。此外,炎症、肝纤维化进展、HCC 发展、肝转移等肝脏疾病的发病机制也与CXCR4 的表达密切相关[12]。有研究发现,CXCR4 靶向途径可通过调节肿瘤微环境改善肝纤维化进程,促进索拉非尼在HCC中的治疗效果[13−14]。因此,阻断的CXCR4 信号通路在理论上可以用于癌症治疗和HCC治疗。CHAN等[15]研究发现,Cela 在体内抑制CXCR4 表达以及抑制肝癌肿瘤生长的潜在治疗作用。与之前的报道一致,该研究进一步证明了Cela在体外和体内有诱导肝癌细胞凋亡和抑制生长的能力。
YANG[16]研究结果表明,Cela 是一种天然的蛋白酶体抑制剂,在癌症预防和治疗方面具有很大的潜力。Cela 以肿瘤细胞蛋白酶体为靶点,能够在体内抑制人类肿瘤生长,这一事实有力地支持了使用蛋白酶体抑制剂作为新型抗癌药物的概念证明[17−18]。进一步的研究应从如何使用Cela,或设计、合成和评估更强的、选择性的Cela类似物下手。
综上,雷公藤红素和米托蒽醌联合使用,可以减少化疗药物米托蒽醌的剂量,降低其毒副作用和长期使用化疗药物所带来的耐药性,并且本研究首次提出使用雷公藤红素和米托蒽醌联合使用具有协同作用,并且进一步在实验中得到验证,证明两者联合具有抑制增长、促进凋亡的作用,且抑制增殖的作用可能与诱导凋亡有关,分子机制有待进一步研究。

