基于凝血酶诱导自噬探讨化瘀解毒法对缺血性中风(瘀毒互结证)大鼠的影响
马若梦,邓奕辉,彭珣,李钰佳,阳晶晶,李定祥✉
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208)
全球范围内,卒中作为仅次于缺血性心脏病的第二大三级死亡原因[1],其特征是急性脑部血液循环障碍,导致长期残疾和死亡,该病严重影响幸存者的生活质量[2]。其中缺血性卒中约占所有卒中的87%[3]。中医称该病为“中风”病,病机不外乎风、火、痰、瘀、虚五端。本课题组以传统中医基础理论为指导,结合前期研究基础和各类成果,提出了本病新的病机理论,可概括为“瘀血阻滞,毒损脑络”[4−8],确立以化瘀解毒为治疗大法[9],并创立化瘀解毒方。
凝血酶是一种凝血因子,通过介导纤维蛋白原转化为纤维蛋白,在止血中起核心作用。凝血酶生成水平和活性在急性缺血性脑卒中与脑梗死严重程度明显相关[10]。自噬在细胞稳态中发挥着重要作用,并参与了许多人类疾病的过程[11−12]。除了营养因子缺乏、生长因子撤离、高温、缺氧及激素刺激可诱导自噬的发生之外[13],凝血酶也可诱导脑内自噬的发生,从而加重脑损伤[14−16]。本课题组前期研究发现,凝血酶与自噬指标LC3Ⅱ/Ⅰ呈高度相关,在7 个不同缺血时相的动态变化规律相似。因此,本文从凝血酶诱导自噬从而介导脑损伤的角度,探讨化瘀解毒法对缺血性中风(瘀毒互结证)的干预作用。
1 材料与方法
1.1 实验动物
健康SPF 级雄性大鼠116 只,体质量220~240 g,购买于湖南斯莱克景达动物有限公司,动物许可证号:SCXK(湘)2019-0004。于湖南中医药大学动物中心饲养,实验动物环境设施合格证号:SYXK(湘)2015-0003,饲养及手术环境温度控制在20~25 ℃,相对湿度50%~70%。
1.2 药物及制备
化瘀解毒方组方:黄芪40 g,川芎15 g,僵蚕10 g,地龙10 g,黄连5 g,黄芩5 g,栀子5 g,由湖南中医药大学第一附属医院门诊部提供。采用水浸泡中药饮片40 min 左右,先武火煮沸,再文火熬制30 min,取药渣按前法再煎煮1 次,两次所得药液混匀、过滤,浓缩为2 g/mL,于4 ℃保存。阿加曲班单水合物(阿拉丁公司,批号:A151030-100 mg)作为阳性对照组,用DMSO 将阿曲班单水合物溶解并按稀释3 倍标准,加入β-CD生理盐水稀释。
1.3 试剂与仪器
Anti-Thrombin 抗体(美国Abcam 公司,批号:Ab92621);LC3B 抗体(美国Proteintech 公司,批号:14600-1-AP);环氧丙烷(上海迈瑞尔化学公司,货号:M25514);锇酸(TED PELLA INC,货号:18456);戊二醛(雷根,货号:DF0156);透射电子显微镜(日本电子,批号:JEM1400);摇床(其林贝尔,货号:TS-92)。
1.4 分组和给药
依据随机数字表将116 只大鼠随机分为假手术组(SHAM 组),模型组(瘀毒互结缺血性中风病证结合组,简称IS-YD 组),化瘀解毒方组(HJF 组),阿加曲班组(ARG组)。按不同的缺血时相再分为IS-YD 12 h组、IS-YD 24 h组、HJF 12 h组、HJF 24 h组、ARG 12 h组、ARG 24 h 组,共7 组,其中假手术组8 只大鼠,其余每组各18只大鼠。大鼠适应性喂养3 d后,于第4天开始给药,HJF 组以11.33 g/(kg·d)剂量灌胃化瘀解毒方,ARG 组以11.16 mg/(kg·d)剂量灌胃阿加曲班单水合物,均为预防性给药,每天1 次,连续7 d。假手术组和模型组分别灌服等量的生理盐水。除假手术组外,其余各组使用角叉菜胶联合干酵母混悬液注射的方法,制备瘀毒互结模型[17]。于第4 天灌胃中药,腹腔注射角叉菜胶50 mg/kg,每天1 次,连续3 d,第4 天,皮下注射干酵母混悬液10 mL/kg。末次灌胃后24 h进行造模,造模前12 h大鼠禁食、不禁水。
1.5 缺血性中风瘀毒互结证(IS-YD)模型制备
参考文献[18]提出的可逆性大脑中动脉闭塞(MCAO)线栓法改良制作。选取体质量220~240 g 的雄性SD大鼠,术前用10%水合氯醛按照0.35 mL/100 g剂量腹腔注射进行麻醉。于颈部正中稍右侧作切口,钝性分离皮下组织,在靠近气管肌旁,用黑色缝合线分离出与迷走神经并行的右颈总动脉(CCA),分离颈内动脉(ICA)与颈外动脉(ECA),于颈总动脉近心端插入头端用石蜡包被的单丝尼龙鱼线,长度自CCA 分叉处约18~20 mm。假手术组除了不插入栓线,其余操作同模型组。术中需记录插入栓线的时间,以此来确定缺血时相和取材时间。术后将大鼠置于饲养笼里,自由进食和饮水。
1.6 神经功能缺失评分
待动物清醒后,参照ZEA LONGA 评分标准对动物进行神经功能缺失评分(NIHSS评分)。0分:无神经功能缺损;1 分:不能完全伸展左侧前爪;2 分:向左侧转圈;3 分:向左侧倾倒;4 分:不能自发行走且意识水平低下。1~3分为造模成功,否则弃之不用。
1.7 标本采集与处理
1.7.1 取出完整脑组织
按组别选取20 只大鼠麻醉后,冰盒上快速断头,取出完整的脑组织,于−20 ℃速冻30 min,备用进行TTC 染色。再选取38 只大鼠进行麻醉,断头去脑,取出完整脑组织,置于多聚甲醛溶液中固定,备用进行HE染色。
1.7.2 分离出皮质、海马
将术后苏醒的38 只大鼠逐个进行神经功能缺失评分并作记录,分别于缺血后12、24 h用水合氯醛麻醉大鼠,快速断头取脑分离出大脑皮质和海马,存放在−80 ℃冰箱里。用药组于最后一次灌胃24 h 后处死大鼠,断头去脑,同样分离出大脑皮质和海马,备用进行Western blot 检测。按组别选取20 只进行麻醉处死后断头取脑,分离出皮质和海马,置于电镜固定液中避光保存,等待透射电镜观察处理。
1.8 指标检测
1.8.1 大鼠神经功能评分
待动物清醒后,参照ZEA LONGA 评分标准,于各组随机抓取5只大鼠做神经功能缺失评分。
1.8.2 TTC染色观察大鼠脑梗死体积占比
于−20 ℃冰箱中取冰冻鼠脑,置于脑槽为2 mm的脑切片模具中,在额极与枕极处放置两片刀片以固定大脑,从视交叉处额极到枕极处连续切5 片,厚度均为2 mm,将切片转移至2% TTC 溶液中染色,染色后梗死区变为白色,非梗死区呈现红色,为使每片脑片染色均匀,37 ℃水浴锅中孵育15 min,且每5 min翻面,后于多聚甲醛溶液中固定,24 h 后拍照,拍照注意采用统一角度和高度,尽量保证统一光线。最后使用Image Pro Plus6.0 软件分析计算脑梗死体积占比。
梗死体积占比(%)=梗死体积/整脑体积 × 100%
1.8.3 苏木素-伊红(HE)染色法观察缺血侧大脑皮质、海马病理形态改变
将完整脑组织取出之后,放入4 %多聚甲醛溶液中固定,石蜡包埋,切成超薄片,脱蜡,染色,脱水,透明,封片,显微镜观察并采集图像。
1.8.4 Western blot 法检测缺血侧大脑皮质、海马凝血酶、LC3Ⅱ/Ⅰ的表达
分别剪取50 mg 的皮质和海马组织,加入500 µL裂解液(RIPA∶蛋白酶抑制剂=50∶1),于4 ℃预冷的生物样品均质量仪中反复研磨充分裂解,4 ℃,12 000 r/min离心10 min;得到上清液。取100 µL 蛋白原液,加入25 µL 5 × loading buffer 混匀,沸水煮15 min。点样、电泳、转膜封闭后进行孵育抗体,LC3B 兔抗(1∶2000)、Thrombin 兔抗(1∶1 000)、β-actin 鼠抗(1∶5 000),将膜与一抗一起孵育,4 ℃过夜,HRP 标记的二抗(1∶8 000)次日孵育。
1.8.5 透射电子显微镜观察缺血侧大脑皮质、海马自噬超微结构
按照固定、脱水、浸透、包埋、切片、染色、拍照的顺序进行操作。
1.9 统计学方法
采用SPSS 25.0 软件统计数据,数据以均数 ± 标准差(±s)表示。组间比较采用单因素方差分析,方差齐者,组间两两比较采用LSD 或SNK 法,方差不齐者,则选用Games-Howell 方法两两比较;若不符合正态性分布,则采用多样本秩和检验,即Kruskal-Wallis单因素ANOVA 分析。P< 0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠神经功能评分比较
在缺血后12、24 h,与SHAM 组比较,IS-YD 组大鼠出现明显的神经功能缺损症状,表现为左侧前爪内收、提尾时向左侧转圈,向左侧倾倒等,神经功能缺失评分升高(P< 0.01);与IS-YD组相较,ARG组和HJF组大鼠神经功能缺失评分显著降低(P< 0.01)。说明化瘀解毒方、阿加曲班可以减轻IS-YD大鼠的神经功能缺损症状。结果见表1。
表1 各组大鼠缺血后12、24 h神经功能评分比较(±s)

表1 各组大鼠缺血后12、24 h神经功能评分比较(±s)
注:与SHAM组比较,**P < 0.01;与IS-YD 12 h组比较,#P < 0.05;与IS-YD 24 h组比较,&P < 0.05。
2.2 各组大鼠脑梗死体积比较
在缺血后12 h,与SHAM 组比较,IS-YD 组、HJF组、ARG 组的大鼠脑梗死体积占比均明显增高(P< 0.01);与IS-YD组相较,ARG组和HJF组大鼠脑梗死体积占比显著降低(P< 0.05,P< 0.01)。在缺血后24 h,与SHAM 组比较,IS-YD 组、HJF组、ARG 组的大鼠脑梗死体积占比均明显增高(P< 0.01)。给药后,与模型组比较,ARG 组和HJF 组大鼠脑梗死体积占比显著降低(P< 0.05)。说明化瘀解毒方、阿加曲班可以降低IS-YD大鼠脑梗死体积。结果见图1、图2。
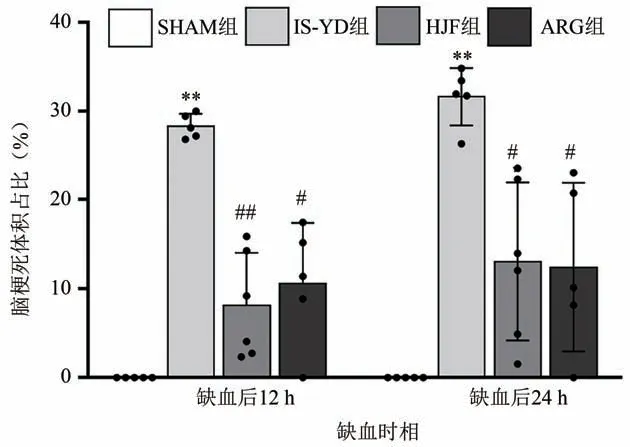
图1 两个时间点各组大鼠脑梗死体积占比比较
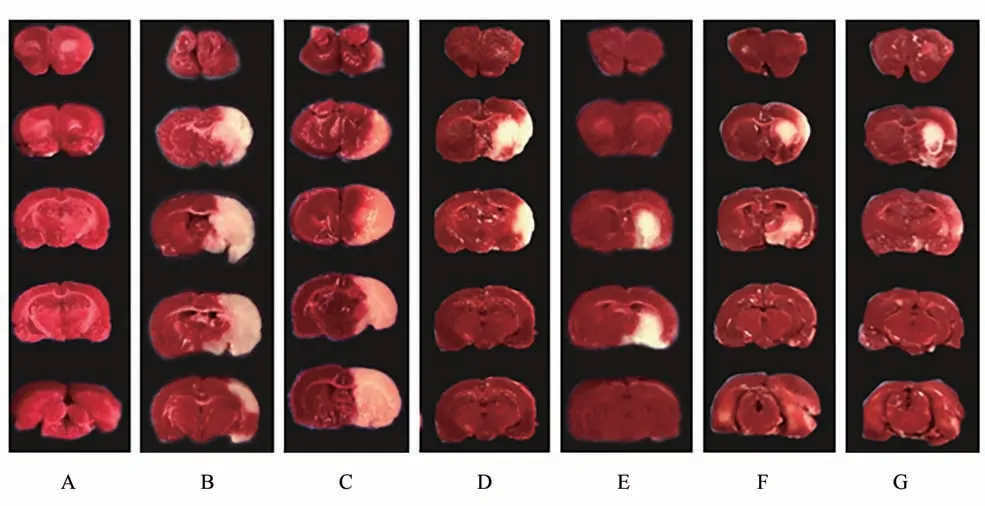
图2 各组大鼠TTC染色结果比较
2.3 各组大鼠缺血侧皮质和海马病理形态学比较
2.3.1 缺血侧皮质病理形态比较
SHAM 组大脑皮质区神经元细胞排列密集,胞浆丰富,染色均匀呈粉红色,细胞核居中大且圆,核仁明显,间质正常;与SHAM 组比较,IS-YD 12 h、ISYD 24 h 组脑组织缺血侧的大脑皮质区形态被明显破坏,可见大片神经元坏死,排列稀疏、紊乱,细胞核皱缩或碎裂,胞浆浓缩染色加深,核仁不清,间质水肿疏松,缺血区呈空泡样变化。与模型组比较,HJF组和ARG 组以上部位病理形态损伤轻微,神经元损伤程度降低,细胞染色较均匀,形态规整,排列较为整齐致密,空泡样改变也较模型组均减轻。结果见图3。

图3 各组大鼠缺血侧大脑皮质区的HE染色图(×200)
2.3.2 各组大鼠缺血侧海马区病理形态的比较
SHAM 组大脑海马区神经细胞排列整齐,胞体形态规则,神经细胞呈圆形或锥形,胞浆丰富,胞质染色均匀,细胞核着色均匀呈蓝紫色,核仁清晰。与SHAM组比较,IS-YD 12 h、IS-YD 24 h 组大鼠海马区神经元细胞排列紊乱、部分细胞形态不规则、细胞核固缩且深染,神经元损伤多集中在CA2区;相应时间点的HJF和ARG 组大鼠海马区神经元损伤相对轻微,表现为细胞形态异常、细胞核固缩或溶解碎裂的数量有所减少。结果见图4。
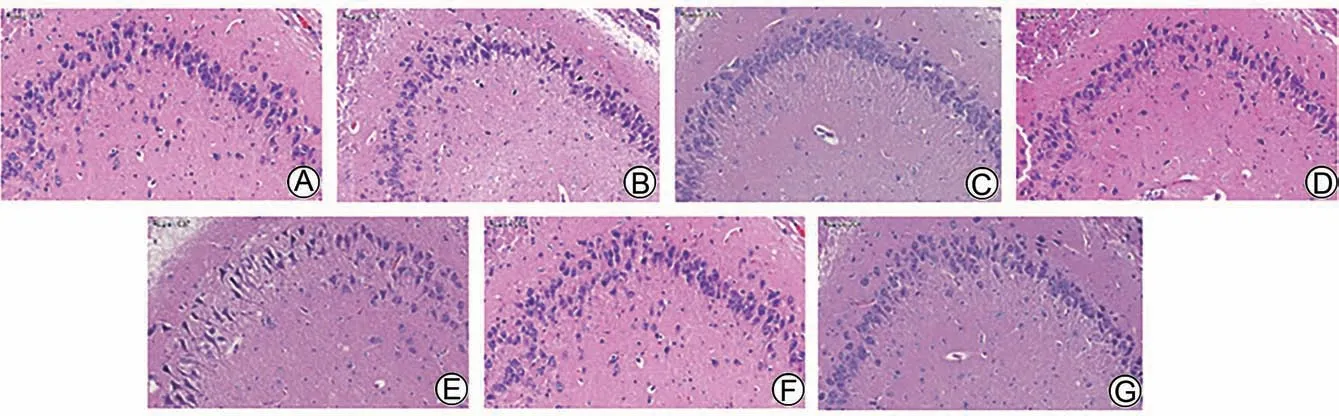
图4 各组大鼠缺血侧大脑海马区的HE染色图(× 200)
2.4 各组大鼠缺血侧皮质和海马凝血酶、LC3Ⅱ/Ⅰ表达比较
2.4.1 缺血侧皮质、海马区凝血酶表达比较
在缺血后12 h,与SHAM 组比较,IS-YD 组的凝血酶蛋白表达均明显升高,差异具有统计学意义(P< 0.01)。与IS-YD 组比较,ARG 组两个脑区的凝血酶蛋白表达显著下降(P< 0.01),HJF 组皮质区(P< 0.01)和海马区(P< 0.05)凝血酶蛋白表达水平也同样下降;在缺血后24 h,与SHAM 组比较,ISYD 组的凝血酶蛋白表达均明显升高,差异具有统计学意义(P< 0.01)。与IS-YD 组相较,ARG 组两个脑区的凝血酶蛋白表达显著下降(P< 0.01),而HJF组皮质区(P< 0.05)和海马区(P< 0.01)凝血酶蛋白表达水平也降低。说明化瘀解毒方、阿加曲班可以抑制皮质区凝血酶、LC3 Ⅱ/Ⅰ的表达。结果见图5~图7。

图5 两个缺血时间点各组大脑皮质区凝血酶蛋白表达水平比较
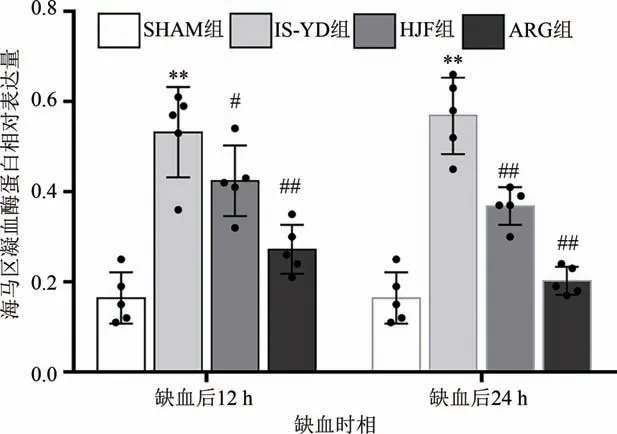
图6 两个缺血时间点各组大脑海马区凝血酶蛋白表达水平比较

图7 两个缺血时间点、两个脑区凝血酶的表达水平
2.4.2 缺血侧皮质、海马区LC3Ⅱ/Ⅰ表达比较
在缺血后12 h,与SHAM 组比较,IS-YD 组的大鼠大脑皮质、海马区的LC3Ⅱ/Ⅰ比值表达均明显升高,差异具有统计学意义(P< 0.01)。与IS-YD 组比较,ARG 组两个脑区的LC3Ⅱ/Ⅰ比值表达显著下降(P< 0.01),HJF 组皮质区(P< 0.05)和海马区(P< 0.01)LC3Ⅱ/Ⅰ比值表达水平也同样下降;在缺血后24 h,与SHAM 组比较的结果同上。与IS-YD 组相较,HJF 组和ARG 组两个脑区的LC3Ⅱ/Ⅰ比值表达显著下降(P <0.01)。说明化瘀解毒方、阿加曲班可以抑制海马区凝血酶、LC3Ⅱ/Ⅰ的表达。结果见图8~图10。
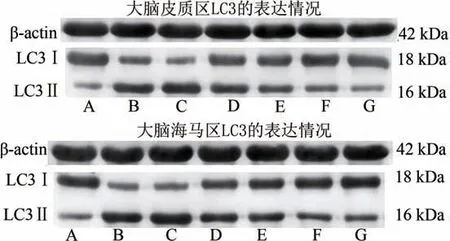
图8 两个缺血时间点、两个脑区LC3Ⅱ/Ⅰ比值的表达水平
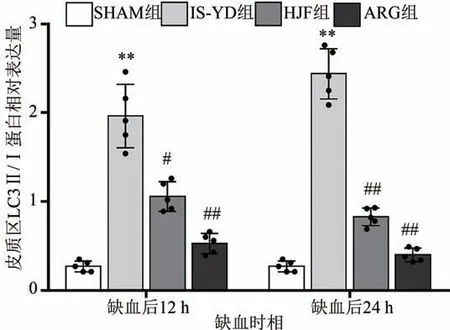
图9 两个缺血时间点各组大脑皮质区LC3Ⅱ/Ⅰ表达水平比较

图10 两个缺血时间点各组大脑海马区LC3Ⅱ/Ⅰ表达水平比较
2.5 各组大鼠皮质和海马区自噬超微结构比较
SHAM 组皮质和海马区可见少量的自噬小体,未见明显的自噬溶酶体及吞噬泡;IS-YD 12 h 组、ISYD 24 h 组发生自噬较严重,可见明显的自噬小体、自噬溶酶体。与模型组比较,HJF组和 ARG组可见自噬小体、自噬溶酶体显著减少,并未见吞噬泡。说明化瘀解毒方、阿加曲班可以抑制模型大鼠大脑缺血侧皮质、海马区自噬的发生。结果见图11、图12。
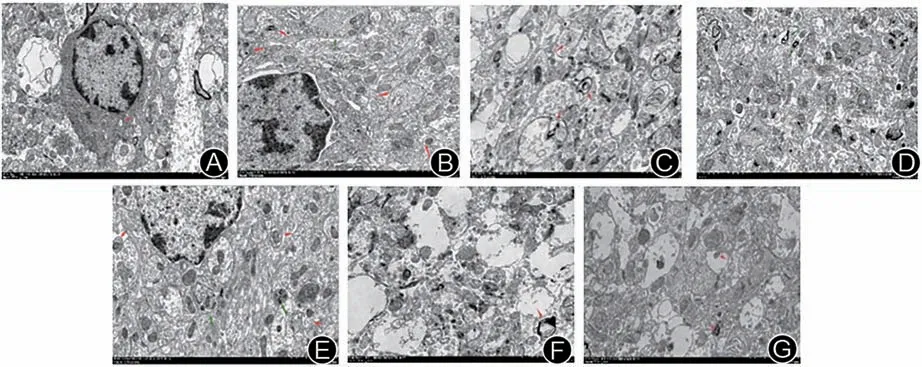
图11 各组大鼠缺血侧大脑皮质区的自噬超微结构(× 6 000)

图12 各组大鼠缺血侧大脑海马区的自噬超微结构(× 6 000)
3 讨论
凝血酶在凝血级联反应被激活过程中,由不具备活性的前体凝血酶原裂解形成[19],主要发挥止血功能[20]。研究发现,凝血酶原的表达存在于神经元和星形胶质细胞中[21−22]。生理水平的凝血酶影响神经的发育和保护[23],促进脑组织活力,且对兴奋性毒性有害因子有保护作用[24]。而高剂量的凝血酶则具有神经毒性,能破坏血管,引发氧化应激,可促进内皮细胞、小胶质细胞和星形胶质细胞的炎症反应[25]。高水平的凝血酶活性不仅是有害的,且缺血半球的凝血酶活性和梗塞体积之间具备显著相关性[10]。
自噬是大多数真核生物在进化上高度保守的细胞行为,是自噬溶酶体系统对细胞质内异物、受损或老化细胞器的吞噬降解过程。通过及时清除受损细胞器,对维持细胞的自稳状态发挥重要作用。有证据表明[26−28],自噬可参与脑卒中的发生和发展,在缺血性脑损伤期间被激活并且参与神经元死亡的调节。然而自噬的作用复杂,其活性的增强在脑缺血过程中起有益作用还是有害作用尚未有定论且存在争议,研究显示,自噬在脑缺血发生和发展过程中,起到的是“双刃剑”的作用[29]。适当的自噬可以降解细胞自身内容物供周围细胞利用,挽救由于缺血濒临死亡的细胞,但另一方面,过度的自噬会导致细胞大量死亡。
营养因子缺乏、高温、缺氧、激素刺激,可诱导自噬的发生[13],凝血酶也可诱导细胞自噬的发生[13−14,30]。HU等[14]研究发现,人耳内注射凝血酶能特异性地提高Beclin 1 和LC3 这两种自噬标记物在星形胶质细胞表达,并促进星形胶质细胞内而非神经元内自噬空泡的形成。在同侧基底节中,耳内注射凝血酶可增加LC3Ⅰ向LC3Ⅱ的转化、组织蛋白酶D 水平和自噬空泡的形成。MU 等[31]采用动物实验研究发现,脑出血患者血浆凝血酶-抗凝血酶(TAT)复合物浓度与脑出血严重程度呈正相关,且血肿周围区域的神经元存在自噬,凝血酶可能参与了这些神经元自噬的激活。亦有研究发现,缺血再灌注诱导的星形胶质细胞中的炎症因子分泌、氧化应激和自噬均可被凝血酶加重,而SPRED2 基因敲除可抑制凝血酶。证明凝血酶通过激活SPRED2 介导的自噬作用加重星形胶质细胞的缺血再灌注损伤[32]。提示凝血酶可激活脑内自噬,加重脑损伤。
本课题组前期探讨了缺血性脑卒中进展过程中凝血酶、自噬相关蛋白LC3Ⅱ/Ⅰ在缺血2、4、8、12、24、48、72 h 7 个缺血时间点的动态变化,发现缺血性脑卒中后凝血酶与自噬相关蛋白LC3Ⅱ/Ⅰ的表达呈正相关,皮质凝血酶与 LC3Ⅱ/Ⅰ的密切程度为56.7%,海马二者的密切程度为 53.3%。且均在缺血12、24 h 达到高值,由此证明了凝血酶、自噬、缺氧缺血性脑损伤的变化三者之间均具有时间依赖性,同时为进一步研究治疗脑梗死筛选了最佳药物反应时间点,可用于指导下一阶段中药复方的干预。且高水平的凝血酶活性、过度发生的自噬会促进大鼠神经功能缺损,加重脑梗死体积占比。
本实验采用阿加曲班作为阳性对照药物,探讨了化瘀解毒方对IS-YD大鼠的干预作用。结果表明,化瘀解毒方可显著降低模型大鼠神经功能评分和脑梗死体积占比,改善缺血侧脑区病理形态学变化。此外,化瘀解毒方可抑制大鼠大脑皮质和海马区的凝血酶活性,下调相应脑区自噬指标LC3Ⅱ/Ⅰ的表达,并减少脑区自噬小体、自噬溶酶体、吞噬泡的数量。故认为化瘀解毒方可能是通过抑制凝血酶的活性,下调了自噬的发生,从而减轻神经功能损伤,发挥抗脑缺血作用。

