白花蛇舌草的化学成分研究
于亮, 杨帅, 黄祝刚, 刘勇, 蒋海强, 吕青涛*
白花蛇舌草的化学成分研究
于亮1,2, 杨帅1,2, 黄祝刚2, 刘勇2, 蒋海强2, 吕青涛2*
(1. 山东省药学科学院, 山东省化学药物重点实验室,济南 250101;2. 山东中医药大学药学院,济南 250355)
为研究白花蛇舌草()的化学成分,采用硅胶柱色谱、制备HPLC色谱等方法,从白花蛇舌草全草的70%乙醇提取物中分离得到9个化合物。根据理化性质及其波谱或光谱数据,结构分别鉴定为:豆甾醇(1)、-谷甾醇(2)、rubiadin (3)、2,6-二羟基-1-甲氧基蒽醌(4)、-谷甾醇-3---d-葡萄糖苷(5)、对香豆酸(6)、山奈酚(7)、槲皮素(8)和2-羟基-3-甲氧基-7-甲基蒽醌(9)。化合物4为新化合物;氯仿提取部位的Fr.4、Fr.4-2及Fr.4-4流分具有较强体外抗人子宫内膜癌Ishikawa细胞活性,其IC50值分别为52.8、78.1和27.5g/mL。
白花蛇舌草;化学成分;2,6-二羟基-1-甲氧基蒽醌;抗子宫内膜癌活性
白花蛇舌草()为茜草科(Rubi- aceae)耳草属植物, 全草具有清热、解毒、消肿、止痛之功效[1],主要用于抗癌治疗[2],含有三萜类、蒽醌类、环烯醚萜类、甾醇类、香豆素类、黄酮类、烷烃类等化学成分[3]。前期用MTT法进行的药理实验结果表明,白花蛇舌草氯仿提取部位具有较强的体外抗子宫内膜癌Ishikawa细胞活性, IC50值为113.0g/mL。为探究其抗癌有效成分,本文对该植物氯仿等提取部位的化学成分进行了系统分离,从全草中分离得到9个化合物(图1),为深入研究白花蛇舌草的药理作用提供科学依据。
1 材料和方法
1.1 材料
白花蛇舌草药材(购自济南建联中药店,批号: 20120730,20130201),经山东中医药大学中药鉴定教研室李峰教授鉴定为茜草科耳草属白花蛇舌草()的干燥全草。

图1 化合物1~9 的结构
1.2 仪器和试剂
Bruker AM-400/600型核磁共振仪(德国Bruker公司);Q Exactive™组合型四极杆Orbitrap质谱仪(美国赛默飞世尔科技公司);显微熔点仪(XRC-1, 四川大学科仪厂);柱色谱硅胶(100~200、200~300目,青岛海洋化工有限公司);高效液相色谱仪(1200, 美国安捷伦公司);Eclipse XDB-C18高效液相制备柱(5m, 9.4 mm×250 mm,美国安捷伦公司);粉碎机(AZL-600Y,永康市艾泽拉仪器有限公司);EYELA旋转蒸发仪(日本东京理化器械株式会社);多功能酶标仪(美国MD Spectra M5)。石油醚、氯仿、乙酸乙酯、二氯甲烷、甲醇、乙醇等试剂均为分析纯。
1.3 提取和分离
干燥白花蛇舌草药材15 kg,粉碎,70%乙醇回流提取3次(药材与乙醇质量比=1:7),每次1.5 h。抽滤、减压浓缩、离心弃去沉淀,依次用石油醚、氯仿、乙酸乙酯萃取,减压浓缩,依次得到浸膏8、75和92 g。
取氯仿部位浸膏,以二氯甲烷:甲醇=300:0、300: 1、60:1、30:1、15:1、3:1、0:1梯度洗脱,得到7个流分(Fr.1~Fr.7)。Fr.3流分以石油醚:乙酸乙酯=60:1,30:1,9:1,3:1,1:1,1:3梯度洗脱,得到Fr.3-1~Fr.3-4流分。Fr.3-2流分挥干溶剂后得无色结晶,以石油醚:丙酮=4:1洗脱,得到化合物1 (10 mg)和化合物2 (11 mg)。Fr.4流分以石油醚:乙酸乙酯=60:1、30:1、15:1、8:1、4:1、2:1、1:1、0:1梯度洗脱,得到Fr.4-1~ Fr.4-4流分。取Fr.4-2流分析出的黄色沉淀,应用高效液相制备,得到化合物3 (11 mg)(流动相为甲醇:水=70:30~100:0)。Fr.5流分以石油醚:乙酸乙酯= 100:0、100:1、50:1、30:1、10:1、3:1梯度洗脱, 得到Fr.5-1~Fr.5-6流分。Fr.5-3流分以石油醚:乙酸乙酯=30:1、20:1、15:1、10:1、8:1、5:1、3:1梯度洗脱得到Fr.5-3-1~Fr.5-3-4流分。Fr.5-3-3流分应用高效液相制备(流动相为:乙腈:水=35:65), 得到化合物4 (11 mg)。
取乙酸乙酯部位浸膏,以二氯甲烷:甲醇(150:1~ 1:1)进行分级洗脱,得到Fr.1~Fr.5共7个流分。取Fr.3流分,以二氯甲烷:甲醇(45:1~1:1)进行分级洗脱,得到Fr.3.1~Fr.3.7流分和化合物5 (16 mg)。Fr.3.2、Fr.3.3和Fr.3.5流分经Sephadex LH-20凝胶柱色谱和重结晶得化合物6 (10 mg)、7 (24 mg)和8 (22 mg)。
取石油醚部位浸膏,以二氯甲烷:甲醇(99:1~9:1)进行梯度洗脱,得到A~E共5个流分。D馏分经反复硅胶柱色谱分离和高速逆流色谱分离,重结晶, 得到化合物9 (7 mg)。
1.4 结构鉴定
化合物1 无色针状结晶,10%硫酸-乙醇显色为紫红色,Liebermann-Burchard反应呈阳性。UHPLC-QE/MS/MS: 413.38 [M + H]+; m.p: 147 ℃~149 ℃;1H NMR (400 MHz, CDCl3+DMSO):0.70、0.80, 0.82, 0.85, 1.01, 1.02 (6CH3), 3.51 (m, H-3), 5.35 (d,= 5.2 Hz, H-6), 5.00 (dd,= 15.2, 8.8 Hz, H-23), 5.15 (dd,= 15.2, 8.8 Hz, H-22);13C NMR (100 MHz, CDCl3+DMSO):37.30 (C-1), 31.66 (C- 2), 71.62 (C-3), 42.32 (C-4), 140.94 (C-5), 121.54 (C- 6), 31.87 (C-7), 31.91 (C-8), 50.18 (C-9), 36.54 (C- 10), 21.07 (C-11), 39.70 (C-12), 42.23 (C-13), 56.88 (C-14), 24.36 (C-15), 28.90 (C-16), 55.97 (C-17), 12.05 (C-18), 19.41 (C-19), 40.47 (C-20), 21.21 (C- 21), 138.31 (C-22), 129.28 (C-23), 51.23 (C-24), 31.90 (C-25), 18.99 (C-26), 21.21 (C-27), 25.39 (C- 28), 12.24 (C-29)。以上波谱数据与文献[4]报道一致,故鉴定为豆甾醇。
化合物2 无色针状结晶, m.p: 140 ℃~142 ℃。10%硫酸-乙醇显色为紫红色, Liebermann-Burchard反应呈阳性。UHPLC-QE/MS/MS: 415.41 [M + H]+;1H NMR (600 MHz, CDCl3)中有6个甲基单峰信号(: 0.68、0.80、0.85、0.92、0.93和0.98);13C NMR (100 MHz, CDCl3)中有29个碳的吸收峰, 其中在: 11.83、11.98、18.74、19.00、19.40和20.00有6个甲基碳的吸收峰。经分析, 该化合物与-谷甾醇对照品共同薄层展开后, 用硫酸-乙醇显色, 两者Rf值一致,且与-谷甾醇对照品混合后,熔点不降。以上波谱数据与文献[5]报道一致,故鉴定为-谷甾醇。
化合物3 黄色针状结晶, 硅胶薄层板展开, 氨熏后显红色, Borntrager’s反应阳性。m.p: 249℃~ 250 ℃; UHPLC-QE/MS/MS: 255.07 [M + H]+;1H NMR (DMSO-6, 400 MHz):7.25 (1H, s, H-4), 8.14 (1H, d,= 7.2 Hz, H-5), 7.90 (2H, m, H-6, 7), 8.21 (1H, d,= 7.2 Hz, H-8), 2.08 (3H, s, CH3), 13.16 (1H, s, 1-OH), 11.36 (1H, s, 3-OH);13C NMR (DMSO-6, 100 MHz):8.57 (-H3), 108.25 (C-4), 109.20 (C- 9a), 117.73 (C-2), 126.82 (C-8), 127.17 (C-5), 132.26 (C-8a), 133.42 (C-10a), 133.65 (C-4a), 134.82 (C-7), 135.02 (C-6), 162.97 (C-3), 164.08 (C-1), 182.47 (C- 10), 186.40 (C-9)。以上波谱数据与文献[6]报道一致, 故鉴定为甲基异茜草素(rubiadin)。
化合物4 黄色片状结晶, 硅胶薄层板展开, 氨熏后显红色, Borntrager’s反应阳性, AlCl3反应呈阴性。UHPLC-QE/MS/MS: 271.06 [M + H]+; m.p: 301 ℃~303 ℃;1H NMR (600 MHz, DMSO-d6):10.87 (1H, s, 2-OH), 10.75 (1H, s, 6-OH), 8.02 (1H, d,= 8.4 Hz, H-8), 7.89 (1H, d,= 8.4 Hz, H-4), 7.42 (1H, d,= 2.4 Hz, H-5), 7.28 (1H, d,= 8.4 Hz, H-3), 7.20 (1H, dd,= 8.4, 2.4 Hz, H-7), 3.81 (3H, s, -OCH3);13C NMR (150 MHz, DMSO-6):181.76 (C-10), 181.24 (C-9), 162.71 (C-6), 158.24 (C-2), 147.79 (C-1), 134.78 (C-10a), 129.81 (C-8), 126.92 (C-9a), 126.85 (C-8a), 126.05 (C-4a), 125.09 (C-4), 121.39 (C-7), 121.01 (C-3), 111.57 (C-5), 60.69 (-OCH3)。13C NMR谱和DEPT谱表明化合物4有15个碳原子,其中1个甲基(CH3),0个亚甲基(CH2),5个次甲基(CH)和9个季碳(C)。13C NMR谱中110~ 185 ppm间14个碳的是蒽醌母核的化学位移[7], 且2个羰基碳的化学位移为181.76和181.24;1H NMR谱表明,取代基共有3个,分别为2个-OH (氢的化学位移分别为10.87和10.75)、1个-OCH3(氢的化学位移为3.806)。蒽醌母核上有1氢(: 7.195, 1H, dd,= 8.4, 2.4 Hz)裂分为4重峰,说明母核上此氢与邻位氢和另一侧的间位氢分别有耦合效应; 另由耦合常数为8.4 Hz的H峰共有4个,故有2对H处于邻位,这与1H-1H COSY谱相吻合。因此推断出蒽醌母核右环(A环)为邻位的,-H之间的耦合,蒽醌母核左环(C环)为2个-H和1个-H之间的耦合。由化合物的AlCl3反应呈阴性可知, 结构中没有-酚羟基,因此可推断出结构中-OCH3只能位于母核的1位,母核上2位的基团只能为-OH,另一-OH只能在6位或7位上,即结构只能为图2中显示的2种可能。由HMBC谱得知,化学位移为181.24的羰基碳只与母核H-8 (: 8.02, d,= 8.4 Hz)有远程耦合关系,说明此羰基碳(C-9)与取代基-OCH3更为邻近;另一化学位移为181.76的羰基碳(C-10)与母核H-4 (: 7.89, d,= 8.4 Hz)和H-5 (: 7.42, d,= 2.4 Hz)分别有远程耦合关系,表明此羰基碳(C-10)与母核C环上的取代基更为邻近,故母核上6位的基团只能为剩余取代基-OH。故结构式只能是图2中的第1种,且5、7、8位的碳氢归属与HSQC谱吻合。故鉴定为2,6-二羟基-1-甲氧基蒽醌(图3, 表1)。
化合物5 白色粉末, 10%硫酸-乙醇显色为紫红色, Molish反应呈阳性。UHPLC-QE/MS/MS: 577.45 [M + H]+;1H NMR (400 MHz, DMSO-d6):0.66 (3H, s, C18-H), 1.23 (3H, d,= 3.6 Hz, C21-H), 1.15 (3H, s, C19-H), 0.96 (3H, s, C25-H), 0.91 (3H, s, C29-H), 0.82 (3H, s, C27-H), 4.42 (H, t,=5.6 Hz, C4′- H), 5.33 (H, d,= 5.6 Hz, C1′-H)。13C NMR (100 MHz, DMSO-6):141.11 (C-5), 121.64 (C-6), 101.32 (C- 1′), 77.45 (C-3), 77.26 (C-2′), 77.21 (C-5′), 73.94 (C- 2′), 70.57 (C-4′), 61.58 (C-6′), 56.67 (C-14), 55.94 (C- 17), 50.10 (C-9), 45.85 (C-24), 42.34 (C-13), 39.61 (C-12), 38.81 (C-4), 37.32 (C-1), 36.69 (C-10), 35.98 (C-20), 33.85 (C-22), 31.90 (C-7), 31.86 (C-8), 29.75 (C-2), 29.21 (C-25), 28.27 (C-16), 25.97 (C-23), 25.34 (C-15), 23.10 (C-28), 21.09 (C-11), 19.57 (C-27), 19.42 (C-26), 19.33 (C-19), 19.09 (C-21), 12.31 (C- 29), 12.14 (C-18)。以上波谱数据与文献[8]报道基本一致,故鉴定为-谷甾醇-3---d-葡萄糖苷(-sito- sterol-3---d-glucoside)。
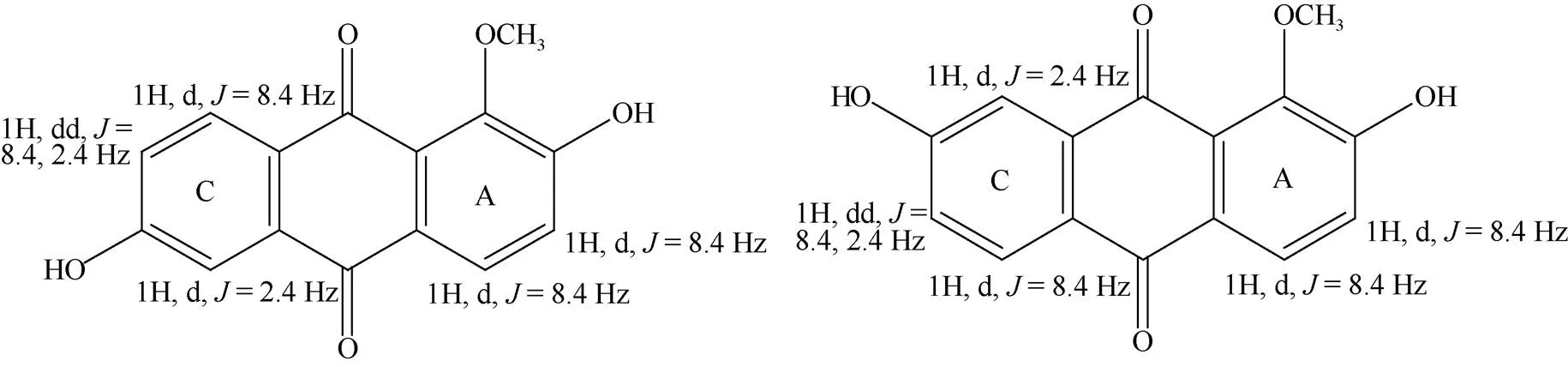
图2 化合物4可能的2种结构及其醌环上H的耦合情况
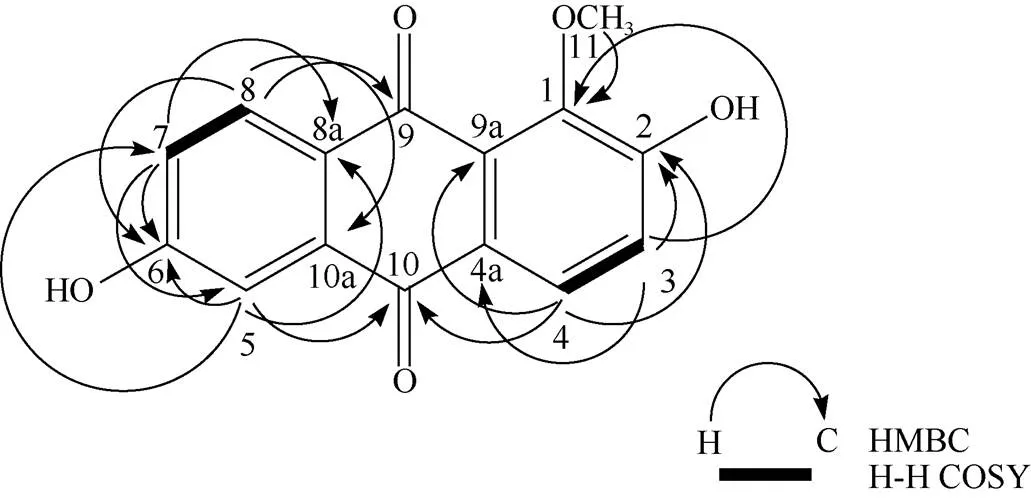
图3 化合物4的结构,HMBC及COSY相关

表1 化合物4的核磁共振波谱数据
化合物6 白色粉末,UHPLC-QE/MS/MS: 165.05 [M + H]+;1H NMR (400 MHz, DMSO-6):7.53 (1H, d,= 16 Hz,-H), 7.50 (2H, d,= 8 Hz, 2,6-H), 6.80 (2H, d,= 8Hz, 3,5-H), 6.31 (1H, d,= 16 Hz,-H)。13C NMR (100 MHz, DMSO-6):168.43 (=O), 160.05 (C-4), 144.56 (C-), 130.52 (C-3, 5), 125.75 (C-1), 116.21 (C-2, 6), 115.89 (C-)。以上波谱数据与文献[9]报道一致, 故鉴定为对香豆酸。
化合物7 黄色粉末(甲醇), mp: 274 ℃~ 275 ℃, HCl-Mg反应为阳性, ZrCl2反应为阳性, 加柠檬酸后黄色部分褪去;UHPLC-QE/MS/MS/: 287.06 [M + H]+;1H NMR (600 MHz, DMSO-6):12.48 (1H, s, 5-OH), 10.78 (1H, s, 3-OH), 10.12 (1H, s, 7-OH), 8.05 (2H, d,= 8.4 Hz, C2′,6′-H), 6.92 (2H, d,= 8.4 Hz, C3′,5′-H), 6.44 (1H, d,= 1.8 Hz, C8-H), 6.19 (1H, d,= 1.8 Hz, C6-H)。13C NMR (150 MHz, DMSO-6):176.14 (C-4), 164.12 (C-7), 160.95 (C- 9), 156.41 (C-5), 147.04 (C-2), 135.91 (C-3), 129.75 (C-2′, 6′), 121.91 (C-1′), 159.41 (C-4′), 115.68 (C-3′, 5′), 103.28 (C-10), 98.44 (C-6), 93.72 (C-8)。以上波谱数据与文献[10]报道基本一致,故鉴定为山奈酚。
化合物8 黄色粉末(甲醇), HCl-Mg反应为阳性, ZrCl2反应为阳性, 加柠檬酸后黄色部分褪去;UHPLC-QE/MS/MS: 303.05 [M + H]+;1H NMR (600 MHz, DMSO-6):12.49 (1H, s, 5-OH), 10.78 (1H, s, 3-OH), 9.59 (1H, s, 7-OH), 7.67 (1H, d,= 1.8 Hz, H-2′), 7.53 (1H, dd,= 1.8, 8.4 Hz, H-6′), 6.87 (1H, d,= 8.4 Hz, H-5′), 6.40 (1H, d,= 1.8 Hz, H-8), 6.18(1H, d,= 1.8 Hz, H-6);13C NMR (150 MHz, DMSO-6):176.03 (C-4), 164.06 (C-7), 160.91 (C- 9), 156.31 (C-5), 147.89 (C-4′), 146.98 (C-2), 145.24 (C-3′), 135.92 (C-3), 122.13 (C-1′), 120.15 (C-6′), 115.78 (C-5′), 115.23 (C-2′), 103.19 (C-10), 98.36 (C- 6), 93.53 (C-8)。以上波谱数据与文献[10]报道基本一致, 故鉴定为槲皮素。
化合物9 黄色针状结晶; UHPLC-QE/MS/ MS: 269.06 [M + H]+;1H NMR (CDCl3, 600 MHz):8.19 (1H, d,= 7.8 Hz, H-8), 8.08 (1H, d,= 1.4 Hz, H-5), 7.79 (1H, s, H-4), 7.76 (1H, s, H-1), 7.58 (1H, d,= 7.2 Hz, H-7), 4.11 (3H, s, OMe-3), 2.54 (3H, s, Me-7);13C NMR (CDCl3):182.70 (C-9), 182.37 (C- 10), 151.11 (C-2), 150.71 (C-3), 144.89 (C-7), 134.51 (C-6), 133.53 (C-8a), 131.34 (C-10a), 129.33 (C-4a), 128.25 (C-5), 127.42 (C-9a), 127.26 (C-8), 112.59 (C- 1), 108.24 (C-4), 56.63 (OMe-3), 21.91 (Me-7)。以上波谱数据与文献[11]报道一致,故鉴定为2-羟基-3-甲氧基-7-甲基蒽醌。
2 结果和讨论
本研究对白花蛇舌草氯仿提取部分的化学成分进行了系统分离,得到9个化合物,分别为:豆甾醇(1)、-谷甾醇(2)、rubiadin (3)、2,6-二羟基-1-甲氧基蒽醌(4)、-谷甾醇-3---d-葡萄糖苷(5)、对香豆酸(6)、山奈酚(7)、槲皮素(8)和2-羟基-3-甲氧基-7-甲基蒽醌(9),其中化合物4是新的蒽醌类化合物。
前期应用MTT法测定了部分流分及化合物对人子宫内膜癌Ishikawa细胞株的体外生长抑制作用,其中-谷甾醇(2)的IC50为233.3g/mL,显示具有一定的体外抑制活性;对香豆酸(6)的IC50为394.3g/mL,未显示有体外抑制活性。氯仿提取部分中Fr.4、Fr.4-2和Fr.4-4流分的IC50值分别为52.8、78.1和27.5g/mL,表明这3个流分有较强的体外抗人子宫内膜癌Ishikawa细胞活性,同时也表明多种活性成分的联合抗癌活性要优于单一化合物。后期将继续对其他流分和化合物开展体外抗癌研究。
据报道,分离得到的各化合物具有一定的药理活性,-谷甾醇(2)可抵抗细菌入侵、调节胆固醇、消炎镇痛、抗氧化、抗肿瘤、抗抑郁[12],对香豆酸(6)具有清除自由基、抑制氧化、抗炎、免疫调节、抑菌[13],山奈酚(7)和槲皮素(8)是很多常用抗癌方剂中的重要有效成分[14],rubiadin (3)具有骨质疏松症、风湿性关节炎、癌症骨转移等破骨细胞活性[15]。白花蛇舌草的药用成分仍需要进一步开发,寻找潜在利用价值。
[1] YE Y X, ZHANG P Z, WANG L, et al. Effects of different extraction methods on polysaccharide and its antioxidant characteristics ofWilld. in Henan Province [J]. Nat Prod Res Dev, 2019, 31(7): 1138–1146. [叶颖晓, 张朋展, 王丽, 等. 不同提取方法对豫产白花蛇舌草多糖及抗氧化活性的影响[J]. 天然产物研究与开发, 2019, 31(7): 1138–1146. doi: 10.16333/j.1001-6880.2019.7.004.]
[2] WANG S Q, CHEN L, NI H. Effect ofongene expression in hepatoma cells [J]. J Chin Med Mat, 2007, 30(10): 1285–1289. [王顺启, 陈力, 倪虹, 等. 白花蛇舌草对肝癌细胞基因表达的影响[J]. 中药材, 2007, 30(10): 1285–1289. doi: 10.13863/j. issn1001-4454.2007.10.033.]
[3] YU L, LÜ Q T, HUANG Z G, et al. Comparison of the contents of two coumarins infrom different areas by HPLC [J]. Mod Instrum Med Treat, 2015, 21(3): 85–87. [于亮, 吕青涛, 黄祝刚, 等. HPLC法比较不同产地白花蛇舌草中两种香豆素类成分的含量 [J]. 现代仪器与医疗, 2015, 21(3): 85–87. doi: 10.11876/mimt20150 3031.]
[4] MAO X F. Studies on the steroidal chemical constituents and quanti- tative determination of-sitosterol of(Willd.) Roxb. [D]. Guangzhou: The First Military Medical University, 2002. [毛杏飞. 白花蛇舌草甾体类化学成分及其-谷甾醇含量测定方法的研究[D]. 广州: 第一军医大学, 2002.]
[5] LI G Q, LI Y Y, TAN Z J. Spectroscopic Identification of-sitosterol [J]. Guangdong Chem Ind, 2018, 45(10): 128–129. [李国强, 李韵仪, 谭卓杰. Β-谷甾醇的波谱结构解析 [J]. 广东化工, 2018, 45(10): 128–129. doi: 10.3969/j.issn.1007-1865.2018.10.057.]
[6] CHEN H, CHEN M, HUANG Z H, et al. Chemical constituents of[J]. Chin J Exp Trad Med Form, 2013, 19(21): 69– 71. [陈红, 陈敏, 黄泽豪, 等. 巴戟天的化学成分研究 [J]. 中国实验方剂学杂志, 2013, 19(21): 69–71. doi: 10.11653/syfj2013210069.]
[7] YU L, LI J M, JIANG Z. A new anthraquinone from[J]. Chin J Med Chem, 2008, 18(4): 298–299. [于莉, 李俊明, 姜珍, 等. 白花蛇舌草中的一个新蒽醌 [J]. 中国药物化学杂志, 2008, 18 (4): 298–299. doi: 10.3969/j.issn.1005-0108.2008.04.015.]
[8] CHEN C, ZHANG H, XIAO W. Study on the chemical constituents ofsubsp.Rousi [J]. Glob Seabuckthorn Res Dev, 2005, 3(4): 25–27. [陈雏, 张浩, 肖蔚. 中国沙棘果实的部分化学成分提取 [J]. 国际沙棘研究与开发, 2005, 3(4): 25–27. doi: 10.3969/j.issn.1672-4836.2005.04.006.]
[9] MA X M, GUO Y J, WANG L S. Studies on the chemical constituents of[J]. China J Chin Mat Med, 2004, 29(5): 472. [马学敏, 郭亚健, 王力生. 麻叶荨麻的化学成分研究 [J]. 中国中药杂志, 2004, 29(5): 472. doi: 10.3321/j.issn:1001-5302.2004.05.031.]
[10] ZHOU Z H, YANG C R. Chemical constituents of crude green tea, the material oftea in Yunnan [J]. Acta Bot Yunnan, 2000, 22(3): 343–350. [周志宏, 杨崇仁. 云南普洱茶原料晒青毛茶的化学成分 [J]. 云南植物研究, 2000, 22(3): 343–350. doi: 10.3969/j.issn.2095- 0845.2000.03.017.]
[11] ZENG Y C, LIANG S Y, WU J H, et al. Chemical constituents fromand their antitumor activities [J]. Chin Trad Patent Med, 2018, 40(8): 1768–1772. [曾永长, 梁少瑜, 吴俊洪, 等. 白花蛇舌草化学成分及其抗肿瘤活性 [J]. 中成药, 2018, 40(8): 1768– 1772. doi: 10.3969/j.issn.1001-1528.2018.08.019.]
[12] CHEN Y K, ZENG A, LUO Z H, et al. Advances on pharmacology ofsitosterol [J]. J Guangdong Pharm Univ, 2021, 37(1): 148–153. [陈元堃, 曾奥, 罗振辉, 等.-谷甾醇药理作用研究进展 [J]. 广东药科大学学报, 2021, 37(1): 148–153. doi: 10.16809/j.cnki.2096-3653.202004 0801.]
[13] GUAN X Q, MAO J L, TANG Y X, et al. Research progress on phar- macological effects of-coumaric acid [J]. Chin Trad Herb Drugs, 2018, 49(17): 4162–4170. [管西芹, 毛近隆, 唐迎雪, 等. 对香豆酸的药理作用研究进展 [J]. 中草药, 2018, 49(17): 4162–4170. doi: 10. 7501/j.issn.0253-2670.2018.17.030.]
[14] CHENG Y F, GUAN W. Determination of quercetin and kaempferol inby high performance liquid chromatography [J]. China J Pharm Econom, 2020, 15(10): 34–36. [程韵霏, 关巍. 高效液相色谱法测定人字草中槲皮素和山柰酚的含量 [J]. 中国药物经济学, 2020, 15(10): 34–36. doi: 10.12010/j.issn.1673-5846.2020.10.007.]
[15] LIU Y. Study on the regulation mechanism of rubiadin on osteoclast differentiation [D]. Yan’an: Yan’an University, 2021. [刘元. 甲基异茜草素对破骨细胞分化调节机制的研究[D]. 延安: 延安大学, 2021. doi: 10.27438/d.cnki.gyadu.2021.000246.]
Chemical Constituents fromWilld.
YU Liang1,2, YANG Shuai1,2, HUANG Zhugang2, LIU Yong2, JIANG Haiqiang2, LÜ Qingtao2*
(1. Shandong Provincial Key Laboratory of Chemical Drugs, Shandong Academy of Pharmaceutical Sciences,Ji’nan 250101, China; 2. School of Pharmacy, Shandong University of Traditional Chinese Medicine,Ji’nan 250355, China)
To understand the chemical composition of, nine compounds were isolated from the 70% ethanol extract by column chromatography on silica gel and preparative high-performance liquid chromato- graphy. Based on physicochemical properties and spectral data, their structures were identified as stigmasterol (1),-sitosterol (2), rubiadin (3), 2,6-dihydroxy-1-methoxyanthraquinone (4),-sitosterol-3---d-glucoside (5),- coumaric acid (6), kaempferol (7), quercetin (8) and 2-hydroxy-3-methoxy-7-methylanthraquinone (9). Compound4 was a new compound. The Fr.4, Fr.4-2 and Fr.4-4 fractions in chloroform extract had strong activity against human endometrial carcinoma Ishikawa cells, with IC50of 52.8, 78.1 and 27.5g/mL, respectively.
; Chemical constituent; 2,6-dihydroxy-1-methoxyanthraquinone; Anti-endometrial cancer activity
10.11926/jtsb.4556
2021-11-02
2022-03-18
国家自然科学基金项目(81173614)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 81173614).
于亮(1985年生),药师,主要从事药物化学研究。E-mail: yulianger777@163.com
E-mail: luqingtao9@163.com

