芒柄花黄素对脓毒症小鼠炎性反应及MAPK/NF-κB通路影响的实验研究
魏东梅,邵龙刚
(江苏省第二中医院急危重症医学科,江苏 南京210019)
脓毒症是不同病原体侵入循环系统后引起的全身免疫反应,与其相关的免疫反应包括中性粒细胞、巨噬细胞、淋巴细胞、单核细胞和自然杀伤细胞等多种细胞的激活[1]。在脓毒症发生后,激活的免疫细胞处于高炎症状态,不受控制的产生促炎因子、急性期蛋白和其他炎症介质[2]。感染部位的炎性反应还包括白细胞的募集和增殖、补体系统的活跃以及内皮黏附分子和趋化因子水平的增加等[1-2]。目前虽已建立了多种治疗脓毒症的方法,然而,患者的病死率并没有显著降低[1,3]。因此,开发新型药物对于脓毒症的治疗具有重要意义。芒柄花黄素是一种从红三叶和黄芪中提取的甲基化异黄酮,由于其来源广泛,且使用安全,引起了学者的广泛关注[4]。最新的多项研究表明,芒柄花黄素具有强大的抗炎能力,已有报道其在神经保护、血管保护和治疗哮喘等方面具有良好的应用前景[5-7]。然而,迄今为止,尚未有芒柄花黄素在脓毒症中的作用报道。本研究通过腹腔注射脂多糖建立小鼠脓毒症模型,探究芒柄花黄素对脓毒症炎性反应的作用及机制。
1 材料与方法
1.1 实验动物 选取8~10周龄、清洁级的C57BL/6雄性小鼠40只,体重22 g左右,由南京中医药大学动物实验中心提供。动物实验经本院伦理委员会通过后实施。
1.2 试剂与仪器 芒柄花黄素购自Med Chem Express公司(纯度>99.9%,货号HY-N0183);脂多糖购自Sigma-Aldrich公司(货号297-473-0);检测炎症因子C-反应蛋白(C-reactive protein,CRP)(货号MCRP00)、单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)(货号CSB-E07430)、髓过氧化物酶(Myeloperoxidase,MPO)活性(货号CSB-E12108)、白细胞介素-1β(Interleukin-1β,IL-1β)(货号DY401)、白细胞介素-6(Interleukin-6,IL-6)(货号SM6000B)和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)(货号SMTA00B)的酶联免疫吸附试验试剂盒购自Minneapolis公司;抗P-P38抗体(货号ab182453)、抗P38抗体(货号ab170099)、抗P-ERK抗体(货号ab229912)、抗ERK1/2抗体(货号ab176640)、抗P-JNK抗体(货号ab176662)、抗JNK 抗体(货号ab126424)、抗P65抗体(货号ab32536)和抗β-actin抗体(货号ab6276)购自美国Abcam公司;辣根过氧化物酶标记的二抗(货号9003-99-0)购自Macklin公司。显微镜(Olympus公司);酶标仪(BEC公司);电泳仪及发光仪(天能公司)。
1.3 实验方法
1.3.1 脓毒症小鼠模型建立和分组:利用随机数法将小鼠随机分为四组,即对照组、内毒素组、低剂量组和高剂量组,每组10只。内毒素组按5 mg/kg浓度腹腔注射脂多糖[8],对照组按5 mg/kg注射0.9%氯化钠溶液,低剂量组在给予脂多糖小鼠中当天按照10 mg/kg腹腔注射芒柄花黄素,高剂量组的芒柄花黄素浓度为20 mg/kg,连续注射7 d[9-10]。
1.3.2 白细胞计数:利用3 ml无菌0.9%氯化钠溶液灌洗小鼠腹腔,收集灌洗后的腹腔液(IPF)保持在冰上以进行进一步分析。将500 μl IPF固定在载玻片上5 min,并用Wright染色法染色,在显微镜下对不同种类白细胞进行计数[11]。
1.3.3 炎症因子检测:取小鼠脾脏后获取脾脏匀浆液。根据试剂盒说明书,对CRP、MCP-1、MPO活性、IL-1β、IL-6和TNF-α进行检测。利用聚氯乙烯作为固相载体,在试剂盒中加入适合浓度的抗体,调整包被缓冲液pH值,室温孵育2 h后,即刻利用非特异性蛋白进行封闭,完成清洗后加入显色液,酶标仪检测[11]。
1.3.4 脾脏形态学分析:为确定脓毒症及给药后脾脏形态学变化,室温下,将小鼠脾脏浸润在10%福尔马林中固定过夜,随后将其包埋在石蜡中。用苏木精和伊红(HE)染料对厚度为4~5 μm的脾脏切片进行染色,最后使用放大400倍的光学显微镜进行观察[11]。
1.3.5 免疫印迹法检测蛋白含量:利用蛋白裂解液对小鼠脾脏进行匀浆,低温离心后加入缓冲液,煮沸制作蛋白样本;电泳及转膜参数:90 V维持30 min,120 V维持90 min,250 mA恒流转膜2 h。进行抗体孵育过夜,冲洗后孵育二抗[12]。
1.4 统计学方法 采用SPSS 19.0统计学软件进行数据分析。计数资料以均数±标准差表示,两样本间比较利用独立样本t检验,三个样本比较采用方差分析;P<0.05为差异有统计学意义。
2 结 果
2.1 芒柄花黄素对脓毒症小鼠存活率的影响 见图1。对照组小鼠在观察期间全部存活;内毒素组小鼠在2 d后开始死亡,7 d的病死率为100%;低浓度组小鼠的存活率为21%;高浓度组小鼠的存活率达到了37.5%。
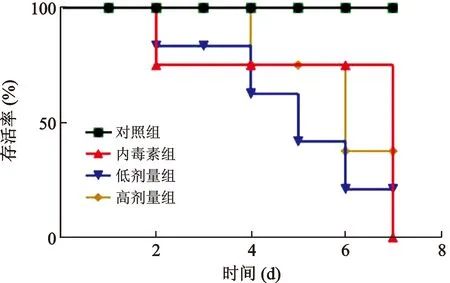
图1 芒柄花黄素对脓毒症小鼠存活率的影响
2.2 芒柄花黄素对脓毒症小鼠IPF中白细胞计数的影响 见图2。与对照组相比,内毒素组白细胞、巨噬细胞、中性粒细胞和淋巴细胞计数均增加(均P<0.05);与内毒素组相比,芒柄花黄素干预后上述白细胞计数均降低(均P<0.05),且具有剂量依赖性(均P<0.05)。
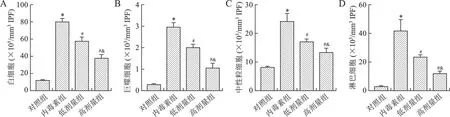
A:IPF中白细胞总数;B:IPF中巨噬细胞计数;C:IPF中中性粒细胞计数;D:IPF中淋巴细胞计数。与对照组相比,*P<0.05;与内毒素组相比,#P<0.05;与低剂量组相比,&P<0.05
2.3 芒柄花黄素对脓毒症小鼠脾脏中炎性介质的影响 见图3。与对照组相比,内毒素组小鼠脾脏中的炎症因子(CRP、MCP-1和MPO)和促炎因子(IL-1β、IL-6和TNF-α)含量均升高(均P<0.05);与内毒素组相比,芒柄花黄素干预后上述炎症因子和促炎因子均降低(均P<0.05),且具有剂量依赖性(均P<0.05)。
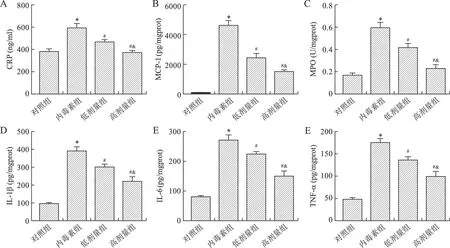
A:脾脏组织中CRP含量;B:脾脏组织中MCP-1含量;C:脾脏组织中MPO含量;D:脾脏组织中IL-1β含量;E:脾脏组织中IL-6含量;F:脾脏组织中TNF-α含量。与对照组相比,*P<0.05;与内毒素组相比,#P<0.05;与低剂量组相比,&P<0.05
2.4 芒柄花黄素对脓毒症小鼠脾脏组织结构的影响 见图4。对照组脾组织的HE染色表现出正常的组织结构;内毒素组切片中融合的白髓(黑色箭头)明显增多,还观察到坏死细胞及红髓处的凋亡小体,这意味着脾肿大和白髓周围巨噬细胞的主动免疫反应强;芒柄花黄素干预后上述脾脏的受损表现得到部分恢复,且以剂量依赖的方式改善。

注:黑色箭头指示融合的白髓
2.5 芒柄花黄素对脓毒症小鼠脾脏组织中MAPK/NF-κB通路相关蛋白的影响 见图5。与对照组相比,内毒素组P-P38、P-ERK、P-JNK和P65表达均增加(均P<0.05);与内毒素组相比,芒柄花黄素干预后P-P38、P-ERK、P-JNK和P65表达减少(均P<0.05),且具有剂量依赖性(均P<0.05)。

A:免疫印迹实验条带的灰度示意图;B:P-P38含量统计图;C:P-ERK含量统计图;D:P-JNK含量统计图;E:P65含量统计图。与对照组相比,*P<0.05;与内毒素组相比,#P<0.05;与低剂量组相比,&P<0.05
3 讨 论
脓毒症进展迅速,病死率高,治疗效果不尽如人意[1-3]。而芒柄花黄素来源广泛,使用安全,在多种疾病中取得一定治疗效果,相关研究成为热点[4-7]。本研究发现芒柄花黄素能够提高脓毒症小鼠的存活率。而脓毒性的进展与白细胞、巨噬细胞、中性粒细胞和淋巴细胞等细胞数量的增加密切相关,这些细胞的过度活化是机体发生失控性炎性反应的根本环节[1-3]。脓毒症发生后,这些白细胞分泌并产生大量炎症蛋白和促炎因子,CRP是一种急性期蛋白[13],MCP-1是一种启动细胞因子[14],而MPO活性反映了中性粒细胞在脾脏中的隔离[15],所有这些介质都被广泛用作炎症标志物;而IL-1β、IL-6和TNF-α等促炎因子,不仅消耗大量抑炎因子,而且又能引起炎症级联放大反应,引发失控性炎症[16]。因此,抑制炎症细胞的过度活化,控制炎性反应,是脓毒症治疗的关键所在[13-16]。
本研究发现芒柄花黄素不仅能够降低脓毒症小鼠IPF中的多种白细胞数量,还能显著降低脾脏中相关炎症因子(CRP、MCP-1和MPO)和促炎因子(IL-1β、IL-6和TNF-α)含量。本实验对脾脏形态学的分析也同样支持芒柄花黄素的抗炎作用和对脓毒症的治疗作用。近来一些研究已证实,芒柄花黄素能够调节白细胞增殖和活性,以及细胞因子的产生,从而抑制炎性反应。有学者报道,芒柄花黄素可通过减轻动脉粥样硬化中的血管炎症发挥脑保护作用[6]。也有学者证实,芒柄花黄素能够抑制胃溃疡大鼠的炎性反应促进胃黏膜血管再生[17]。还有学者发现,芒柄花黄素抑制IL-1β诱导的人软骨细胞炎症并减缓大鼠骨关节炎的进展[10]。不仅在慢性炎症中发挥抗炎作用,芒柄花黄素在急性炎症中也同样发挥作用。Yi 等[17]报道,芒柄花黄素可减轻小鼠过敏性哮喘的气道炎症和氧化应激反应。本实验结果与上述研究相似,均证实了芒柄花黄素的抗炎作用,并扩展了芒柄花黄素在不同疾病中的应用。
为进一步探究芒柄花黄素减轻脓毒症炎性反应的机制,课题组进行了炎症相关通路的检测。已有文献[18-19]报道,在发生脓毒症等炎性反应过程中NF-κB和MAPK信号通路可被激活,通路中的关键分子,如P38、JNK、ERK1/2和P65等表达增加。Gao等[18]发现,脓毒症发生肝肾损伤时NF-κB和MAPK信号通路活化,加重组织器官损伤。还有研究发现,在脓毒症心肌损伤时巨噬细胞功能紊乱,导致P38、JNK、ERK1/2和P65等分子异常表达[19]。本研究也发现,在小鼠脓毒症发生后脾脏中的NF-κB和MAPK信号通路被激活,而芒柄花黄素干预后此异常活化的通路被抑制。本实验结果和先前研究一致,芒柄花黄素能够通过对NF-κB和MAPK等炎症关键通路的抑制发挥抗炎作用。有学者发现,芒柄花黄素通过抑制NF-κB和MAPK通路的激活来减弱破骨细胞的生成[20]。也有学者证实,芒柄花黄素通过调节NF-κB通路抑制大鼠胃部炎症并促进溃疡愈合[17]。
综上所述,芒柄花黄素可能通过抑制MAPK/NF-κB通路活化减轻小鼠脓毒症炎性反应。本研究拓展了芒柄花黄素在不同疾病模型上的应用,为开发新型治疗脓毒症药物提供了更加深入的实验依据。

