熊果酸调控AMPK/SIRT1通路对牙周炎大鼠牙槽骨吸收的影响
王玉玮,李丁新,赵 飞,齐宝明,高志强
(1.唐山市协和医院口腔修复科,河北 唐山 063000;2.唐山市协和医院儿童牙科,河北 唐山 063000)
牙周炎是导致患者牙齿松动或缺失的重要原因,牙槽骨吸收是牙周炎的病理基础,因此预防牙槽骨吸收,促进牙槽骨的修复与重建,可有效改善牙周炎[1-2]。熊果酸(Ursolic acid,UA)是从山楂、熊果等植物中提取的五环三萜类化合物,具有抗炎、抗氧化等作用。研究[3-4]显示,UA还具有促进骨合成、抑制骨吸收的作用,对骨质疏松患者的骨重塑过程发挥重要作用。腺苷酸活化蛋白激酶(Adenosine monophosphate-activated protein kinase,AMPK)是调节细胞能量代谢的酶,AMPK可激活下游沉默信息调节因子1(Silent information regulator 1,SIRT1),而SIRT1是一种组蛋白脱乙酰化酶。研究[5]显示,SIRT1具有调节成骨细胞与破骨细胞分化的作用。AMPK/SIRT1通路的激活,可诱导人间充质干细胞的抗氧化反应和成骨分化[6]。UA对牙周炎大鼠牙槽骨吸收的研究尚未见报道,本研究以此为出发点,旨在探索UA对牙周炎大鼠牙槽骨吸收及AMPK/SIRT1通路的影响。
1 材料与方法
1.1 实验材料 6~8周龄雄性SD大鼠(SPF级),体重230~270 g,购自山东艾来克生物科技有限公司,生产许可证号SCXK(鲁)2019-0017,大鼠在24~25 ℃温度、60%~64%湿度、12 h∶12 h光暗的环境下饲养。本研究经医院伦理委员会批准(批准号L2022-2-03)。UA(批号S31135,纯度≥99%,原料药)、AMPK抑制剂(Compound C)(批号P5499)、抗酒石酸酸性磷酸酶(TRAP)染色试剂(批号387AJ)均购自上海源叶生物科技有限公司;HE试剂盒(批号C0105S)、兔抗鼠核因子κB受体活化因子配体(RANKL)(批号AF7872)、SIRT1(批号AF5300)、磷酸化AMPK(p-AMPK)(批号AF5908)、AMPK(批号AF6195)、β-肌动蛋白(β-actin)(批号AF7924)均购自常州市比迪文生物科技有限公司;兔抗鼠核因子κB p65(NF-κB p65)(批号ab16502)、乙酰化NF-κB p65(Ac-NF-κB p65)(批号ab19870)、骨保护素(OPG)(批号ab73400)、肿瘤坏死因子-α(TNF-α)(批号ab6671)、白细胞介素-1β(IL-1β)(批号ab254360)抗体均购自美国Abcam公司;免疫组化检测试剂盒(批号SP1641)、羊抗兔二抗(批号SP5627)均购自苏州蚂蚁淘生物科技有限公司;小动物活体断层扫描仪(型号Viva CT40)、显微镜(型号M110T)、凝胶成像分析仪(型号Tanon 3900)均购自深圳市伯建生物科技有限公司。
1.2 实验造模及分组给药 根据文献[7]制备牙周炎大鼠模型,4%戊巴比妥钠麻醉大鼠后,在大鼠双侧上颌第二颗磨牙牙颈部使用0.2 mm的正畸结扎丝进行结扎,同时在颊侧牙龈龈沟内注射30 μl的脂多糖,每隔2 d注射一次,共注射3次,当出现牙齿松动、牙龈红肿、出血、糜烂等现象则表明造模成功。30只大鼠造模成功,随机分为模型组、UA组(150 mg/kg)、UA+AMPK抑制剂组(150 mg/kg+0.2 mg/kg),每组10只。另取10只健康大鼠(不进行任何处理)作为对照组。UA组大鼠使用150 mg/kg的UA灌胃给药(用0.9%氯化钠溶液配制成浓度为15 mg/ml的混悬液,以10 ml/kg的体积灌胃)[8];UA+AMPK抑制剂组大鼠使用150 mg/kg的UA灌胃给药,同时腹腔注射0.2 mg/kg的Compound C[9];对照组和模型组大鼠灌胃10 ml/kg的0.9%氯化钠溶液;每天给药1次,连续给药2周。
1.3 微计算机断层扫描技术(Micro-CT)观察大鼠牙槽骨吸收 末次给药24 h后,处死大鼠,分离上颌骨及相应牙周组织,剪取500 μg组织于-80 ℃保存,其余使用4%多聚甲醛固定并切片。取4%多聚甲醛固定的牙周组织标本,采用小动物活体断层扫描仪进行三维扫描,分别检测骨小梁厚度(Tb.Th)、釉牙骨质界至牙槽嵴顶的距离(CEJ-ABC)、骨小梁数目(Tb.N)、骨小梁分离度(Tb.Sp)。
1.4 HE染色观察牙周组织病理改变 将石蜡包埋的牙周组织切成厚度4 μm的切片,使用HE染色试剂盒进行染色,镜下观察牙周组织病理学变化。
1.5 TRAP染色及破骨细胞计数 牙周组织石蜡切片脱蜡水化后,使用TRAP染色试剂盒进行染色,显微镜观察破骨细胞数,随机观察5个视野,计算平均每个视野破骨细胞数。
1.6 免疫组化法检测牙周组织RANKL、OPG蛋白表达 取牙周组织的石蜡切片,经脱蜡水化抗原修复后,分别加入兔抗鼠RANKL、OPG一抗(1∶1000稀释),4 ℃孵育过夜,再加入羊抗兔二抗孵育1 h,DAB显色,苏木素复染,RANKL主要表达于细胞膜与胞浆,OPG主要表达于胞浆,阳性呈棕黄色或棕褐色,显微镜观察RANKL、OPG蛋白阳性表达并拍照,随机选择3个区域,采用Image-Pro Plus 6.0图像软件分析RANKL、OPG蛋白的光密度值。
1.7 蛋白印迹法检测牙周组织AMPK、p-AMPK、SIRT1、Ac-NF-κB p65、NF-κB p65、TNF-α、IL-1β蛋白表达 取各组大鼠牙周组织,进行研磨,RIPA裂解液进行总蛋白的提取,经电泳后转膜并封闭,分别加入兔抗鼠AMPK(1∶300)、p-AMPK(1∶300)、SIRT1(1∶200)、Ac-NF-κB p65(1∶500)、NF-κB p65(1∶500)、TNF-α(1∶700)、IL-1β(1∶700)、β-actin(1∶700)一抗,4 ℃孵育过夜,再加入羊抗兔二抗(1∶1200),室温孵育2 h,显色,β-actin为内参,分析蛋白相对表达。
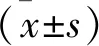
2 结 果
2.1 UA对牙周炎大鼠牙槽骨吸收的影响 与对照组比较,模型组大鼠牙槽骨CEJ-ABC、Tb.Sp显著升高,Tb.N、Tb.Th显著降低(均P<0.05);与模型组比较,UA组大鼠牙槽骨CEJ-ABC、Tb.Sp显著降低,Tb.N、Tb.Th显著升高(均P<0.05);与UA组比较,UA+AMPK抑制剂组大鼠牙槽骨CEJ-ABC、Tb.Sp显著升高,Tb.N、Tb.Th显著降低(均P<0.05)。见图1(表1)。

图1 各组大鼠牙槽骨Micro-CT图
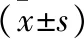
表1 四组大鼠牙槽骨CEJ-ABC、Tb.N、Tb.Th、Tb.Sp比较
2.2 UA对牙周炎大鼠牙周组织病理变化的影响 HE染色结果显示,对照组大鼠牙槽骨表面光滑完整,未见明显吸收,牙周膜区域宽度均匀,未见明显炎症细胞浸润牙周组织;模型组大鼠牙槽骨表面不平整,牙槽骨高度明显降低,有较多骨吸收陷窝,牙周膜纤维排列紊乱,有大量炎症细胞浸润;UA组大鼠较模型组大鼠病理改变减轻,牙槽骨吸收减少,牙周纤维排列较整齐,炎症细胞浸润程度减轻;UA+AMPK抑制剂组较UA组大鼠病理改变加重,牙槽骨表面不平整,骨吸收增加,炎症细胞浸润增加。见图2。
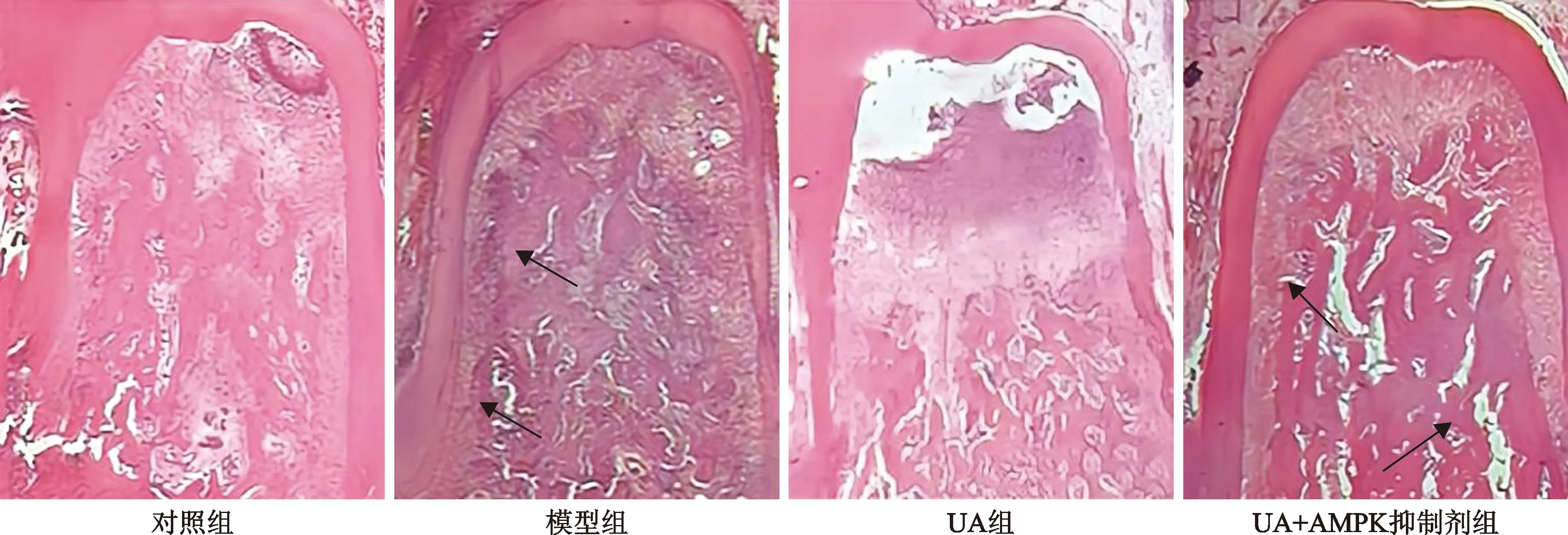
注:箭头所示为骨吸收陷窝
2.3 UA对牙周炎大鼠牙周组织破骨细胞的影响 与对照组比较,模型组大鼠牙周组织破骨细胞数显著升高(P<0.05);与模型组比较,UA组大鼠牙周组织破骨细胞数显著降低(P<0.05);与UA组比较,UA+AMPK抑制剂组大鼠牙周组织破骨细胞数显著升高(P<0.05)。见表2。

表2 四组牙周炎大鼠牙周组织破骨细胞数比较(个)
2.4 UA对牙周炎大鼠牙周组织RANKL和OPG蛋白表达的影响 免疫组化结果显示,RANKL和OPG阳性表达呈棕黄色或棕褐色颗粒。与对照组比较,模型组大鼠牙周组织RANKL蛋白表达显著升高,OPG蛋白表达显著降低(均P<0.05);与模型组比较,UA组大鼠牙周组织RANKL蛋白表达显著降低,OPG蛋白表达显著升高(均P<0.05);与UA组比较,UA+AMPK抑制剂组大鼠牙周组织RANKL蛋白表达显著升高,OPG蛋白表达显著降低(均P<0.05)。见表3。
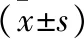
表3 四组牙周炎大鼠牙周组织RANKL、OPG蛋白表达比较
2.5 UA对牙周炎大鼠牙周组织AMPK、p-AMPK、SIRT1、Ac-NF-κB p65、NF-κB p65、TNF-α、IL-1β蛋白表达的影响 与对照组比较,模型组大鼠牙周组织p-AMPK/AMPK、SIRT1蛋白表达水平显著降低,Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达水平显著升高(均P<0.05);与模型组比较,UA组大鼠牙周组织p-AMPK/AMPK、SIRT1蛋白表达水平显著升高,Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达水平显著降低(均P<0.05);与UA组比较,UA+AMPK抑制剂组大鼠牙周组织p-AMPK/AMPK、SIRT1蛋白表达水平显著降低,Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达水平显著升高(均P<0.05)。见表4。
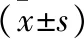
表4 四组牙周炎大鼠牙周组织p-AMPK/AMPK、SIRT1、Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达比较
3 讨 论
牙周炎是临床常见疾病,其发病率可达70%,可造成牙周组织损害,是成人丧失牙齿的原因之一[10-11]。本研究采用结扎联合注射脂多糖的方法建立大鼠牙周炎模型,结果显示,大鼠牙槽骨表面不平整,牙槽骨高度明显降低,有较多骨吸收陷窝,牙周膜纤维排列紊乱并伴有炎症细胞浸润,牙槽骨CEJ-ABC、Tb.Sp、牙周组织破骨细胞数显著升高,Tb.N、Tb.Th显著降低,与以往报道[2]结果类似,说明结扎联合注射脂多糖的方法确实能够诱导大鼠牙周炎症的发生,使牙槽骨遭到破坏,提示建模成功。
UA为一种中药提取物,具有抗炎、抗菌、抗氧化等多种功效,在炎症性疾病、肿瘤等疾病中发挥重要作用[12]。报道显示,UA还具有促进骨形成、抑制骨吸收的作用,通过作用多种靶基因、多条信号途径治疗骨质疏松[13]。李梦红等[14]研究表明,UA具有促进小鼠成牙骨质细胞分化的作用。另有研究显示,在正畸牙移动模型大鼠中,UA可减少大鼠正畸牙移动的距离,减缓正畸所致牙根吸收[15]。与上述研究相似的是,本研究发现,UA可显著改善牙周炎模型大鼠病理学改变,且牙槽骨CEJ-ABC、Tb.Sp、牙周组织破骨细胞数显著降低,Tb.N、Tb.Th显著升高,表明UA可减轻牙周炎引起的牙周病理损伤,缓解牙槽骨吸收,提示UA对牙周炎的改善作用可能与促进骨形成、抑制骨吸收有关。
骨骼重塑过程涉及成骨细胞与破骨细胞之间的动态平衡,多种因子参与诱导破骨细胞的分化与成熟[16]。RANKL又称为骨保护素配体,可促进破骨细胞的活化增殖;OPG可抑制破骨细胞分化,减少骨吸收[17-18]。既往研究[19]显示,牙周炎大鼠牙周组织中OPG下调,RANKL上调,牙槽骨吸收能力增强。本研究发现牙周炎大鼠的牙周组织中RANKL蛋白表达较健康大鼠显著升高,OPG蛋白表达较健康大鼠显著降低,说明牙周炎大鼠具有较强的牙槽骨吸收能力。接着,本研究给予牙周炎模型大鼠UA治疗后,结果显示,与模型组比较,UA组大鼠牙周组织OPG蛋白表达显著升高,RANKL蛋白表达显著降低,提示UA可上调OPG蛋白表达,抑制RANKL蛋白表达,减少牙槽骨吸收。
AMPK是调节细胞能量代谢的蛋白,AMPK激活可上调SIRT1表达,AMPK/SIRT1信号通路可参与调控细胞增殖分化、炎性反应等,还可通过调控细胞凋亡而影响骨骼肌质量[20]。研究[21]显示,激活AMPK/SIRT1信号通路可提供骨髓间充质干细胞抗氧化功能,及促进成骨分化。TNF-α、IL-1β为主要炎症因子,SIRT1可通过抑制NF-κB乙酰化水平及转录而抑制炎症因子的释放[22]。Tamaki等[23]研究发现,在牙周炎大鼠的牙周组织中,AMPK及SIRT1处于抑制状态,AMPK的激活有助于缓解牙槽骨吸收。本研究给予牙周炎模型大鼠UA治疗后,结果显示,与模型组比较,UA组大鼠牙周组织p-AMPK/AMPK、SIRT1蛋白表达水平显著升高,Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达水平显著降低,提示UA可能激活AMPK/SIRT1信号通路。而使用AMPK抑制剂Compound C后,与UA组比较,UA+AMPK抑制剂组大鼠牙周组织p-AMPK/AMPK、SIRT1蛋白表达水平显著降低,Ac-NF-κB p65/NF-κB p65、TNF-α、IL-1β蛋白表达水平显著升高,同时,大鼠牙槽骨CEJ-ABC、Tb.Sp及牙周组织破骨细胞数、RANKL蛋白表达显著升高,牙槽骨Tb.N、Tb.Th及牙周组织OPG蛋白表达显著降低,牙周组织病理改变加重,进一步表明UA可通过激活AMPK/SIRT1信号通路,调控RANKL、OPG蛋白表达,进而抑制牙槽骨吸收和炎性反应,促进牙槽骨的修复与重建。
综上所述,UA可通过激活AMPK/SIRT1信号通路,抑制炎症因子释放和牙周炎大鼠牙槽骨吸收,促进牙槽骨的修复与重建。另外,本研究未进行氧化应激指标检测,不能确定UA对牙槽骨吸收的抑制作用是否与氧化应激反应相关,这是本研究的不足之处,后续将针对此不足开展相关实验,以完善UA减轻牙周炎大鼠牙槽骨吸收的机制研究。

