微塑料暴露下有/无植物人工湿地脱氮性能的对比
黄 娟 李 瑞 马溢轩 韩庭苇 曹美芳 钱秀雯
(东南大学土木工程学院, 南京 211189)
环境中的塑料垃圾经紫外线辐射、机械磨损和生物降解等过程后,分解破碎形成小颗粒的微塑料(粒径小于 5 mm),对生态系统和人类健康造成威胁[1].微塑料经地表径流、污水排放等方式进入污水处理系统[2],而传统污水厂中机械搅拌和曝气等流程加速了微塑料的破碎,增加了其向自然水体泄漏的风险,太湖中检测出全球淡水湖泊浮游生物网中微塑料的最高水平,平均丰度为 0.01×106~6.8×106个/km2[3].人工湿地可以通过基质和植物的物理拦截有效去除微塑料[4],但受限于分离和定量的技术手段,植物种植在人工湿地去除微塑料中的作用鲜有报道.
污水中氮素主要通过微生物驱动的硝化和反硝化过程去除,许多研究报道了微塑料对序批式活性污泥工艺(SBR)[5]、好氧颗粒污泥[6]、膜生物反应器[7]中硝化和反硝化细菌的毒性作用.与活性污泥工艺相比,人工湿地不仅可以通过植物吸收和基质吸附加强氮素的去除,还可以通过植物调节刺激微生物活性,促进氮素在湿地中的生物降解过程[8].因此,当人工湿地面临微塑料污染胁迫时,探究有/无植物人工湿地的脱氮性能和微生物群落差异对理解湿地生态功能尤为重要.
研究表明,植物具有独特的生长和保护机制,受污染物胁迫时会产生适应性生理调节,甚至出现枯萎死亡的现象[9],直接影响湿地脱氮性能.同时,由于植物的生长状况、泌氧能力和根系分泌物组成影响着湿地微环境,微塑料对植物的胁迫可能会影响氮转化功能菌的组成和分布,从而间接导致湿地脱氮性能的变化.因此,探究微塑料短期和长期暴露下湿地植物生理状况的变化和调控,是阐明湿地脱氮影响机制的重要信息.
本试验选用聚苯乙烯微塑料(PS MPs)作为研究对象,黄菖蒲为试验植物,构建了黄菖蒲湿地和无植物湿地,旨在探究PS MPs短期和长期暴露下,有/无植物人工湿地微塑料去除和脱氮性能的差异, 对植物光系统和抗氧化系统的影响, 以及有/无植物湿地微生物群落结构和脱氮功能细菌丰度的差异.
1 材料与方法
1.1 试验材料和合成污水
本试验采用的PS MPs分散液购自天津倍思乐色谱技术开发中心,不含添加剂或塑化剂等杂质成分.使用动态光散射仪(DLS)和傅里叶变换红外吸收光谱仪(FTIR)对微塑料聚合物粒径和类型进行表征,如图1所示. PS MPs样品的平均粒径为4~6 μm,分散性良好,无明显聚集,且FTIR谱图与聚苯乙烯结构一致.

(a) 粒径分布

(b) FTIR图
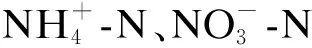
1.2 人工湿地装置搭建和运行
在实验室搭建无植物湿地(CW-U)和黄菖蒲湿地(CW-P)2组垂直流人工湿地,如图2所示.装置主体采用有机玻璃制作,内部由上至下填充4层粒径不同的砾石,每个装置孔隙体积为5 L.合成污水以间歇流的方式投加到人工湿地中,以水力停留时间(HRT)72 h为一个周期,连续培养180 d,直至营养物质去除率不随时间发生明显波动,即认为装置达到稳定去除,其中CW-U的 TN、COD和TP平均去除率分别稳定在57.27%、92.09 %和 66.07%,CW-P的TN、COD、TP平均去除率分别稳定在64.65%、66.07%和79.46%.然后向2组湿地中加入含有PS MPs的废水.

图2 人工湿地装置示意图(单位:cm)
1.3 样品采集和测定

在PS MPs短期和长期暴露阶段,分别从黄菖蒲湿地中采集生长状态相同的叶片,使用南京建成生物工程研究所的试剂盒测定植物的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量,并参照Lichtenthaler[16]的方法测定叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(total Chl)和类胡萝卜素(Car)含量.
试验结束时,分别从2组装置的砂石层的相同深度范围内(10~20 cm深度处)采集3个不同点位的基质样品,将3个样品混合均匀后进行16s rRNA测序,探究组间微生物群落差异.
1.4 数据分析
采用SPSS 28.0统计软件,通过配对T检验对2组湿地的水质差异进行统计学分析;通过皮尔逊相关性分析确定出水中各氮素组成对TN去除的贡献.
2 结果与讨论
2.1 PS MPs去除效果对比
本试验对PS MPs短期和长期暴露下2组湿地出水中的PS MPs浓度进行了精确定量,如表1所示.CW-U和CW-P中PS MPs的出水浓度相近,短期和长期暴露下去除率均超过99.80%.结果表明,2组人工湿地均可实现PS MPs的高效去除,这可能是因为基质和生物膜吸附是湿地去除微塑料的主要机制[17].PS MPs出水浓度随暴露时间的延长增加了228.40%~241.13%,说明PS MPs在人工湿地中的广泛积累导致基质生物膜和植物根系吸附位点趋于饱和,长期暴露时有泄漏风险.同时,湿地内部截留的大量微塑料可能会对湿地微生物和植物产生不利影响,亟须进一步探讨.

表1 两组人工湿地各阶段PS MPs出水浓度
2.2 湿地脱氮性能的差异
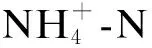

(a) TN
2.3 黄菖蒲的生理响应
植物的生长状况影响着人工湿地脱氮性能[21],而叶绿素a、叶绿素b和类胡萝卜素的含量是评估逆境条件下植物光合能力和生长状况的重要指标[22].如图4所示,PS MPs短期暴露时,黄菖蒲中的叶绿素a、叶绿素b和总叶绿素的质量分数分别为2.10×10-3、0.89×10-3和2.99×10-3,长期暴露时分别降低了26.15%、13.92%和22.51%;类胡萝卜素质量分数在短期暴露时为0.55×10-3,长期暴露时下降了16.22%.结果表明,与PS MPs短期暴露相比,PS MPs长期暴露可能使得黄菖蒲的光系统和叶绿体结构发生了进一步损伤,在一定程度上对植物的光合作用和生长发育产生不利影响,从而抑制了其在湿地中的生态功能,这与CW-P在PS MPs暴露后期脱氮性能的下降相一致.

图4 黄菖蒲各阶段光合色素含量
植物体内的抗氧化酶活性反映了植物在逆境条件下的功能健康,也影响着湿地的脱氮性能[23].如图5所示,PS MPs短期暴露下黄菖蒲体内超氧化物歧化酶(SOD)活性高于长期暴露,说明微塑料急性胁迫诱导过量活性氧自由基(ROS)产生,细胞发生氧化应激[24].同时,长期暴露下黄菖蒲体内过氧化物酶(POD)和过氧化氢酶(CAT)的活性分别增加了5.06%和13.25%,说明POD和CAT的活性被激发,表现出协同清除自由基的能力.丙二醛(MDA)是膜质过氧化的最终产物,其含量可以反映植物对逆境条件的响应强弱[25],PS MPs长期暴露下黄菖蒲体内MDA的质量分数下降了45.75%,表明植物细胞逐渐适应逆境条件,但由于细胞膜质过氧化程度严重,膜结构发生不可逆的损伤,其生理系统功能仍难以恢复.结果表明,PS MPs长期暴露损伤了植物的抗氧化系统,从而不利于湿地的脱氮性能.

(a) SOD活性

(b) POD活性

(c) CAT活性

(d) MDA含量
2.4 微生物群落结构的差异
采用高通量测序比较了PS MPs短期和长期暴露下2组湿地基质微生物群落结构的差异.如表2所示,所有微生物样品的Good’s coverage指数均大于99.50%,表明测序深度足够,测序结果合理. Observed species和Chao1均随着PS MPs暴露时间的延长出现了不同程度的下降,但CW-P始终高于CW-U,表明黄菖蒲湿地可以有效抵抗PS MPs胁迫,保持更高的微生物丰度.同时,CW-P中Shannon指数和均匀度指数(Pielou_e)也始终高于CW-U,Simpson指数始终低于CW-U,表明黄菖蒲对微生物多样性和均匀度具有积极贡献.如图6所示,4组样品中扩增序列变体(ASVs)总数为2 080个,CW-U和CW-P在2个阶段的共享ASVs分别为141和185个,仅占总数的6.78%和8.89%,说明PS MPs短期和长期暴露下,2组湿地微生物群落结构具有明显差异.

表2 人工湿地各阶段微生物α-多样性

图6 两组湿地各阶段微生物群落ASVs总数的韦恩图
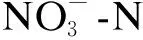

图7 两组湿地各阶段门水平上微生物的相对丰度组成
2.5 脱氮功能菌属的差异
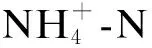
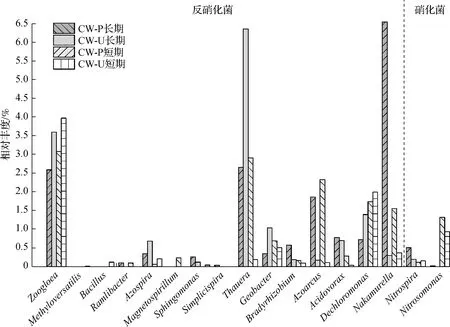
图8 两组湿地各阶段脱氮功能菌属相对丰度
对于反硝化而言, PS MPs短期和长期暴露下,CW-P中反硝化菌属的整体相对丰度较CW-U分别提高了71.33%和15.44%,但在分布上有所差异.动胶菌属(Zoogloea)是2组湿地中占比最高的反硝化菌属,与CW-U相比,其在CW-P中各阶段的相对丰度分别下降了88.91%和101.08%.类似地,脱氯单胞菌属(Dechloromonas)和固氮螺菌属(Azospira)相对丰度在CW-P中分别降低了25.58%~67.59%和15.22%~ 33.49%.而中村菌属(Nakamurella)、嗜酸菌属(Acidovorax)、固氮弧菌属(Azoarcus)、慢生根瘤菌属(Bradyrhizobium)和沙壤土杆菌属(Ramlibacter)的相对丰度在CW-P中分别增加了118.12%~624.16%、7.31%~24.36%、168.68%~221.65%、7.31%~38.36%和9.74%~10.35%.结果表明,黄菖蒲对PS MPs暴露下湿地中反硝化细菌的影响较为复杂,植物一方面通过根系分泌物为微生物提供可利用的碳源,刺激异养反硝化菌的生长;另一方面,植物的根系泌氧作用使得湿地环境中溶解氧浓度升高,抑制了部分反硝化菌的生长.
3 结论
1) 黄菖蒲湿地和无植物湿地均可有效去除PS MPs,出水浓度均随暴露时间的延长而增加.
3) PS MPs的长期暴露对黄菖蒲的光系统和抗氧化系统造成损伤,光合色素含量(叶绿素a、叶绿素b和类胡萝卜素)和SOD活性明显下降.
4) PS MPs短期和长期暴露时,黄菖蒲湿地的微生物物种丰度、多样性和均匀度更高,2组湿地微生物群落结构存在明显差异.
5) 黄菖蒲湿地中硝化细菌和反硝化细菌的总体丰度更高,且在菌属分布上有所差异.

