工程微生物合成香草醛的进展与挑战
邱 笛,周 超,张根林
(石河子大学 化学化工学院 新疆兵团化工绿色过程重点实验室,新疆 石河子 832003)
香草醛(4-羟基-3-甲氧基苯甲醛),又称香兰素,由于具有类似奶油香草味气味,经常被用作香料、食品和化妆品的添加剂[1]。另外,香草醛还具有抗真菌[2]、抗癌[3]和抗氧化[4]等生物活性,被广泛应用于制药领域[5-6]。预计到2025年,香草醛的全球需求量将在2016年18 600 t的基础上增加6.2%[7]。目前,香草醛可通过天然提取、化学合成以及生物合成法获取。天然提取的香草醛来源于芸香科的香豆荚[8-9],通过渗透法(乙醇和水)、油树脂法(乙醇)或超临界CO2萃取法获得[9-10]。因为植物提取获得的香草醛产量低、成本高且香豆荚种植需要占用大量的土地,不能满足市场的需求。化学合成的香草醛,是由化石资源的碳氢化合物制备的,如愈创木酚和丁香酚,其中,以愈创木酚为基础的工业生产过程是利用乙醛酸作为缩聚剂,将甲酰基引入苯酚中形成中间产物,随后再由苯基乙醛酸转化为醛[11-12],由愈创木酚合成的香草醛占全球供应市场的85%。虽然化学合成的香草醛产量高、成本低,但是反应过程使用有毒有害的化学试剂以及底物选择性差[13-14],所以不符合绿色化学和可持续的理念。
随着代谢工程和合成生物学的发展,利用DNA重组、基因编辑技术,定向调控生物体的代谢网络并改造宿主细胞,以可再生资源为底物生产有价值的天然产物成为研究热点。通过在微生物宿主中重建代谢途径、阻断竞争代谢支路等策略引导碳流更快更多地流向目标产物,平衡代谢通量,可提高目标产物的产量。目前,已有利用微生物以葡萄糖、丁香酚、异丁香酚、木质素和阿魏酸等不同碳源合成香草醛的研究,可见生物合成香草醛是一种很有前景的绿色制造工艺[15-16]。基于此,本文全面综述香草醛的生物合成途径、优化与调控香草醛合成途径的相关工程策略,同时提出微生物异源合成香草醛所面临的挑战,以期为香草醛的高效生物合成提供参考。
1 工程微生物细胞合成香草醛
近20年来,人们利用微生物以不同底物合成香草醛,解析并验证了香草醛的合成途径。微生物合成的香草醛代谢途径主要有2条(图1):芳香族氨基酸途径和莽草酸途径[17]。芳香族氨基酸途径合成的香草醛起始于苯丙氨酸[18-22]或酪氨酸[23-30],而从莽草酸途径合成的香草醛以3-脱氢莽草酸[31-35]为前体。除了这2条途径外,研究人员还设计了其他的代谢策略[36-60]来合成香草醛。
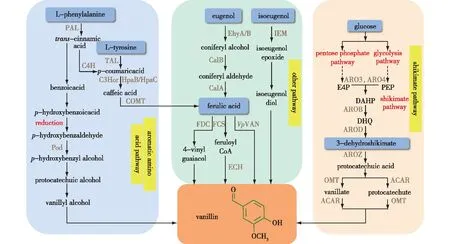
PAL—phenylalnine ammonia lyase;C4H—cinnamate-4-hydrosylase;TAL—tyrosine ammonia lyase;C3H—4-coumarate 3-hydroxylase;HpaB/HpaC—4-hydroxyphenylacetate 3-hydroxylase;COMT—caffeate O-methyltransferase;EhyA/B—eugenol hydroxylase;CalB—coniferyl alcohol dehydrogenase;CalA—coniferyl aldehyde dehydrogenase;FDC—coenzyme-independent decarboxylase;FCS—trans-feruloyl-CoA synthetase;ECH—enoyl-CoA hydratase/aldolase;VpVAN—vanillin synthase;IEM—isoeugenol monooxygenase;ARO3/ARO4—3-deoxy-D-arabinoheptulosonate-7-phosphate synthase;AROB—dehydroquinate synthase;AROD—dehydroquinate dehydratase;AROZ—3-dehydrogenase shikimic acid dehydrase;OMT—O-methyltransferase;ACAR—carboxylic acid reductases。蓝色代表芳香族氨基酸途径,绿色代表其他合成路径,橙色代表莽草酸途径图1 生物合成香草醛的可能途径Fig.1 The possible bio-synthetic pathway of vanillin
1.1 利用苯丙氨酸合成香草醛
在植物中,香草醛基于L-苯丙氨酸的脱氨作用,通过木质素前体肉桂酸、对香豆酸、咖啡酸以及阿魏酸,最终形成香草醛。具体过程如下:苯丙氨酸解氨酶(PAL)催化苯丙氨酸脱氨生成反式肉桂酸,然后经过肉桂酸4-羟化酶(C4H)和对香豆酸3-羟化酶(C3H)两步羟化形成咖啡酸,再利用甲基转移酶(MTs)的甲基化作用合成香草醛前体阿魏酸,最后在阿魏酰辅酶A合成酶(FCS)和水合酶/醛缩酶(ECH)作用下生成香草醛[18-19]。
在植物中,苯丙氨酸解氨酶(PAL)和2种依赖细胞色素P450酶的C4H和C3H参与催化L-苯丙氨酸合成香草醛中的前体咖啡酸[20]。因为P450酶在细菌宿主中的表达难以实现,所以Huang等[21]在大肠杆菌中以L-苯丙氨酸为前体物,利用其内源的4-羟基苯乙酸-3-羟化酶(4HPA3H)从头合成,得到766.68 mg/L咖啡酸。此外,Luo等[22]在大肠杆菌中通过敲除基因tyrA(编码预苯酸脱氢酶)防止碳通量流向酪氨酸,增强L-苯丙氨酸的供应,使咖啡酸产量提高至1 355.8 mg/L,说明提高L-苯丙氨酸的供应对香草醛的合成非常重要。
1.2 利用酪氨酸合成香草醛
酪氨酸是芳香族氨基酸中的重要成分,是生产黄酮类、生物碱类和萜类化合物的关键前体[23]。可以L-苯丙氨酸生产香草醛,不过中间产物——对香豆酸可以直接由L-酪氨酸生成[24]。与从L-苯丙氨酸合成香草醛的途径相比,从L-酪氨酸的途径更简短,可以避免反式肉桂酸的存在,特别是L-酪氨酸的4位含有羟基,直接由酪氨酸解氨酶(TAL)作用生成对香豆酸。因此,L-酪氨酸作为前体可能优于L-苯丙氨酸[25]。在以L-酪氨酸合成香草醛的途径中,中间产物咖啡酸的合成研究成果较多。Kang等[26]利用优化后的TAL和C3H,在高产酪氨酸的大肠杆菌中,合成了150 mg/L咖啡酸。Jang等[27]以L-酪氨酸为起始物,利用TAL将L-酪氨酸转化为对香豆酸,然后在C3H的羟化作用下得到咖啡酸,在添加200 mg/L酪氨酸的条件下产生了191.8 mg/L咖啡酸。为了避免补充酪氨酸,Li等[28]在酿酒酵母中表达RcTAL和C3H,从葡萄糖合成11.4 mg/L咖啡酸。为了减轻异源合成受质粒拷贝数的限制,Qi等[29]在酿酒酵母中也使用类似的合成途径从L-酪氨酸合成香草醛前体咖啡酸,并通过多拷贝染色体整合策略提高咖啡酸的产量,使咖啡酸的产量比Li等[28]的结果提高了32%[30]。Ni等[1]利用大肠杆菌为宿主,以L-酪氨酸为底物,将其转化为4-香豆酸后,再利用阿魏酸介导的香草醛生物合成途径,获得97.2 mg/L香草醛。
1.3 莽草酸途径合成香草醛
3-脱氢莽草酸可由葡萄糖的糖酵解途径(EMP)的赤藓糖-4-磷酸和磷酸戊糖途径中(PPP)磷酸烯醇式丙酮酸的经缩合反应获得。香草醛合成能以3-脱氢莽草酸为前体,经3-脱氢莽草酸脱水酶合成原儿茶酸,然后在氧甲基转移酶(OMT)和羧酸还原酶(ACAR)的作用下生成香草醛,或经过ACAR的还原作用生成原儿茶醛,最后在OMT的甲基化作用下生成香草醛。1998年,Li等[31]首次在大肠杆菌中以葡萄糖为简单碳源从头合成香草酸,在高产3-脱氢莽草酸的大肠杆菌中引入AroZ、COMT和来自粗糙脉孢菌(Neurosporacrassa)的芳基醛脱氢酶(ALDH),最终仅检测到微量的香草醛,且ALDH还原香草酸的过程需要额外补充辅因子NADH。Hansen等[32]通过引入诺卡氏菌的ACAR和磷酸乙酯转移酶实现在酵母中合成香草醛,因为ACAR能催化ATP和NADPH将原儿茶酸还原成原儿茶醛且将香草酸还原为香草醛,基于此,分别在酿酒酵母和裂殖酵母中以葡萄糖合成45和65 mg/L香草醛,成为酵母合成香草醛的开端。但由于宿主内许多内源性的酶容易将所需的醛转化为不需要的醇,成为微生物合成香草醛的主要障碍[33]。因此,2014年,Kunjapur等[34]在大肠杆菌K12中通过敲除控制醛酮还原酶和醇脱氢酶表达的基因,以葡萄糖为原料获得119 mg/L香草醛,比亲本菌株的产量高55倍。2016年,Kunjapur等[35]利用3-脱氢莽草酸脱水酶(AsbFBt)催化内源性的3-脱氢莽草酸转化为原儿茶酸且过表达氧甲基转移酶(OMTHS)合成香草酸,最后在羧酸还原酶(CarNi)与加入的蛋氨酸作用下,香草醛的产量增加到419 mg/L。
1.4 其他途径合成香草醛
异丁香酚是廉价易得的生物质,由异丁香酚合成香草醛是利用异丁香酚单加氧酶(IEM)使其侧链氧化而得到[36]。Zhao等[37]用两亲性短肽18A和异丁香酚单加氧酶融合增强异丁香酚单加氧酶的活性,由异丁香酚生物转化得到14.5 mmol/L的香草醛。随后,Wang等[38]利用来自硝基还原假单胞菌Jin1中具有高特异性的异丁香酚单加氧酶,转化得到252 mmol/L香草醛。同样,丁香酚也可作为合成香草醛的经济底物,在丁香酚羟化酶(EhyA/B)作用下生成松柏醇,然后其被松柏醇脱氢酶(CalB)氧化为松柏醛,之后松柏醛被松柏醛脱氢酶(CalA)转入阿魏酸合成香草醛的途径中。以阿魏酸[39-40]为前体生产香草醛可以分为非辅酶A依赖型和依赖辅酶A两种方式,非辅酶A依赖型是通过香草醛合酶(VpVAN)实现的。如Gallage等[41]利用香草荚中内源性的VpVAN催化阿魏酸转化为香草醛。同样,Arya等[42]利用Agrobacterium介导的VpVAN在香豆荚中催化阿魏酸合成香草醛,但是含量仅为544.72 μg。因为阿魏酸转化为香草醛只是阿魏酸分解代谢的一个中间步骤,产生的香草醛可迅速转化为其他副产物或通过烟酰胺腺嘌呤二核苷酸(NAD)依赖的反应将香草醛转化为香草酸。为了防止香草醛进一步氧化,Gioia等[39]利用荧光假单胞菌BF13为宿主,最高得到1.28 g/L的香草醛,证实敲除香草醛脱氢酶vdh基因是获得高产量香草醛所必需的[43]。Fleige等[44]使用拟淀粉菌Amycolatopsissp.ATCC 39116,以此同样敲除vdh基因并过表达fcs/ech获得突变株,高产19.3 g/L香草醛。Furuya等[45]在大肠杆菌中表达辅酶脱羧酶(FDC)、加氧化酶(Cso2),以阿魏酸为底物将4-乙烯基愈创木酚 (4-vinylguaiacol)转化生成7.8 g/L香草醛。研究者们发现,FCS和ECH不仅依赖辅酶A,而且两者的比例对香草醛产量影响很大[46-47]。最近,Chen等[48]在大肠杆菌JM109中将fcs和ech基因比例调控为1∶1,成功构建由阿魏酸生物合成香草醛的全细胞催化体系,将20 mmol/L阿魏酸转化为15 mmol/L香草醛,有效地消除了高浓度阿魏酸引起生产香草醛的瓶颈问题。表1总结了相关代谢途径合成香草醛的成果。

表1 工程微生物合成香草醛策略及其产量
2 工程微生物合成香草醛面临的挑战
尽管香草醛的生物合成被认为是环境友好且低能耗的方法,但是其合成受到复杂的酶促反应和辅因子供应等条件的限制[61]。因为对宿主细胞来说,香草醛的存在对宿主存在威胁,导致细胞生长受抑制[62],所以解除反馈抑制和增强异源酶的高效表达是香草醛生物合成的关键性因素[63-64](图2)。
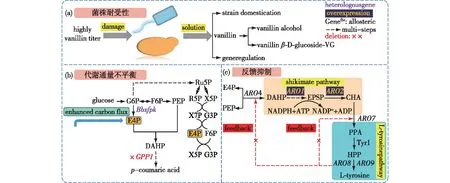
图2 工程微生物合成香草醛面临的挑战Fig.2 Challenges of vanillin production in engineered microorganism
2.1 宿主耐受性
对大多数宿主来说,高浓度的香草醛不仅对细胞生长有抑制效应,还会影响与氨基酸代谢相关蛋白质合成,最终抑制细胞活性[65-67]。另外,微生物在生产香草醛的过程中,由于细胞的呼吸会分泌乙醇,高浓度乙醇的存在会对细胞生长造成胁迫并干扰氧化还原平衡[68-69]。因此,增加工程菌对环境的耐受性是突破香草醛生物合成瓶颈的重要途径。代谢基因的调控、目标化合物的转移和菌株的驯化是解除香草醛和乙醇对细胞毒害的主要方法。
第一种方法是通过基因调控来提高菌株对香草醛的耐受性。Liang等[70]成功鉴定宿主与香草醛耐受性相关的醛酮还原酶基因GCY1和过氧化物酶膜信号受体基因PEX5,并证实还原酶失活体Gcy1pY56F具有NADPH依赖的香草醛还原酶活性,可以直接增强菌株对香草醛的耐受性。Cao等[71]证实,转录因子YRR1缺失能增强HAA1编码的转录激活因子促进转录与翻译过程,从而提高酵母对香草醛的耐受性。第二种方法是目标化合物香草醛的修饰转移,通常是将香草醛的醛基进行羟化、醛基糖苷化来降低香草醛毒害作用[72-73]。引入还原酶将香草醛转化为毒性较低的香草醇研究较多。Wang等[74]过表达醇脱氢酶(ADH6)、YNL134C(NADH依赖的醛还原酶)和YJR096W(烯酮还原酶)基因,促进香草醛还原为香草醇。Brochado等[75]利用计算机模拟,在酿酒酵母中引入尿苷二磷酸葡萄糖醛酸转移酶(UGT),利用在分批培养中得到毒性更低且更易溶的β-D-葡萄糖基香草醛(vanillinβ-D-glucoside-VG)。在高乙醇的特定条件下,Natesuntorn等[76]证实DNA某些区域的拷贝数变化可以提高酿酒酵母的耐受性。Morard等[77]发现,酿酒酵母中非整数倍的Ⅲ号染色体在乙醇耐受进化实验中经常存在,且非整数倍体可被自然菌株用来增强自身的乙醇耐受性。除此之外,研究人员还尝试增加麦角甾醇含量来维持细胞膜的流动性和稳定性以减轻产物香草醛对细胞代谢的负担[78-79]。
2.2 代谢通量不平衡
生物合成香草醛效率低的另一挑战是代谢通量不平衡。因此,代谢工程的重点是重新编辑细胞代谢通路,解除内源性代谢以产生高附加值产品[80]。莽草酸途径合成香草醛需要2个前体:4-磷酸-赤藓糖(E4P)和磷酸烯醇式丙酮酸(PEP)。然而,酵母中E4P的可用碳通量至少比PEP的少一个数量级[81]。为了高效提供E4P,并解决其内在的稀缺性,Liu等[82]将酵母中的中心碳代谢途径重排,引入来自短双歧杆菌的磷酸酮醇酶(Bbxfpk)和来自克鲁氏梭菌的磷酸转乙酰化酶(Ckpta)的异源磷酸酮醇酶途径(PHK),最终将部分碳通量从糖酵解途径直接导向E4P,过表达Bbxfpk后E4P的浓度增加5.4倍;随后,敲除PHK途径中的GPP1,使p-HCA(合成香草醛的前体物)产量提高40%,该策略可以将更多代谢通量流向E4P。Hassing等[83]将中心碳与芳香族氨基酸代谢直接连接,以提高酵母生产2-苯乙醇的能力,主要是过表达丙酮酸激酶变体和消除苯乙醇形成,以此消除对羟基苯乙醇形成来改善磷酸烯醇式丙酮酸供应,显著提高了酿酒酵母中2-苯乙醇的产量。
代谢通量的分支竞争途径也是代谢通量不平衡的主要原因。在大肠杆菌中含有许多具有醛还原酶活性的内源性酶,会导致形成的最终产物是香草醇而不是香草醛,Kunjapur等[34]通过灭活3种醛酮还原酶(AKRs)和乙醇脱氢酶(ADHs),得到香草醛产量为119 mg/L。
2.3 反馈抑制
生物合成香草醛可以利用苯丙氨酸和酪氨酸为起始物,但是以苯丙氨酸、酪氨酸为底物的酶在转录和翻译水平上受到严格调控[84-85](图2)。在酿酒酵母中,过表达反馈不敏感突变酶3-脱氧-D-阿拉伯糖庚酮糖-7-磷酸(DAHP)合酶和分支酸突变酶(chorismate mutase)来实现消除对关键酶的反馈抑制[86]。DAHP合酶由ARO4基因编码,是催化芳香族氨基酸途径的第一步,如果其229位的亮氨酸突变为赖氨酸得到ARO4K229L,则可使其不再被酪氨酸反馈抑制[87]。第二个受到酪氨酸抑制并由色氨酸激活的基因是ARO7,如果将用甘氨酸取代141位的丝氨酸,得到的ARO7G141S,可消除酪氨酸的抑制作用[88]。Luttik等[86]变构调控ARO4和ARO7的表达,可显著影响胞内苯丙氨酸、酪氨酸的浓度。Gold等[89]在酵母中通过敲除苯丙酮酸脱羧酶基因ARO10并过表达ARO4K229L的基因,最终将酪氨酸积累到129 mmol/L。之后,Rodriguez等[90]同样过表达抗反馈抑制ARO4K229L和ARO7G141S的基因,并敲除丙酮酸脱羧酶基因PDC5和ARO10,最终获得香草醛前体对香豆酸的产量为1.93 g/L。Li等[91]为了解决L-酪氨酸途径的瓶颈,对酿酒酵母BY4741进行遗传修饰,通过过表达突变的ARO4K229L和ARO7G141S的基因,使香草醛前体物对香豆酸的产量提高3.61倍;同时,删除PDC5和ARO10来减少副产物苯乙醇的形成。Zhou等[92]在酿酒酵母中敲除GAL80调控系统以消除酪氨酸反馈抑制且删除苯丙酮酸脱羧酶基因(ARO10),咖啡酸产量从222.7 mg/L提高到569 mg/L,成功强化了香草醛中间体咖啡酸的合成。
3 提高生物合成香草醛的工程化策略
为了缓解香草醛生物合成途径中存在的挑战,关键酶的筛选、辅因子的优化、混菌的培养等均是有效的工程化策略(图3)。

图3 提高香草醛产量的工程化策略Fig.3 Strategies of enhancing the titer of vanillin
3.1 关键酶的筛选
在香草醛合成路径中,特定酶的活性或特异性低造成中间产物的积累是导致终产物含量低的瓶颈之一。因此,代谢工程目标之一就是提高关键酶的表达水平[93-94]。香草醛的合成途径涉及多个关键酶表达,如裂解酶、羟化酶、脱氢酶和脱羧酶等(表2)。因为香草酸作为代谢途径的副产品存在[95-96],所以引入羧酸还原酶的酶促反应策略可以有效提高香草醛含量,如来自诺卡氏菌的羧酸还原酶CAR,以ATP和NADPH为辅因子,在大肠杆菌中具有较高的香草酸还原活性[97-98]。Park等[99]从脓肿分枝杆菌中得到B1MLD编码的CAR,再由CAR介导的全细胞生物催化,可还原产生2.86 g/L香草醛。因为引入羧酸还原酶需要消耗较多能量,将其甲基化可提高香草醛的产量并提高其稳定性[100-101]。甲基转移酶催化的氨基酸通常是组氨酸或酪氨酸,以S-腺苷甲硫氨酸(SAM)为甲基供体通过SN2亲核取代进行甲基化[102]。Hansen等[32]通过表达儿茶酚甲基转移酶(HsCOMT)来增强香草醛的合成效率,将香草醛生物合成途径引入裂殖酵母和酿酒酵母中,利用葡萄糖分别合成香草醛65和45 mg/L。同样,Kunjapur等[35]利用来自H.sapiens的儿茶酚甲基转移酶从头合成香草醛,发现从原儿茶酸甲基化合成香草醛是限速步骤,基于此,敲除抑制甲硫氨酸合成的转录因子metJ、过表达甲基化途径的metA和cysE基因,最后得到香草醛产量为272 mg/L。由此可见,在香草醛合成途径中涉及甲基化反应时,可通过解除对S-腺苷甲硫氨酸生物合成和再生来提高香草醛产量。尽管通过使用来自H.sapiens的儿茶酚甲基转移酶能提高香草醛含量,但是其活性较低。为了提高氧甲基转移酶活性,还可以利用蛋白质工程手段提高甲基转移酶的特性[103],达到以非天然的底物来合成所需的甲基化产物。
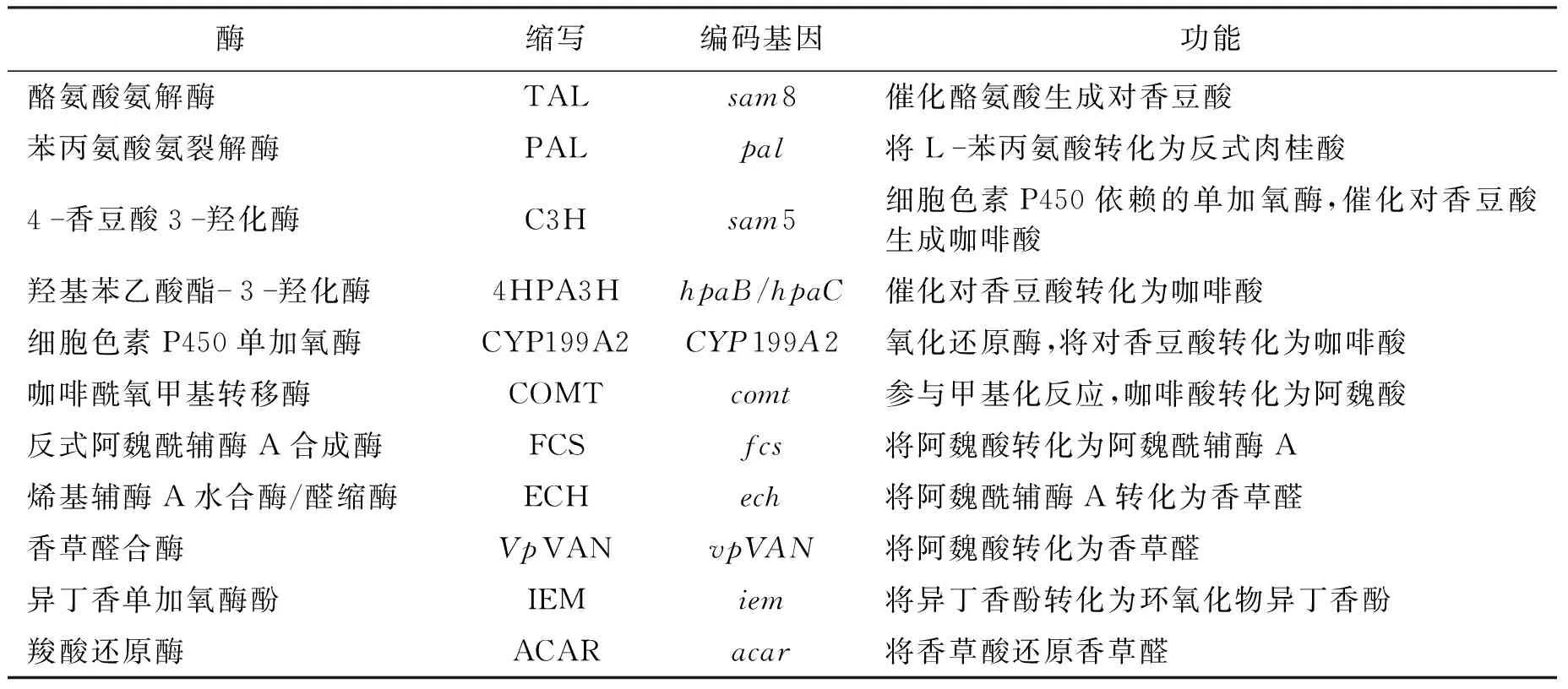
表2 香草醛合成中涉及的关键酶
除了关键酶的筛选外,酶性能的改造对提高高附加值产物的产量也有重要作用。定向进化、半理性设计以及理性设计是改造酶的主要手段。霍亚楠等[104]在大肠杆菌中通过定向进化改造来自黏红酵母的酪氨酸氨裂解酶TAL,将筛选的酶在S9N和A11Y位点进行组合突变,可解决TAL酶活性低的问题,最终获得394.2 mg/L对香豆酸。异丁香酚单加氧酶(IEM)是从异丁香酚合成香草醛的关键酶,但受到产物抑制而导致酶活低,Zhao等[37]通过半理性设计进行定点突变筛选得到突变酶T52P,获得酶活提高35%的突变菌。甲基转移酶(OMT)是合成香草醛前体阿魏酸的关键酶,但其催化活性低限制了香草醛的高效合成,Law等[105]构建COMTY200L突变体,将其区域选择性提高到90%,从而提高了甲基转移酶的活性。因此,通过对关键酶的筛选以及对关键酶进行改造,可以提高酶的活性,增加其与底物的结合力,从而提高目标产物的含量。
3.2 辅因子供应
辅因子,如ATP、NADP(H)/NAD(H)及金属元素等对生物体的生化反应至关重要[106-107],因为某些关键酶常需要辅因子来维持高活性,而辅因子供应不足可能导致合成过程受限。因此,通过改变辅因子供应是实现高附加值化学品高效生产的重要方法[108-110]。
咖啡酸作为香草醛合成的核心前体物之一,其合成与辅因子供应密切相关[111]。在细菌中难以实现P450酶的功能表达,主要是因为细菌缺乏细胞色素P450还原酶(CPRs)/氧化还原伴侣。因此,Qiu等[5]在咖啡酸合成中使用HpaB和HpaC异源酶组合代替依赖于细胞色素P450单加氧酶的C4H,在此过程中,电子通过HpaC从NADH转移到FAD形成FAD(H2),被HpaB进一步捕获,在O2存在下氧化对香豆酸[112-113],因此,FAD(H2)可能是电子转移中的限速步骤。Chen等[114]过表达磷酸双乙酰酶/磷酸酮醇酶(XFPK/PTA)与天然转醛缩酶Tal,同时抑制E4P且促进NADPH再生,有利于酵母合成咖啡酸。此外,增加胞内S-腺苷甲硫氨酸的供应也是提高天然产物产量有效的方法[115-116]。Chen等[117]利用来自拟兰芥的咖啡酰O-甲基转移酶(AtCOMT)在大肠杆菌中以简单碳源代替3,4-二羟基苯甲醇(3,4-DDBA)从头合成,得到240.69 mg/L的香草醇。在香草醛合成途径中,从咖啡酸到阿魏酸步骤中存在S-腺苷甲硫氨酸甲基供体和NADPH的供应问题。为了提高SAM生产中NADPH的浓度,通过sRNA方法敲除NADPH消耗途径的aroE、argC、proA、ilvC和proC这5个基因,使SAM浓度比野生菌株的提高70%[118]。同时,金属离子在香草醛合成中也有重要意义,如敲除钼酸盐转运体有助于增加香草醛的产量[119]。
3.3 共培养策略
因为大肠杆菌不能高效表达细胞色素P450酶[120],而酿酒酵母合成芳香族氨基酸受到反馈抑制[90],所以可利用共培养系统将整个合成途径分配在不同宿主中,可以实现对香草醛的高效合成。
共培养策略是利用菌株间的互利共生作用来提高目标产物产量、减少宿主细胞代谢负担且确保辅因子供应和代谢通量平衡[121-123]。利用共培养系统合成高值化学品的成果不少,如紫杉醇、柚皮素和迷迭香酸等。Zhou等[124]将不能单独产生紫杉醇前体的酿酒酵母与大肠杆菌共培养,以此将乙酰化二醇紫杉烷的合成途径分为两个模块,最终获得33 mg/L含氧紫杉烷。Zhang等[125]建立酿酒酵母与大肠杆菌共培养体系,以D-木糖为唯一碳源来培养2种工程菌生产柚皮素,还可以避免生成副产物乙醇。基于此,将共培养策略应用于生物合成香草醛途径有积极意义[126-128]。Lesage等[129]利用黑曲霉与担子菌合成香草醛,因为阿魏酸可被黑曲霉分解为香草酸,然后香草酸被担子菌还原为香草醛,由此获得237 mg/L的香草醛。在以苯丙氨酸为起始物合成香草醛中间体时,细胞色素P450依赖的C4H在香豆酸[130]的生产中起关键作用,因此利用酿酒酵母代替大肠杆菌表达P450酶可有效促进香草醛的合成。香草醇是香草醛前体,Yang等[131]利用共培养策略,以2株大肠杆菌(YMC12和YMC13)分别作为上下游宿主以减少菌株间竞争,用葡萄糖和甘油作为混合碳源,菌株YMC12负责用甘油产生3,4-DHBA,而菌株YMC13将3,4-DHBA转化为香草醇,当两株菌的接种量为1∶1时,最终得到328.9 mg/L香草醇。由此可见,共培养策略在高效合成香草醛及其衍生物方面有较好的潜力。
4 总结与展望
随着对香草醛合成代谢途径的不断研究以及相关酶和基因的鉴定和表征,利用工程微生物合成香草醛成为新的机遇。本文综述了香草醛生物合成面临的3个主要挑战并分析了造成这些挑战的主要原因。为了获得高产量的香草醛,目前研究主要集中在以下方面:①对合成途径进行调整和关键酶挖掘;②提高菌株对香草醛耐受性;③保证辅因子供应,促进氧化还原平衡。未来,我们还可以通过多种策略进一步提高香草醛产量:①通过人工智能与机器学习相结合,理性设计获得活性更高的酶,构建调控元件,使能量最优地流向香草醛的合成。②构建智能传感器,在线监测香草醛合成,同时设计反应器,建立反应分离耦合体系,及时分离终产物以降低毒性;③与发酵工程相结合调控细胞内氧化还原状态,同时利用融合蛋白的表达来减少微生物生产香草醛过程中副产物的积累。

