乙酸型甲烷八叠球菌细胞工厂的设计与构建研究进展
严云峰,闫 震,2
(1. 山东大学 环境科学与工程学院 山东省水环境污染控制与资源化重点实验室,山东 青岛 266237;2. 山东大学苏州研究院,江苏 苏州 215123)
甲烷既是可再生的清洁能源,也是第二大温室气体,全球甲烷排放量中有超过70%来自地球厌氧环境中栖息的产甲烷古菌[1]。作为地球上最古老的生命之一,产甲烷古菌在生物地球碳循环中扮演着重要角色,它的生长代谢及其产甲烷过程与地球气候的变化息息相关[2]。目前已知的生物甲烷排放主要来自乙酸型与H2/CO2型两条产甲烷途径,而乙酸型产甲烷途径贡献了其中的三分之二[3-4]。因此,深刻认识乙酸型产甲烷途径的微观作用机制,可为甲烷的减排及其作为能源的合理利用奠定理论基础。
乙酸型甲烷八叠球菌(Methanosarcinaacetivorans)是一种严格厌氧的产甲烷古菌,属于广古菌门、甲烷微菌纲、甲烷八叠球菌科、甲烷八叠球菌属[5-6]。M.acetivorans于1984年从美国加利福尼亚州附近海域的海洋沉积物中分离获得[7],数十年来,M.acetivorans已成为研究乙酸型产甲烷途径的模式菌株。不仅如此,由于代谢途径的多样性与可遗传操控性,M.acetivorans表现出作为开发合成生物学底盘和构建微生物细胞工厂的巨大潜力[8]。
因此,笔者在综述M.acetivorans的产甲烷代谢途径、遗传改造策略和细胞工厂构建3个方面研究进展的基础上,分析M.acetivorans与其他进行乙酸型产甲烷代谢的产甲烷古菌在这三方面的异同,并对进一步设计和构建其作为微生物细胞工厂所面临的问题与挑战进行展望。
1 乙酸型产甲烷途径


图1 乙酸型产甲烷代谢途径及3种能量代谢模式(修改自文献[4,8])Fig.1 Aceticlastic methanogenesis and three modes of energy metabolism(Modified from reference [4,8])
2 遗传改造策略
2.1 传统的基因编辑方法
在生化和生理学研究基础之上,对乙酸型产甲烷古菌的进一步了解与改造需要借助分子生物学的遗传改造策略。不同于其他产甲烷古菌,Methanosarcina属的乙酸型产甲烷古菌不仅能利用多种底物进行生长代谢产甲烷[32],而且M.acetivorans和M.barkeri作为遗传操作的模式产甲烷古菌,还能在固体培养基中很好地维持单细胞形态[33],这些特征都为乙酸型产甲烷古菌的遗传改造提供了便利[34]。
一方面,传统的遗传改造策略是利用片段同源重组或位点特异性整合来完成对宿主染色体上基因的敲除、插入或置换(图2)[35-38]。通常有2种方法可用于构建靶基因敲除菌株(图2(a)和图2(b))[36],一种是利用pMP44衍生质粒经过两次同源重组实现基因的无标记敲除(表1)[35-39],前提是靶基因是非必需的且敲除后生长速率不受影响,理论上基因成功敲除的概率为50%[38];另外一种是先利用线性化的pJK301衍生质粒经两侧同源重组进行靶基因敲除,再导入pMR55质粒,利用翻转重组酶(Flp)识别和重组两侧的特异性位点(FRT),从而去除筛选和反筛选标记基因(pac-hpt)编码的操纵子标记,特点是FRT“疤痕”将保留在删除位置(表1)[35-36]。目的基因在染色体上的插入通常利用位点特异性整合的方式将整个质粒整合到特定的hpt位点(图2(c)),通常选用pAB79衍生质粒或pJK026A系列衍生质粒,特点是均可以通过ΦC31位点特异性重组整合至M.acetivorans基因组内[39-41]。相应地,要求宿主菌株应携带组成型表达的ΦC31位点特异性重组酶基因(int)和整合到染色体hpt上的ΦC31attP位点。M.acetivorans的基因进行阳性检测对于染色体上关键基因的确定至关重要。使用四环素(Tc)依赖性启动子PmcrB(tetO)对检测基因启动子进行原位置换,利用四环素抗性阻遏蛋白(TetR)与启动子内的操作子序列(tetO)作用机制来控制检测基因的表达水平,再比较在基因不同表达水平下菌体生长情况来确定基因的必要性[39,42]。启动子原位置换是利用线性化的pGK050A系列衍生质粒通过两侧同源重组来实现。同样地,重组时利用的pac-hpt操纵子标记可通过导入pMR55质粒来去除,从而实现无标记的遗传改造(图2(d))[35]。
另一方面,传统的遗传改造策略是利用可自主复制的穿梭载体在不整合至宿主基因组的情况下完成目的基因的表达。研究人员以M.acetivorans自身的pC2A质粒为基础,开发出一系列可在E.coli/Methanosarcina中自主复制的穿梭载体[34,43],在M.acetivorans单个细胞中利用pC2A复制子可获得约6个拷贝数[39,44]。以常用的穿梭质粒pWM321为例[34],质粒上含有可在E.colipir+DH5α中复制的R6K复制子、可供筛选的氨苄青霉素抗性基因以及可在M.acetivorans中复制的pC2A复制子和可供筛选的嘌呤霉素抗性基因(表1)。同时,pWM321质粒还提供一个大型的多克隆位点方便目的基因相关表达原件的插入。需要注意的是,为避免自主复制质粒整合到染色体上,转化时所用的宿主应缺失ΦC31int基因且不包含任何ΦC31附着位点[38]。
另外,传统的遗传改造策略还包括通过改造和优化核心启动子及核糖体结合序列(RBS)增强蛋白的表达。在古菌和真核生物中,转录起始速率由相同的3个核心启动子元件控制,分别是TATA盒、RNA Ⅱ聚合酶转录因子识别元件(BRE)和转录起始位点(TSS)。另外,古菌中RBS的翻译启动与细菌类似,都是基于Shine-Dalgarno序列识别[45]。Karim等[46]通过将合理设计的突变引入Mcr的β亚基(mcrB)基因的核心启动子和RBS中,建立了对M.acetivorans蛋白质水平的表达调控,结果发现:通过改造核心启动子和核糖体结合位点可使M.acetivorans的调控蛋白质水平在60倍范围内发生可预测的变化。这一发现为乙酸型产甲烷菌代谢工程改造提供了更精准的调控策略。
2.2 CRISPR-Cas9介导的基因编辑技术
CRISPR-Cas9技术具有精准、高效和脱靶率低等特点,已经广泛应用于真核和原核生物的基因编辑[47]。近年来,针对产甲烷古菌的CRISPR-Cas9基因编辑技术已成功应用于M.acetivorans[48-49]与H2/CO2型产甲烷古菌M.maripaludis[50]改造,这无疑为产甲烷古菌的遗传改造提供了新策略。
Nayak等[48-49]研究发现,利用Cas9介导的同源定向修复手段进行基因的插入和敲除是非常精准且高效的(图3(a))。一方面,所有的转化子在基因组内都能发生所需的突变且没有脱靶活性;另一方面,遗传改造所需时间由传统方法的8~12周缩短至3~4周,将多个sgRNAs在同一转录本中表达,进而引导Cas9在不影响转化效率的前提下同时对宿主染色体引入多个突变,极大地减少了构建复杂菌株所需的时间。另外,通过设置合适的对照实验,基于Cas9的质粒转化结果就可以很好地确定染色体上基因的必要性,还可以操纵必需基因,如添加串联亲和标签等[49]。在M.acetivorans中,以CRISPR-Cas9基因编辑技术应用为例,Cas9的表达、sgRNA以及同源修复片段(DNA Donor)的合成都依赖于pDN_CRISPR系列质粒的构建[48]。完整的pDN衍生质粒上除了关键的pC2A复制子和pac-hpt筛选标记外,还包括PmarB(tetO1)引导表达的化脓链球菌Cas9、甲醇诱导型启动子PmtaCB1介导转录的sgRNA和同源修复片段(切割位点两侧各500~1 000 bp的同源序列)。如果采用脂质体介导的方法转化质粒并以自主复制的方式在菌体内表达,必须注意的是为避免质粒整合至基因组内,转化时所用的宿主应缺失ΦC31int基因且不包含任何ΦC31附着位点。此外,近期Nayak等[48]研究发现,通过sgRNA引导Cas9特异性切割产生致命的DNA双链断裂(DBS)不仅可以通过修复片段的同源重组来进行基因编辑,而且可以通过与Methanocellapaludicola非同源末端连接(NHEJ)机制共表达的方式在微同源区产生长度不等的缺失来完成遗传改造。

图3 CRISPR-Cas9和CRISPRi-dCas9遗传改造机制(修改自文献[48,50])Fig.3 CRISPR-Cas9 and CRISPRi-dCas9 genetic modification mechanisms(Modified from reference [48,50])
在产甲烷古菌中的基因编辑策略除了利用CRISPR-Cas9系统的sgRNA引导Cas9切割和定向修复进行基因的缺失和插入之外,还可以利用sgRNA引导存在缺陷或失活的dCas9与DNA结合(CRISPRi-dCas9),在不产生切割的前提下阻断基因转录的起始和延伸来抑制基因表达(图3(b))。Dhamad等[50]通过将pDN衍生质粒中的Cas9替换为dCas9来制备目的pDL系列衍生质粒,并以M.acetivorans中参与固氮的基因簇[51-53]为靶向评估dCas9介导的靶基因抑制效果,结果发现:当sgRNA靶向固氮基因(nif)的两个独立区域(启动子Pnif和关键基因nifD)时,nif转录本的丰度降低幅度>90%,M.acetivorans的固氮功能丧失;当sgRNA靶向固氮酶辅因子合成必需基因(nifB)时,nifB转录的本丰度降低幅度>85%,固氮功能未完全丧失;当sgRNA靶向nif阻遏子编码基因(nrpR1)时,nif操纵子转录本的丰度增加,M.acetivorans可以通过固氮作用正常生长。这一系列结果揭示了CRISPRi-dCas9系统在靶基因抑制方面的突出效果,为产甲烷古菌的遗传改造提供了新思路和新方法。
总的来说,产甲烷古菌的遗传改造是一个相对较新的发展领域,其独特的代谢过程和重要的生态学意义使其成为近年来遗传研究的热点。此外,产甲烷古菌可以作为整个古菌域的遗传改造模型,针对现有基因编辑方法的优化改进以及扩大产甲烷古菌遗传改造的研究范围都有着较好的研究前景。
3 以M. acetivorans为底盘细胞的细胞工厂构建
3.1 基于产甲烷途径构建细胞工厂
厌氧消化是实现有机废弃物资源化最有效的技术之一,实现形式是产生以甲烷为主要成分的生物沼气,对环境污染物处理和可再生能源生产具有重要意义。厌氧消化最终的产甲烷阶段由产甲烷古菌负责,这也是整个厌氧消化反应的关键限速和控制步骤。然而,多数产甲烷古菌对环境因素极其敏感,如pH的突然变化、盐或有机物浓度的增加、负载速率的改变或有毒化合物的引入,通常会导致系统故障,这会极大地影响产甲烷阶段的代谢速率。与其他产甲烷古菌相比,Methanosarcina属菌株对所处环境的变化有着更强的抵抗性。de Vrieze等[54]发现,M.acetivorans与M.barkeri可耐受的总铵质量浓度高达7 g/L、盐质量浓度高达18 g/L(以Na+计)以及乙酸盐质量浓度高达15 g/L,并且可以抵抗0.8~1.0个单位的pH变化。基于这些特点,当环境因素影响生物沼气生成的稳定性和高效性时,可将M.acetivorans作为合适的生物增强型接种物强化厌氧消化过程中的甲烷再生。
随着以M.acetivorans为底盘微生物的遗传改造技术的快速发展,以M.acetivroans纯培养物作为微生物细胞工厂的研究也越来越受到关注。Lessner等[55]通过引入来源于Pseudomonasveronii的编码广泛特异性酯酶基因mekB,将M.acetivorans的酯酶活性提高80倍,使其将源自乙酸甲酯和丙酸甲酯的甲基转化为甲烷,进一步增加了Methanosarcina可用底物的范围。Aldridge等[56]利用Methanosarcina作为细胞工厂合成化工原料异戊二烯:其一是将异戊二烯合成酶基因ispS导入M.acetivorans中,在以甲醇为底物的分批培养条件下,M.acetivorans的异戊二烯产量是细菌Clostridiumljungdahlii的6×106倍,是自养型蓝细菌Synechocystis的179倍;其二是将ispS基因导入M.barkeri中后发现,能以甲醇或者H2/CO2为底物生产异戊二烯,不过产率分别为M.acetivorans(底物为甲醇)的3.8%和2.4%[56]。近期,Schöne等[57]通过敲除编码M.acetivorans产甲烷途径的关键酶Mtr的基因与适应性进化培养,可重构其产甲烷生长代谢途径为CO依赖型的产乙酸生长代谢途径,这对于进一步了解产甲烷途径的功能进化过程以及拓宽产甲烷古菌作为微生物细胞工厂的应用范围具有重要意义。
3.2 基于反向产甲烷途径构建细胞工厂
在厌氧发酵链的末端,产甲烷古菌产生的生物甲烷,一部分被同处于厌氧环境的甲烷氧化古菌(ANME)所消耗,未被消耗的部分排放入大气,若能有效利用ANME在厌氧环境中作为“甲烷汇”的重要功能,就可缓解甲烷排放入大气对地球造成的温室效应[58]。ANME所进行的甲烷厌氧氧化属于热力学吸能反应,需要耦合体外电子受体,如硝酸盐、三价铁或四价锰的还原才能进行[59],这造成ANME生长极其缓慢,目前还没有纯培养物被分离,更没有可进行遗传改造的分子生物学技术,所以很难开发作为细胞工厂进行甲烷生物转化研究。由于ANME与产甲烷古菌起源于广古菌门共同的祖先,应用基于宏组学技术对ANME的富集培养物研究发现,与产甲烷途径及其能量代谢相关的关键基因在ANME宏基因组也普遍存在并具有较高的表达丰度,基于此,ANME被认为采用反向的产甲烷途径进行甲烷厌氧氧化。系统发育进化分析发现Methanosarcina与ANME的若干分支亲缘关系较近,因此以M.acetivorans与M.barkeri等纯菌株为底盘细胞研究反向产甲烷途径提供了理想平台。Yan等[60]通过生物化学技术研究M.acetivorans与胞外三价铁的电子互营机制,揭示了胞外三价铁驱动甲烷厌氧氧化的分子机制(图4)。近期,Yu等[61]研究发现,M.barkeri可利用三价铁或阳性电极作为电子受体进行甲烷厌氧氧化,但是否可以进行以甲烷作为唯一碳源的生长代谢还有待进一步研究。

图中左侧为M. acetivorans产甲烷代谢途径,右侧为M. acetivorans反向产甲烷代谢途径。其中反应(1)是反向产甲烷代谢途径的第一步,反应不可逆且需辅以三价铁作为电子受体;反向产甲烷途径的反应(2)中所需Na+来自Fdred氧化过程中产生;其余反应步骤均可逆图4 M. acetivorans产甲烷代谢途径和反向产甲烷途径的比较(修改自文献[4])Fig.4 Comparison of methanogenic metabolic pathway and reverse methanogenic pathway of M. acetivorans(Modified from reference [4])
利用遗传改造技术构建以M.acetivorans为底盘细胞的甲烷转化细胞工厂也在如火如荼地进行中。Soo等[62]将ANME编码反向产甲烷代谢途径第一步催化甲烷氧化的关键酶Mcr的基因克隆至M.acetivorans以强化甲烷厌氧氧化,辅以三价铁作为电子受体,可实现以M.acetivorans作为微生物细胞工厂转化甲烷为生物燃料前体乙酸。McAnulty等[63]将Clostridiumacetobutylicum中编码3-羟基丁酰辅酶A脱氢酶的基因(hbd)克隆至甲烷氧化强化型M.acetivorans中以此合成乳酸,最高获得约6 μmol的乳酸产量。另外,McAnulty等[64]还将甲烷氧化强化型M.acetivorans、电活性细菌Geobactersulfurreducens以及经甲烷驯化的污泥共培养,可将甲烷转化为电能,具体机制为M.acetivorans利用反向产甲烷途径捕获甲烷并产生乙酸,甲烷驯化污泥中的微生物(如Paracoccusdenitrificans),通过提供电子穿梭体促进电子转移,G.sulfurreducens以乙酸盐来产生电子,以创建微生物燃料电池,将甲烷直接转化为电能。表2总结了近年来将乙酸型甲烷八叠球菌作为细胞工厂的应用实例。
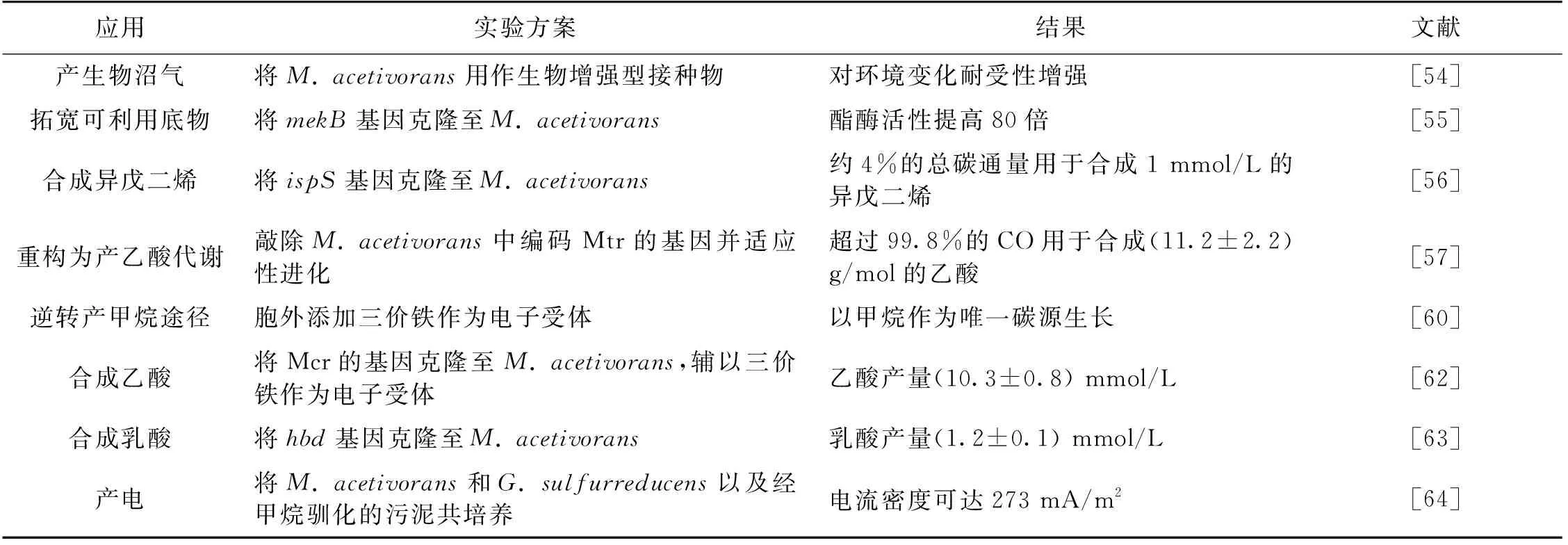
表2 乙酸型甲烷八叠球菌作为细胞工厂的应用
4 结论与展望
详细解析乙酸型产甲烷途径及其能量代谢过程,不仅有重要的环境生态意义,也是开发以乙酸型产甲烷古菌作为底盘细胞构建微生物细胞工厂的理论基础。作为乙酸型产甲烷古菌的模式菌株,M.acetivorans具有代谢途径多样、遗传调控策略清晰、纯培养技术成熟等优点,这些都为以M.acetivorans为细胞工厂开发甲烷的生产及其高值化转化技术提供了可能。尽管如此,与其他模式微生物相比,M.acetivorans相关的分子遗传改造技术开发和细胞工厂构建还处于初级阶段,仍然面临诸多问题与挑战。首先,与其他模式微生物相比,M.acetivorans的生长代谢效率偏低,特别是M.acetivorans的培养、分子遗传操控等技术都需要在严格厌氧条件下进行,这些是开发更为方便快捷的分子遗传改造技术的瓶颈,严重限制了以它作为细胞工厂来生产目标产物的合成效率。其次,对M.acetivorans进行遗传改造的分子生物学工具包还仅为国外的个别课题组开发并拥有,并未由Addgene等公益性组织共享,这对于构建M.acetivorans细胞工厂带来了很多的不便。最后,单一的M.acetivorans细胞工厂稳定性较低、环境适应能力较弱、不易扩大培养规模,所以M.acetivorans作为微生物细胞工厂的巨大潜力还有待进一步发掘。
为解决M.acetivorans生长效率慢的问题,可利用基因组尺度代谢网络模型与13C同位素示踪等技术分析碳代谢流,从全局规模系统地认识代谢网络,预测限制甲烷代谢效率的可调控靶点,再利用代谢工程技术,如启动子工程、RNA调控元件等,平衡各代谢流的基因表达,优化控制各条代谢流的通量,方可实现对于产甲烷和甲烷转化代谢效率的理想优化。为解决无法从公共渠道获得M.acetivorans的遗传改造分子生物工具包的问题,可以尝试利用体外合成的Cas9、sgRNA及DNA Donor共转化的方式替代复杂的质粒构建过程来进行古菌基因编辑,特别地,这一方法已成功应用于真菌和酵母等细胞的遗传改造。最后,为解决单一M.acetivorans细胞工厂稳定性差、环境适应能力弱的问题,可将M.acetivorans与其他微生物共培养,构建以M.acetivorans为中心的合成微生物群落,通过M.acetivorans与其他微生物的营养互营或种间电子传递过程,提升微生物组细胞工厂的稳定性,缓解环境因子对于M.acetivorans自身代谢生长的负面影响,拓展M.acetivorans作为细胞工厂的应用范围。

