溶藻细菌的筛选及群体感应信号对其活力的调节作用
赵 薇,许彤骏,王喻元,曾艳华,周 进
(1. 清华大学 深圳国际研究生院 海洋工程研究院,广东 深圳 518055;2.美国考文垂教会中学,波茨敦 宾夕法尼亚州 19464;3.深圳市红岭中学,广东 深圳 518000)
有害赤潮(HABs)是一种严重的全球性海洋灾害,近年来赤潮发生次数增多,发生区域扩大,危害日益加剧。为了有效地控制HABs,研究者推出了许多措施,包括化学、物理和生物学方法[1]。化学方法则需要利用金属、光敏剂、除草剂和其他化学品破坏藻类的正常代谢来杀死藻细胞;物理方法则需要借助超声、膜过滤和吸附等技术来杀死藻细胞;生物学方法只需要利用自然生态中的水生动物、植物和微生物等来杀死藻细胞。化学和物理方法虽然在一定程度上可以有效去除藻细胞,但是成本较高且容易造成二次污染。因此,具有无毒、高效、专一性强等特点的生物学方法有着明显的优势,已成为研究的热点[2]。
溶藻细菌(algicidal bacteria)的发现为生物防治赤潮提供了可能的途径。细菌对藻类的影响体现在:一方面,细菌吸收藻类产生的有机物质,并为藻类的生长提供营养盐和必要的生长因子,从而调节藻类的生长;另一方面,细菌也可以通过直接或间接作用抑制藻类的生长,甚至裂解藻细胞,从而表现为杀藻效应[3]。溶藻菌在赤潮暴发过程中具有重要的作用,一些研究者认为赤潮的终止与溶藻菌有直接的关系[4]。这类细菌分泌的胞外物质具有高效、专一地杀死或者抑制藻类生长的作用,开发利用这些溶藻菌用于赤潮的生物防控[5]是当今最热门的研究方向之一。近年来,针对溶藻细菌的开发取得了诸多进展。Lovejoy 等[6]在澳大利亚分离到1株Pseudoalteromonas属细菌,该菌在3 h内能导致赤潮藻Gymnodiniumcatenatum、Chattonellamarina和Heterosigmaakashiwo细胞裂解,作用机制在于向海水培养基释放活性物质而起作用。Doucette等[7]分离到1株细菌Cytophaga41-DBG2,该细菌能产生一种溶解性杀藻复合物从而有效地杀死Gymnodiniumbreve。Imai等[8]从Pseudomonasstutzer中提取出的甲藻生长抑制剂(DGI)活性较高,且毒性较稳定(4 ℃时3个月保持不变),并且对鱼类无害,是比较理想的杀藻物质[9]。Kodani等[10]从日本东京Shinobazu池塘中分离到12株具有杀藻活性的细菌,9株属于Pseudoalteromonassp.,其中K44-1的甲醇提取物具有明显的杀藻活性,进一步从中提取到1-甲基-β咔啉,在30 μg/disc时能抑制几种蓝藻的生长。关于杀藻机制,一般认为它通过作用于生理过程如阻断呼吸链、抑制细胞壁合成以及抑制孢子的形成等方面,以达到抑制藻细胞生长或杀灭藻细胞的目的。
在溶藻菌株的研究历程中,针对细菌的分离、溶藻范围、溶藻化合物以及作用机制(直接或间接)都有了较多的积累[1]。然而,需要注意的是,细菌的行为是一种群体表现,其功能效应的发挥依赖一定的细胞密度,而溶藻行为的产生是否依赖于群体,是否受控于某种信号调节还未曾揭示。因为细菌间存在的通讯语言——群体感应信号(quorum sensing,QS)具有多样化的生态功能[11]。在微生物之间,QS可引发一系列的连锁反应,表现出群体效应,完成一系列单一物种不可能完成的任务。目前这一理论已对诸多生物学现象进行了阐释,如铜绿假单胞菌(Pseudomonasaeruginosa)毒力的形成、沙门氏菌(Salmonellasp.)耐药性的产生、哈维氏弧菌(Vibrioharveyi)生物荧光的出现以及微生物被膜(biofilm)的产生等[12]。早期,针对群感信号调节下的溶藻行为仅仅在铜绿微囊藻有过零星报道[13-17],而在其他藻类(如甲藻)中的作用还未曾提及。为此,我们推测群体感应信号在溶藻活力的过程中起了一定的调节作用。为了验证这一假设,我们从藻际微生物中筛选了溶藻菌株,并选取代表性的一种进行重点研究(包括QS信号分子的检测、QS突变株的构建以及野生株与突变株溶藻活力比较等),以期找寻信号调节下的溶藻行为,扩充对微生物溶藻机制的认识。
1 材料与方法
1.1 试剂及藻种
1.1.1 试剂
蛋白胨、胰蛋白胨、酵母提取物,Oxoid公司;CTAB、TEMED、过硫酸铵(Thiamine. HCl),华美生物工程公司;Tris、琼脂糖、氨苄青霉素,厦门泰京生物技术有限公司; DAPI、dNTP、IPTG、X-Gal,Promegagon公司、DNA marker,MBI Fermentas公司;其余试剂均为国产分析纯试剂。
1.1.2 培养基
f/2培养基:NaNO375 mg、NaH2PO4·H2O 5 mg、Thiamine·HCl 0.1 mg、Na2EDTA·2H2O 4.36 mg、FeCl2·6H2O 3.15 mg、CuSO4·5H2O 0.01 mg、ZnSO4·7H2O 0.022 mg、CoCl2·6H2O 0.01 mg、MnCl2·4H2O 0.18 mg、NaMoO4·2H2O 0.006 mg、生物素 0.5 μg以及维生素B120.5 μg,陈海水定容到1 L。
LB培养基:NaCl 10 g、胰蛋白胨10 g、酵母提取物5 g,琼脂粉 10 g(固体培养基),pH 7.0~7.2,去离子水定容到1 L。
LB-Amp培养基:LB培养基灭菌后,冷却到50 ℃,加入氨苄青霉素至终质量浓度为100 μg/mL。
Zobell 2216 E培养基:蛋白胨5 g、酵母提取物1 g、磷酸铁0.1 g、琼脂粉 10 g(固体培养基),pH 7.6~7.8,陈海水定容到1 L。
R2A培养基:酵母粉0.5 g、朊蛋白胨0.5 g、水解酪蛋白0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、丙酮酸钠0.3 g、K2HPO40.3 g、MgSO40.05 g、琼脂粉10 g,溶解于1 L陈海水中。
1.1.3 藻种
实验用的藻种主要为裸甲藻(Gymnodiniumaeruginosum),由本实验室从自然水域中分离获得。藻类所用培养液为f/2培养液。藻类置于室内三角瓶中培养,温度为(20±1) ℃,光照条件为12 h 光照∶12 h黑暗。
1.2 样品采集与微生物培养
样品采自深圳海域自然发生的裸甲藻赤潮。用采样瓶装取含有赤潮的表层水样,然后置于冷藏箱中立即运回实验室。经梯度(10-1、10-2、10-3、10-4、10-5和10-6)稀释后取稀释液50 μL涂布于R2A固体培养基。将平板置于28 ℃培养箱培养3~7 d,挑取菌落形态有差异的(大小、形状、颜色、表面等)单克隆转接到R2A固体培养基。经过进行1~2次纯化后,将纯化的菌株用固体斜面培养基4 ℃保存。
1.3 菌株鉴定
利用基因组提取试剂盒EasyPure Genomic DNA Kit(北京全式金生物技术股份有限公司)提取菌株的基因组DNA。16S rRNA基因扩增采用通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行。PCR反应体系为25 μL,之后通过10 g/L琼脂糖凝胶电泳检测PCR产物,目的片段大小在1 500 bp左右的PCR产物送至深圳华大基因科技有限公司测序。将得到的基因序列与EzBioCloud数据库(https:∥www.ezbiocloud.net/identify)中的序列进行同源性比对,取相似度最高的作为细菌参考分类。
1.4 溶藻活力及藻细胞酶活测定方法
将纯化后的细菌接种于50 mL Zobell 2216E液体培养基中,28 ℃、150 r/min摇瓶培养至培养基耗尽(约培养至48 h),取40 mL进行离心,离心后的上清液过0.22 μm滤膜得到无菌滤液,参照文献[18]的方法按照1%的接种量加入指数生长的裸甲藻培养液中。定时取样,参照文献[19]介绍的方法采用FDA染色计活细胞数,按式(1)计算杀藻率。以不添加任何物质的无菌藻培养液作为对照,实验组和对照组设置3个重复。
杀藻率=(NC-NT)/NC×100%
(1)
式中:NC表示对照组中的活细胞数,NT表示实验组中的活细胞数。
采用浮游植物荧光仪PhytoPam (德国WALZ公司)并行分析实验组与对照组的叶绿素含量(μg/L)。
添加滤液后继续培养藻类24 h(此时藻细胞接近指数后期,密度约为2.0×104个/mL),取50 mL藻液10 000g离心10 min收集藻体,用于以下指标的测定。
丙二醛(MDA)含量测定:收集的藻细胞加入等体积的三氯乙酸与硫代巴比妥酸,煮沸 20 min,迅速冷却,5 000 r/min离心5 min后,分别测定450、532和600 nm处的吸光值A450、A532和A600。样品中 MDA含量的计算见式(2)。
c=6.45(A532-A600)-0.56A450
(2)
式中:c为MDA的浓度,μmol/L,A为吸光值[20]。
超氧化物歧化酶(SOD)活力测定:向离心后的藻细胞加入预冷至4 ℃的pH 7.8的磷酸缓冲液(含1% 聚乙烯吡咯烷酮PVP和0.25% Triton-100)和少量石英砂冰浴研磨,匀浆液7 000 r/min离心10 min,取上清液测定酶活性。按照试剂盒(南京建成生物科技有限公司)的方法测定SOD活性。
SOD活性=(A0-As)Vt/(0.5A0×cells×Vs)
(3)
式中:A0为对照管的吸光值,As为样品管的吸光值,Vt为样液总体积,Vs为测定时样品用量。
1.5 群体感应信号AHL的检测方法
采用薄层色谱法(TLC)分析AHL信号分子。菌株在摇瓶发酵24 h后收集上清液(1 L),采用乙酸乙酯进行萃取,其步骤:向离心后的上清液中加入等体积的乙酸乙酯(含0.2%冰醋酸)并充分振荡,静置分层后再次充分振荡,待液体静置再分层后,收集上层有机相;取下层水相重复萃取2次,然后合并3次萃取的所有上层有机相;采用旋转蒸发仪将全部萃取液蒸发至干燥,最后用1 mL乙酸乙酯(含0.2%冰醋酸)重新溶解蒸馏烧瓶底部的萃取物,得到的AHL萃取液置于-20 ℃保存。
AHL信号分子的判断通过TLC确定[21]。首先通过预实验确定AHL标准品和萃取液的最佳上样量,能够使A136(Agrobacteriumtumefaciens136)产生明显颜色反应的AHL萃取液或AHL标准品的最小上样量即为TLC分析的最佳上样量。本研究中使用AHL标准品(C6-HSL、C8-HSL、C10-HSL和3-O-C8-HSL,Sigma公司)为对照进行TLC分析,步骤如下:首先在TLC平板(20 cm×20 cm TLC aluminum sheets;RP-18 F254 S,Merck公司)底部距离下边缘2 cm处用铅笔和直尺轻轻划一条直线;分别取AHL标准品与AHL萃取液以2 cm的间距点样品(按照确定好的最佳上样量)到直线上;上样完毕后,将TLC平板置于含有甲醇和水(体积比为60∶40)的展层剂中(展层剂不要没过直线),待展层剂到达距离TLC平板上边缘约2 cm处时将平板拿出;待平板完全吹干后置于平底容器中,并向平板上倾倒含有A136菌液的软琼脂(配制方法与最佳上样量实验一致)。待琼脂凝固后均匀涂布X-Gal,用锡箔纸覆盖TLC平板所在的容器并置于28 ℃培养24 h。通过与AHL标准品比较来确定AHL萃取液中的信号分子结构。
1.6 AHL突变株与回补株的构建方法
分子克隆与原核表达、基因敲除与回补等遗传操作实验用到的大肠杆菌和质粒见文献[21]。所有大肠杆菌均在37 ℃下LB培养基中培养,必要时需向培养基中添加氨苄青霉素(100 μg/mL)、卡那霉素(50 μg/mL)或四环素(5 μg/mL)。AHL报告菌株AgrobacteriumtumefaciensA136(pCF218)(pCF372)通常在28 ℃下含有壮观霉素(50 μg/mL)和四环素(4.5 μg/mL)的LB培养基中培养。
为了探究AHL对溶藻活力的调控作用,以YTD5-新鞘氨醇杆菌为例,通过框内缺失突变法(in-frame deletion)对菌株的AHL功能基因进行了敲除[22]。用来构建突变株的引物序列见文献[21]附表Ⅱ。敲除步骤:首先分别扩增待敲除基因两侧的序列(片段大小500~1 000 bp为宜),通过第二轮融合PCR将这两个侧翼序列连接在一起;然后利用事先设计好的双酶切位点将此融合片段克隆到自杀质粒pAK405上,并将重组质粒转化进E.coliS17-1/λpir中;最后通过接合转移的方式转入菌株SZD1-新鞘氨醇杆菌中。染色体上的突变整合利用卡那霉素(50 μg/L)筛选,并用菌落PCR的方法验证。把经证实的转化结合子在不含抗生素的R2A液体培养基中培养,然后稀释涂布在含有链霉素(100 μg/L)的R2A平板上;随后,为了获得目标基因敲除的菌株,利用PCR的方法对卡那霉素敏感且耐受链霉素的菌株进行筛选。最后,通过对突变区域测序的方式来验证这些筛选出来的突变株。
在进行基因回补实验时,首先利用文献[21]附表Ⅱ中的相应引物扩增目的基因及其自身启动子序列,进而利用无缝连接试剂盒将此扩增片段与pCM62连接,然后将重组质粒电转化到目的基因已敲除的突变株中获得回补株,最后,通过菌落PCR及四环素抗性来验证基因回补是否成功。
1.7 野生株、突变株与回补株溶藻能力检测方法
挑取野生株YTD5-新鞘氨醇杆菌、QS突变株及QS回补株的单克隆分别接种在R2A液体培养基中,于200 r/min、28 ℃条件下过夜振荡培养;当细菌生物量(OD600)达到0.9左右时,收集上清液,再检测溶藻活力,每个实验组与对照组设置3个平行。
1.8 数据统计
统计学分析包含3个重复数据,结果以平均值±标准差表示。数据分析采用SPSS 18.0统计软件处理,以P值表示差异性(P<0.05为差异显著,P<0.01为差异极显著)。
2 结果与讨论
2.1 溶藻细菌的筛选与鉴定
将筛选到可培养的单克隆菌株121株,通过细菌培养物添加实验获得具有溶藻活力的菌株17株。使用16S序列分析并去除重复后,共得到10株细菌(序号为YTD1~YTD10)。序列经GenBank 数据库比对后,以同源性不小于99.9%为判断依据,共获得10株阳性菌株。经鉴定均属于变形菌门(Proteobacteria)的α-变形菌纲(α-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria),分属于5个属,其中,菌株YTD1、YTD2和YDD3属于交替假单胞菌属(Pseudoalteromonassp.);菌株YTD4、YTD6和YTD9属于假单胞菌属(Pseudomonassp.);YTD7和YTD8属于弧菌属(Vibriosp.);菌株YTD5和YTD10分别为新鞘氨醇杆菌(Novosphingobiumsp.)和鞘氨醇单胞菌(Sphingomonassp.),结果统计于表1。
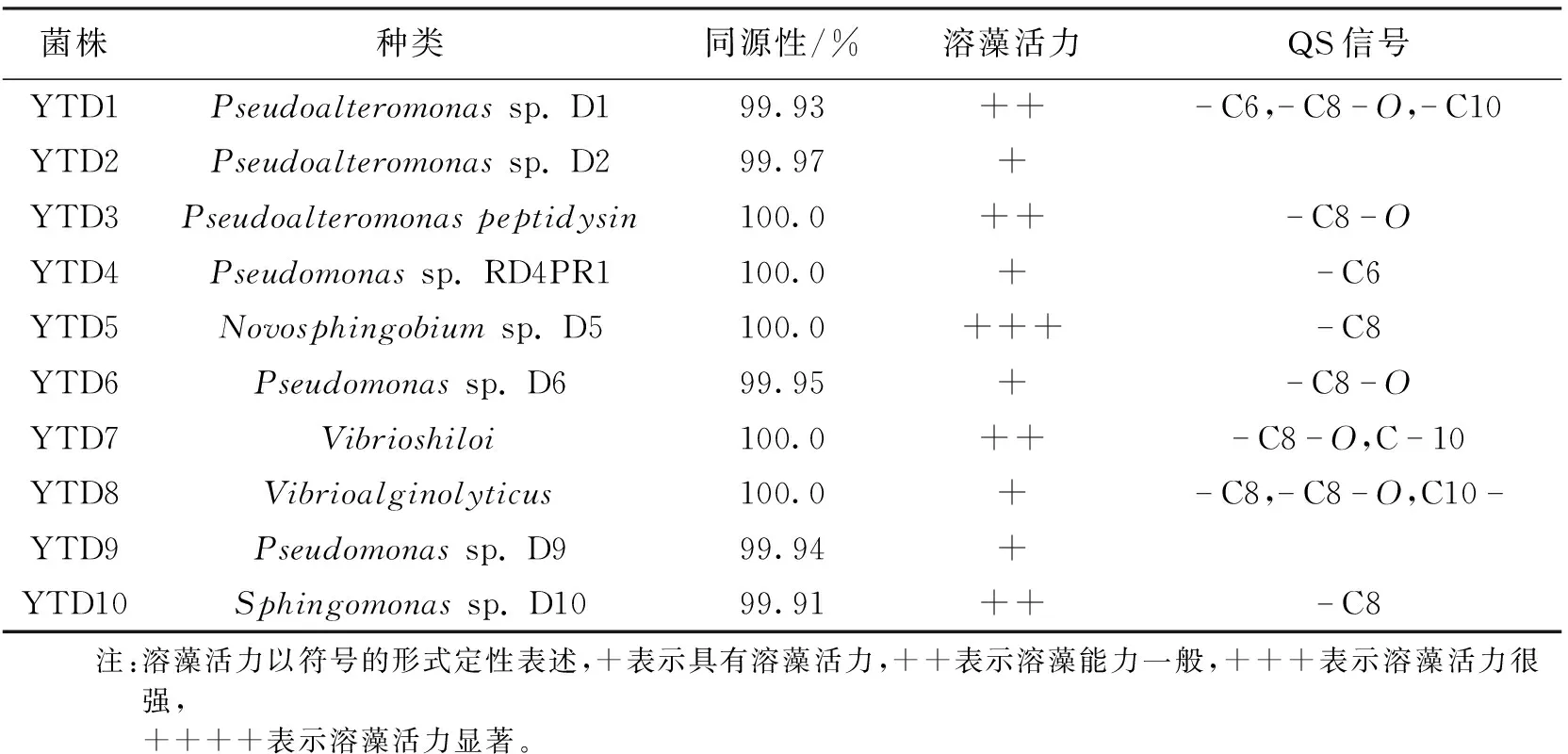
表1 菌株的鉴定
2.2 杀藻细菌的作用方式
不同菌株的溶藻活力如图1所示。由图1可知:在所有细菌的2216E培养液上清均具有一定的抑藻能力,表明它们是通过间接方式溶藻,尤其以YTD5菌株——新鞘氨醇杆菌的溶藻作用最为明显,溶藻能力大于90%。为了探究溶藻细菌对目标藻类的杀灭能力,以溶藻能力最强的菌株——YTD5(Novosphingobiumsp. D5)为例,考察共培养过程中对藻细胞的形态影响,结果如图2所示。由图2可知:添加了细菌滤液后,藻首先沉降于培养瓶底,随着时间延长,藻细胞逐渐收缩,壳板分离,细胞质变得较为致密,此时细胞运动减弱,内部结构变得无序;接着壳板破裂,内容物释放,藻细胞崩解,直至死亡。
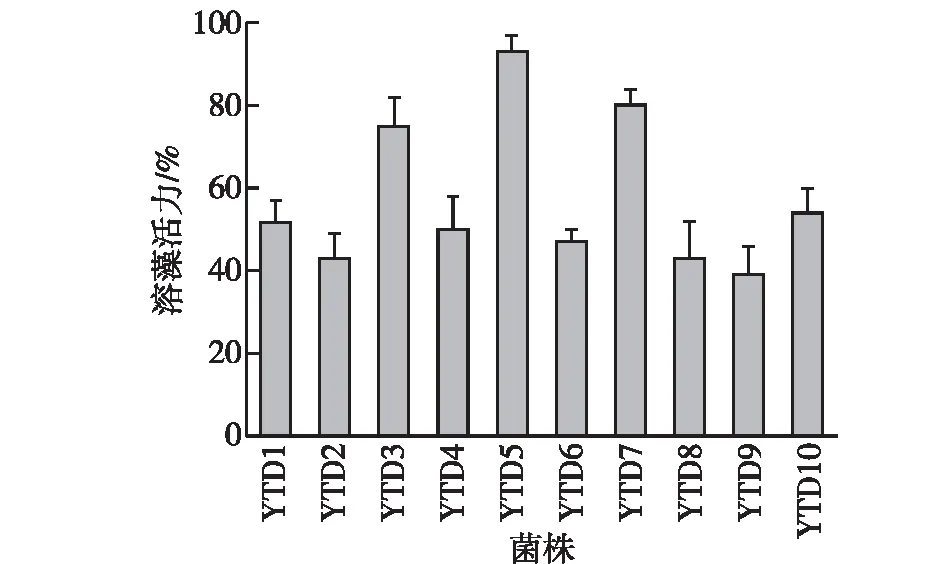
图1 不同菌株的溶藻活力Fig.1 The algicidal rate of ten strains
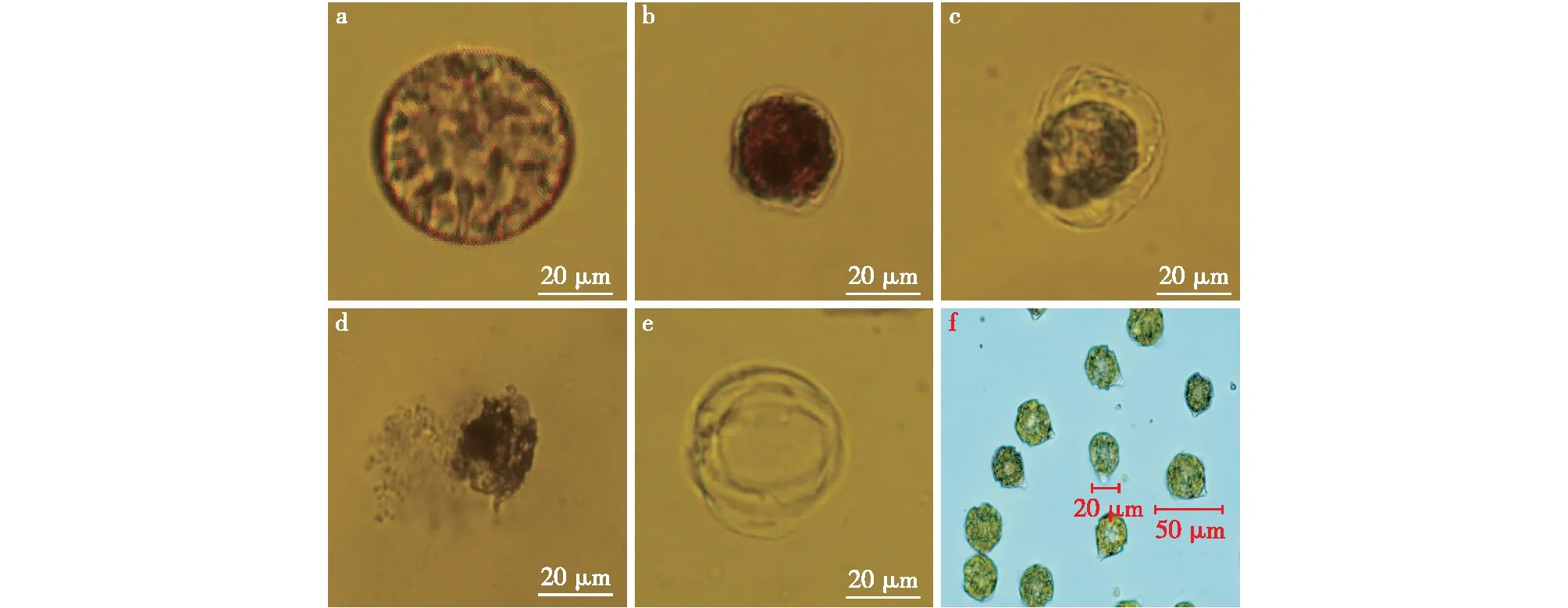
a~e—添加溶藻细菌后不同阶段的藻细胞;f—正常藻细胞图2 添加溶藻细菌后藻细胞的形态变化Fig.2 Morphological changes of algal cell after adding algicidal bacteria
为了获得生理水平的机制,研究了代表性菌株YTD5菌株对裸甲藻的生理影响,结果如图3所示。由图3可知:溶藻细菌培养物滤液的加入使宿主的膜脂过氧化产物MDA含量升高,且呈现添加剂量的依赖性,其中当添加量达到4%时与对照组相比呈现极显著差异(P<0.01),说明溶藻菌滤液的加入促使藻细胞发生了膜脂过氧化;对于藻细胞超氧物歧化酶(SOD)活性的变化情况则是先升后降的趋势,随着添加剂量的上升,SOD活性也上升,至2%的添加量时达到最大值(P<0.01),当添加量达到4%时,SOD活性反而呈现下降趋势,回落到与对照组无明显差异的状态(P>0.05),这一先升后降的过程表明,裸甲藻的生理稳态受到了溶藻细菌胞外滤液的扰动;溶藻菌滤液的叶绿素含量显著降低,除了0.5%的剂量组没有呈现明显差异外,其余剂量组(1%、2%和4%)的添加使得叶绿素含量分别下降了30%、50%和70%(P<0.05)。
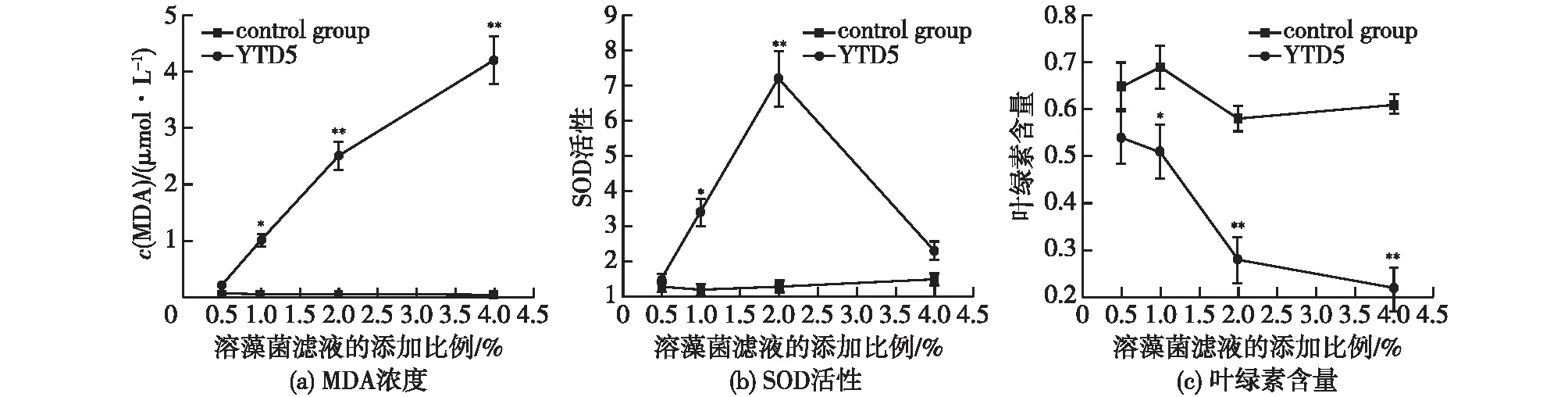
图3 不同比例的溶藻菌滤液对裸甲藻MDA浓度、SOD活性以及藻细胞叶绿素含量的影响Fig.3 Effects of different addition of bacterial filtrate on MDA content,SOD activity,and chlorophyl concentration of target algae
2.3 溶藻细菌群体感应信号能力的检测
对10株细菌代谢产物的抽提物进行TLC检测,鉴定其分泌的AHL信号类型,结果如图4所示。由图4可知:有8株细菌具有明显的斑点显色能力,说明具有产高丝氨酸内酯的能力,经过与AHL标准品的比对和薄层迁移速率分析后发现,其产物主要为C8-HSL、C8-O-HSL以及C10-HSL 3种AHL分子,其中弧菌属(YTD7和YTD8)具有产2种或3种信号分子的能力(C8-HSL、C8-O-HSL或C10-HSL),而交替假单胞菌(YTD2)和假单胞菌(YTD9)在TLC上的没有显色或者很弱,我们目前还不能完全排除这2株菌不具有产信号的能力,可能的原因是抽提物浓度太低,未达到TLC方法的检测限。

S为AHL标准品,YTD1~YTD10为待检菌株图4 TLC分析菌株产AHL的能力Fig.4 Quorum sensing (acyl-homoserine lactones) test of the five strains
2.4 群体感应信号对溶藻活力的调节作用
基于YTD5新鞘氨醇杆菌溶藻能力最强,其AHL分泌的能力也相对突出,因此选择该菌株进行突变株的构建,并评估了QS信号对溶藻活力的调节作用。通过框内缺失突变法敲除了菌株的2个QS基因(novI、novR),得到QS突变株ΔnovI/R,并通过平板划线进行检测,结果见图5。由图5可知:野生株能够在24 h内使AHL报告菌A136产生显著的显色反应,表现出AHL活性;与野生株相比,突变株在经过48 h后依旧只有很弱的产信号能力,说明信号基因的缺失导致了信号产生能力的丧失;同时也表明QS突变株被成功构建。
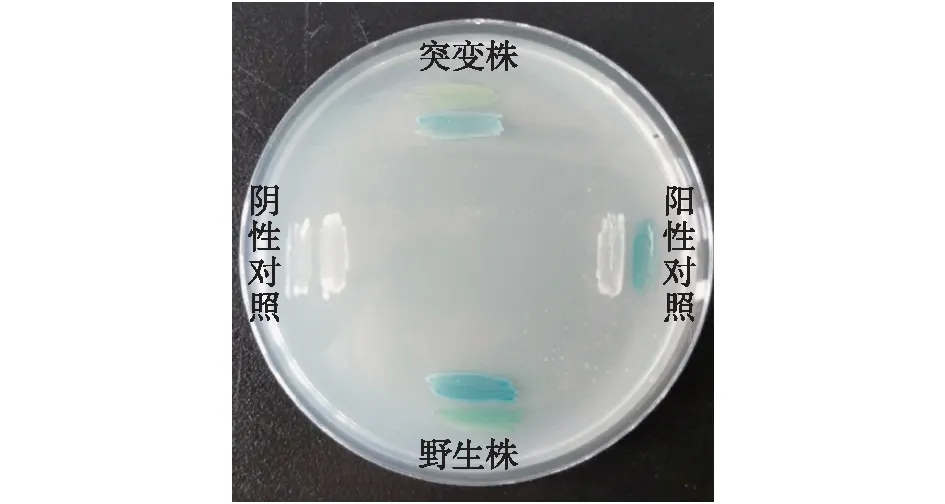
图5 野生株及其突变株产信号能力的检测Fig.5 Quorum sensing detection of wild type and mutant of YTD5-Novosphingobium sp.
为了评估QS对溶藻活力的调控作用,比较了野生株和QS突变株之间溶藻能力的差异,结果如图6所示。由图6可知:以1%的添加量为例,野生株YTD5在12 h内显示出对裸甲藻生长抑制的能力,溶藻率超过75%;而突变株的溶藻能力明显下降,至观察点结束(72 h)也未看到明显的抑藻作用,溶藻能力始终低于10%。回补实验证实当ΔnovI/R基因通过回补质粒转化到相应突变株,其对应回补株ΔnovI/R(pC)的溶藻能力得到了恢复。这表明QS基因的敲除显著降低了溶藻能力,说明QS在溶藻作用中起正调控作用。
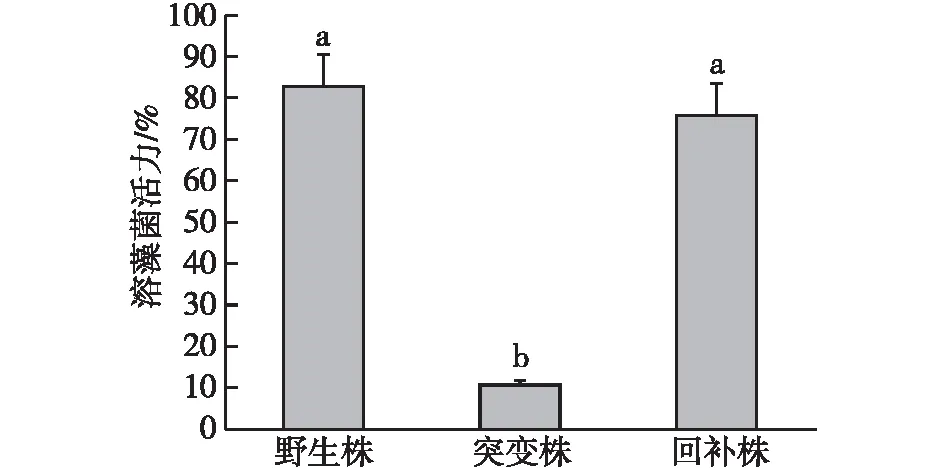
图6 QS信号的缺失对溶藻活力的影响Fig.6 Effects of QS signal on algicidal activity
2.5 讨论
溶藻细菌是一类以直接或间接方式抑制或杀死藻类的细菌统称。虽然近年来发现多株海洋杀藻细菌,但所检测到的杀藻多集中在少数几个类群,已知的杀藻细菌主要属于Bacteroidetes和γ-Proteobacteria,包括Cytophaga、Saprospira、Flavobacterium、Zobellia和Pseudoalteromonas、Alteromonas、Vibrio、Shewanella,这些细菌都是革兰氏阴性细菌[23],偶有革兰氏阳性细菌的报道[24]。本研究中筛选得到多株杀藻细菌,均属于变形菌门(Proteobacteria)的α-变形菌纲(α-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria),包括交替假单胞菌属(Pseudoalteromonassp.)、假单胞菌属(Pseudomonassp.)、弧菌属(Vibriosp.)、新鞘氨醇杆菌属(Novosphingobiumsp.)以及鞘氨醇单胞菌(Sphingomonassp.)。γ-变形菌纲在生态系统中常常是K策略生存者[25],这表明溶藻细菌通常具有较强的竞争能力,包括对宿主的抑制或者杀灭。此外,考虑到海洋中绝大多数细菌尚未能被培养,因此还存在着大量细菌资源等待挖掘。
杀藻细菌的作用方式时常有2种情形:一是需要接触的直接杀藻,二是不需要接触的间接杀藻。前者是杀藻细菌,能够直接进攻并杀死藻细胞,后者则是通过分泌杀藻物质(agicidal substance)来杀死藻细胞。常见的杀藻细菌中,Saprospira和Cytophaga主要是接触杀藻;Alteromonas和Pseudoalteromonas主要是间接杀藻[19]。本研究筛选得到的10株杀藻细菌的2216E培养液均能有效地抑制藻类,属于间接杀藻。Alteromonasstrain K and D、Pseudoalteromonassp. T827/2B、Pseudoalteromonassp. A28也以同种的方式杀藻[8,26-27]。现今越来越多的证据表明:非接触型间接杀藻在溶藻方式中占的比例更大,且在实际的应用中也更具优势。需要指出的是,虽然我们发现了溶藻效应,但对溶藻活性物质还未曾得知,在后续的工作中将采用液相色谱和核磁共振的方式对目标化合物进行鉴定,明确具体的活性成分。
藻类在逆境条件下常发生膜脂过氧化作用,MDA是其产物之一,通常利用它作为脂质过氧化指标,以表征细胞膜脂过氧化程度和藻类对逆境条件反应的强弱[20]。本研究结果发现,未添加无菌滤液的对照组,其MDA浓度维持在较低水平(0.1 μmol/L左右),说明藻细胞膜脂未受到损伤;而当加入无菌滤液后,MDA浓度开始显著升高,说明藻细胞膜脂过氧化水平有明显响应,表明溶藻菌无菌滤液的加入诱发了藻细胞膜脂的过氧化状态,致使膜的通透性和抗稳定性受到损伤,从而加大了细胞内溶物外渗的风险。在不同的添加剂量中,可以看到明显的浓度依赖性,表明可能的杀藻机制是使藻细胞膜受到损伤,进而导致藻细胞裂解。
与此同时,活性氧(ROS)也是对藻类造成氧化伤害的原因之一[28]。SOD是抗氧化系统中主要的酶类,它通过清除细胞中的ROS来消除或减轻氧化损伤[29]。本研究结果表明,当加入0.5%的溶藻菌滤液时,藻的SOD活性显著升高,说明藻体启动自我保护,通过提高SOD活性应对外界压力;当添加量超过4%时,抗氧化酶类活性受到极限胁迫,从而活性明显降低。这表明杀藻细菌分泌的胞外物质能够引起藻细胞的ROS积累,并干扰其抗氧化系统。事实上,在前期的文献中也报道了类似的结果。如,张冬慧[30]发现,溶藻菌WS8胞外活性物质的施入,会使铜绿微囊藻SOD活性随着时间的延长呈现先升高后降低的趋势。吴培枫等[31]用溶藻菌Halomonasp.DH-e无菌滤液处理东海原甲藻,也发现不同浓度的无菌滤液可以使甲藻SOD活性呈现一定的趋势变化,本研究结果进一步验证了前人的结果。由此可以推测,溶藻物质的存在引起了藻细胞膜脂过氧化的加剧及抗氧化系统的紊乱,最终导致生长抑制或细胞裂解的发生。
QS信号是细菌之间的密度调节分子,其中尤以AHLs信号研究的最为广泛。QS可调节菌群的密度和级联行为并实现单个微生物无法完成的生态功能[32],在菌株特性、生物膜的形成、生态系统的发生以及环境适应性上具有重要作用[33]。本研究筛选到的溶藻细菌具有产至少一种AHL的能力,且均分布在α-变形菌纲和γ-变形菌纲。这一结果与Case等[34]仅在变形菌门的基因组中发现了LuxI和LuxR同源蛋白是一致的。经分析发现的群体感应信号类型主要是中长链的高丝氨酸内酯,例如3-O-C8-HSL,它是单胞菌属产生的一类最主要的AHL信号分子[35]。需要指出的是,本研究没有检测到假单胞菌的AHL信号,而前人的结果中报道该菌是常见的信号菌[36],这可能是本研究中提取的信号分子浓度不够,没有达到TLC的检测限,后续我们将进一步提高萃取量进行二次验证。
为了验证群体感应信号对溶藻活力的调节作用,本研究通过框内缺失突变法敲除了菌株YTD5新鞘氨醇杆菌的QS基因(novI、novR),得到QS突变株ΔnovI/R。平行划线检测法显示野生株能够产生显著的显色反应,而突变株只有很弱的产信号能力,这表明我们成功构建了QS突变株。溶藻活力的验证实验证实,QS基因的敲除显著降低了菌株的溶藻率,说明QS在溶藻能力上起正调控作用。以往的研究发现溶藻能力受细菌生理、宿主状态和环境因子多种机制调控,而信号作用下的受调控机制还不清楚。本研究采用QS基因敲除的方式,初步证实了QS对溶藻的正向调控作用,扩充了QS调节下细菌生理行为。
针对QS调节溶藻活力的行为,前期有一些零星的探索。Wu等[14]报道了芽孢杆菌Bacillussp. strain S51107利用NprR-NprX型QS系统调节对铜绿微囊藻的杀灭作用。与此同时,Guo等[17]也证实了气单胞菌Aeromonassp. GLY-2107利用C4和C6短链AHL分子调节对铜绿微囊藻的裂解能力,原因在于AHL控制了溶藻物质3-苄基哌嗪-2,5-二酮和3-甲基吲哚的合成。Chi等[15]证实从东海原甲藻微藻中分离得到的菌株Ponticoccussp. PD-2具有抑制多种藻类(球形棕囊藻、亚历山大藻)的能力,且该菌的溶藻能力依赖于高丝氨酸内酯,因为该信号会影响杀藻代谢产物的产生。Chi等[15]认为,QS调节的杀藻系统可能在赤潮分解过程中发挥潜在作用,QS信号有望作为防控赤潮的一种潜在方法。在硅藻中,交替假单胞菌Pseudoalteromonaspiscicida利用QS信号——2′-庚基-4-喹诺酮调节对颗石藻Emilianiahuxleyi的溶解能力[37]以及高效溶藻菌FDHY-C3利用信号调节中肋骨条藻的裂解[38]。
例如,溶藻弧菌利用QS系统可影响抑藻活力和宿主对Fe的获取机制[39],在甲藻的藻际环境中,还未曾有过专门的报道。我们猜测溶藻细菌借助QS信号调节与宿主的关系,这对帮助我们理解藻菌共生关系和赤潮的消亡机制具有重要意义[40]。然而,现实的结论还需进一步的验证。
3 结论
通过藻际样品的微生物分离,酶活性检测以及群体感应信号突变株的构建,可以得到如下结论:
1)从藻际环境中筛选得到10株能杀藻的海洋细菌,经鉴定分属于交替假单胞菌属(Pseudoalteromonassp.)、假单胞菌属(Pseudomonassp.)、弧菌属(Vibriosp.)、新鞘氨醇杆菌属(Novosphingobiumsp.)以及鞘氨醇单胞菌(Sphingomonassp.);杀藻作用方式研究表明主要是间接杀藻。
2)杀藻机制初步研究表明新鞘氨醇杆菌YTD5培养物滤液的加入使裸甲藻的膜脂过氧化产物MDA含量明显升高,而藻的SOD含量则呈先升后降的变化。这表明膜的稳定性和抗氧化状态的平衡是引发藻类生长受限或细胞裂解的潜在原因。
3)通过对溶藻菌新鞘氨醇杆菌YTD5的基因突变证实溶藻能力的高低受到群体感应信号的调节,表明信号分子对溶藻活力具有正向调节作用,这为后续改造溶藻菌株提供了思路,例如开发底盘细菌,利用合成生物学手段对其进行改造。

