镍纹蛋白样β对脂多糖诱导心肌细胞损伤的抑制作用及其机制
曹红,张小萌,许琮
1 华中科技大学同济医学院附属同济医院综合科,武汉 430030;2 华中科技大学同济医学院附属同济医院肾内科
脓毒血症是ICU常见疾病,其引起的心脏损伤和心功能障碍是导致患者死亡和预后不良的主要原因之一。目前认为,脓毒血症引起的心脏炎症可能与铁死亡有关,而铁死亡在心血管疾病尤其是急性心脏损伤中发挥重要作用[1-2]。铁代谢异常可引起游离铁(Fe2+)浓度增高,膜磷脂重构使得细胞对过氧化连锁反应的敏感性增加,铁介导的类Fenton反应可促进脂质自由基和脂质过氧化物的产生,脂质过氧化物清除系统功能障碍导致其清除不足,这一系列过程最终引起脂质过氧化物蓄积并引发细胞死亡[3]。因此,抑制心肌细胞铁死亡可能是防治脓毒血症心脏损伤的有效方法。镍纹蛋白样β(Metrnβ)是最近发现的一种由骨骼肌和脂肪组织产生的激素,在运动和冷暴露刺激下分泌增加[4]。Metrnβ通过在脂肪库中诱导交替激活的巨噬细胞,以及促进脂肪组织褐变来促进能量消耗,与先天免疫、获得性免疫和炎症通路相关[5-8]。在冠心病患者中,血清Metrnβ水平与心血管事件及患者预后密切相关,并且可减轻肿瘤治疗中与化疗相关的心脏毒性[8]。2021年3月—2022年5月,本研究观察了Metrnβ对脂多糖(LPS)诱导心肌细胞损伤的抑制作用,并探讨是否与调控炎症反应、氧化应激反应及铁死亡有关。现报告如下。
1 材料与方法
1.1 材料 细胞:H9c2心肌细胞购自上海中国科学院细胞典藏中心。主要试剂:DMEM培养基购自美国Thermo Fisher Scientific公司,MTT试剂盒购自美国Abcam公司,DCFH-DA荧光探针购自美国Med Chem Express公司,抗铁死亡蛋白谷胱甘肽过氧化物酶4(Gpx4)活性试剂盒购自美国Beyotime公司,心肌细胞损伤标志物乳酸脱氢酶(LDH)试剂盒购自上海碧云天科技有限公司,炎症反应相关因子[肿瘤坏死因子α (TNF-α)、白细胞介素(IL)-1、IL-6]试剂盒均购自美国Biolegend公司,氧化反应相关因子[活性氧(ROS)、丙二醛(MDA)、谷胱甘肽(GSH)]试剂盒购自上海碧云天科技有限公司,细胞炎症信号分子Toll样受体4(TLR4)抗体购自美国Abcam公司。
1.2 细胞分组及处理 将H9c2心肌细胞置于含有10%小牛血清的DMEM培养基中,于37 ℃、5% CO2培养箱中培养。取对数生长期的H9c2细胞,将其分为LPS组、Metrnβ组、Metrnβ+LPS组及对照组。LPS组、Metrnβ组、Metrnβ+LPS组分别给予1 mg/L LPS、200 ng/mL Metrnβ、1 mg/L LPS+200 ng/mL Metrnβ,对照组给予等体积PBS,作用12 h。
1.3 细胞活性检测 采用MTT法。各组细胞分组处理后去除培养基,PBS清洗,每孔加入MTT溶液10 µL,室温孵育30 min,使用酶标仪检测450 nm处的光密度(OD)值。细胞增殖率=(OD实验孔-OD对照孔)/OD对照孔×100%。
1.4 细胞LDH、炎症反应相关因子检测 采用ELISA法。取各组分组处理后的细胞,每孔加入裂解液50 µL,孵育15 min;收集裂解后的细胞,离心后吸取上清。使用试剂盒检测细胞LDH、TNF-α、IL-1、IL-6表达,严格按照试剂盒说明书操作。
1.5 细胞氧化反应相关因子及Gpx4活性检测 采用ELISA法。将H9c2细胞以1×104/孔接种于96孔板,参照“1.2”进行分组处理,每孔加入DCFH-DA荧光探针1 µL,室温下孵育20 min,采用不含血清的DMEM培养基清洗。使用酶标仪检测各组细胞的荧光强度,以此表示ROS含量,严格按照试剂盒说明书操作。将H9c2细胞以1×104/孔接种于6孔板,参照“1.2”进行分组处理,加入SDS裂解液孵育30 min,收集细胞裂解液,离心后取上清,在酶标仪下检测OD值,以此表示MDA、GSH和Gpx4活性,严格按照试剂盒说明书操作。
1.6 细胞Fe2+检测 采用总铁比色法。取各组分组处理后的细胞,加入裂解液孵育15 min,收集裂解液,离心后取上清进行样本测定。标准孔中加入100 µL分析缓冲液,样品孔中加入5 µL样品并用分析缓冲液稀释至100 µL/孔。在每个标准孔中加入5 µL铁还原剂,每个样品孔中加入5 µL分析缓冲液,37 ℃条件下孵育30 min。加入Fe2+探针100 µL,室温下避光孵育1 h。采用酶标仪检测各组在波长593 nm处的OD值,根据标准曲线计算Fe2+含量,严格按照试剂盒说明书操作。
1.7 细胞TLR4、Gpx4蛋白检测 采用Western blotting法。取各组分组处理后的细胞,加入SDS裂解液孵育30 min,收集细胞裂解液,离心后取上清,检测蛋白浓度后定量为3 000 ng/mL。SDS-PAGE电泳蛋白样本,转膜后采用5%羊血清封闭1 h,加入抗TLR4、Gpx4及内参GAPDH一抗(稀释比例为1∶ 1 000),4 ℃温孵过夜;加入二抗(稀释比例为1∶ 1 000),室温孵育1 h。加入显影液进行显色反应,凝胶系统扫描,Image J软件分析条带灰度值,计算TLR4及Gpx4蛋白相对表达量。
1.8 统计学方法 采用SPSS23.0统计软件。计量资料采用Shapiro-Wilk正态性检验,呈正态分布以表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖率比较 LPS组、Metrnβ+LPS组、Metrnβ组及对照组细胞增殖率分别为40.49% ±10.68%、72.68% ± 8.23%、102.86% ± 18.44%、100.00% ± 14.26%,与Metrnβ组、对照组比较,LPS组及Metrnβ+LPS组细胞增殖率均降低,且LPS组降低更明显(P均<0.05)。
2.2 各组细胞LDH、炎症相关因子、氧化反应相关因子及Gpx4表达比较 与Metrnβ组、对照组比较,LPS组及Metrnβ+LPS组细胞LDH、TNF-α、IL-1β、IL-6、ROS、MDA表达均升高,GSH、Gpx4表达均降低,且LPS组变化更明显(P均<0.05)。见表1。
表1 各组细胞LDH、炎症相关因子、氧化反应相关因子及Gpx4表达比较()

表1 各组细胞LDH、炎症相关因子、氧化反应相关因子及Gpx4表达比较()
注:与Metrnβ组及对照组比较,*P<0.05;与LPS组比较,#P<0.05。
组别LPS组Metrnβ+LPS组Metrnβ组对照组ROS(ng/L)28.83 ± 4.53*11.66 ± 3.50*#1.83 ± 0.98 2.00 ± 1.26 LDH(U/L)44.56 ± 10.88*19.01 ± 5.98*#7.43 ± 2.21 7.93 ± 1.59 TNF-α(ng/L)396.25 ± 48.87*167.76 ± 18.36*#10.85 ± 3.44 10.91 ± 4.15 IL-1β(ng/L)314.45 ± 51.88*101.10 ± 13.98*#8.35 ± 1.09 5.71 ± 2.65 IL-6(ng/L)308.56 ± 45.92*89.55 ± 16.45*#7.83 ± 1.93 11.36 ± 3.02 MDA(nmol/L)3.25 ± 0.81*1.52 ± 0.15*#0.71 ± 0.18 0.78 ± 0.12 GSH(nmol/mg)71.96 ± 10.97*129.36 ± 16.52*#180.05 ± 10.13 176.21 ± 11.21 Gpx4(µmol/g)53.00 ± 6.27*104.02 ± 12.79*#151.41 ± 10.93 147.90 ± 12.42
2.3 各组细胞Fe2+含量及TLR4、Gpx4蛋白相对表达量比较 与Metrnβ组、对照组比较,LPS组及Metrnβ+LPS组细胞Fe2+含量升高、Gpx4蛋白相对表达量均降低,且LPS组变化更明显(P均<0.05)。与Metrnβ组、对照组及Metrnβ+LPS组比较,LPS组TLR4蛋白相对表达量升高(P均<0.05)。见表2及图1。

图1 各组细胞TLR4、Gpx4蛋白表达条带图(Western blotting法)
表2 各组细胞Fe2+含量及TLR4、Gpx4蛋白表达比较()
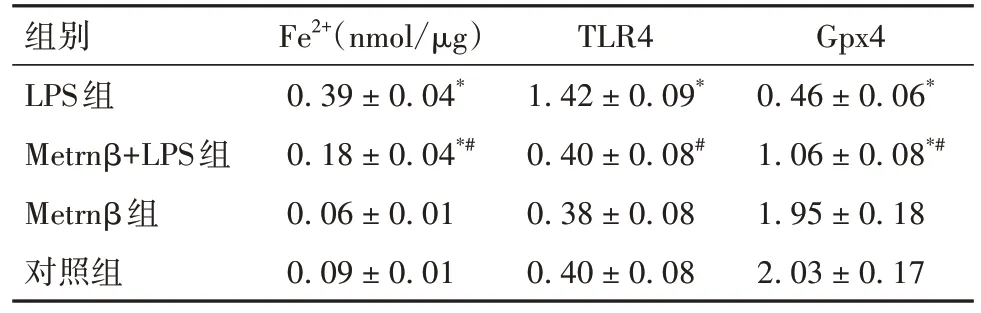
表2 各组细胞Fe2+含量及TLR4、Gpx4蛋白表达比较()
注:与Metrnβ组及对照组比较,*P<0.05;与LPS组比较,#P<0.05。
组别LPS组Metrnβ+LPS组Metrnβ组对照组Fe2+(nmol/µg)0.39 ± 0.04*0.18 ± 0.04*#0.06 ± 0.01 0.09 ± 0.01 TLR4 1.42 ± 0.09*0.40 ± 0.08#0.38 ± 0.08 0.40 ± 0.08 Gpx4 0.46 ± 0.06*1.06 ± 0.08*#1.95 ± 0.18 2.03 ± 0.17
3 讨论
脓毒血症与全身炎症反应可引起多器官损伤,其中心功能不全是常见表现[9]。LPS是细菌的主要致病成分之一,也是脓毒血症的强激活剂,可用于在动物模型中诱导脓毒血症[10]。本研究结果显示,与Metrnβ组、对照组比较,LPS组细胞LDH升高、细胞增殖率降低,提示成功使用LPS诱导心肌细胞损伤。Metrnβ是一种新的脂肪因子,在调控脂肪代谢、炎症、免疫性疾病中发挥重要作用[10]。近期研究表明,血清Metrnβ水平与冠心病、糖尿病等疾病的发生密切相关[14-15]。本研究结果显示,Metrnβ+LPS组细胞增殖率高于LPS组,细胞LDH低于LPS组,提示Metrnβ能够减轻LPS诱导的心肌细胞损伤,提高心肌细胞活性并减少LDH释放。
铁死亡被确定为脓毒血症引起心脏损伤的主要致病机制之一[11]。铁死亡区别于以往发现的死亡方式,表现为细胞膜完整、细胞内无气泡、细胞核大小正常,无染色质凝聚,伴有特征性的线粒体缩小及膜密度增加[1]。多种因素导致的铁代谢异常引起Fe2+含量增高,可诱导细胞发生铁死亡[6]。QIU等[12]揭示了铁死亡在心脏缺血再灌注(I/R)中的作用,并证实抑制铁死亡可以减少I/R引起的心脏损伤。随后研究发现,在心脏移植后再灌注引发的无菌性炎症中,铁死亡促进了中性粒细胞的募集,加剧了心脏炎症反应[13]。Gpx4是调控铁死亡的重要蛋白,Gpx4缺失可导致小鼠脂质过氧化加重,心肌细胞铁死亡增加。本研究结果显示,与Metrnβ组、对照组比较,LPS组及Metrnβ+LPS组细胞Fe2+含量升高、Gpx4表达降低,且LPS组改变更明显;这提示铁死亡参与了LPS诱导的心肌细胞损伤,而Metrnβ可以减轻LPS诱导的心肌细胞铁死亡,从而减轻心肌细胞损伤。
铁死亡是一个由多种机制调节的复杂过程。磷脂与多不饱和脂肪酰基尾部的过氧化被认为是铁死亡的主要驱动因素[16]。既往研究已经证明,铁死亡的发生需要3个关键事件,即铁积累、GSH耗竭和脂质过氧化[17]。本研究结果显示,LPS组细胞内ROS及细胞脂质过氧化的中间代谢产物MDA表达均高于对照组,抗氧化酶GSH表达低于对照组,提示LPS可促进心肌细胞的氧化反应。EL-ASHMAWY等[14]研究显示,血清中低水平的Metrnβ与胰岛素抵抗、内皮功能损伤和动脉粥样硬化程度有关。此外,REBOLL等[5]研究发现,Metrnβ可以促进人血管内皮细胞血管生成,减少心肌梗死后心力衰竭的发生。本研究结果显示,Metrnβ+LPS组细胞ROS、MDA表达均低于LPS组,GSH表达均高于LPS组,表明Metrnβ可减轻LPS引起的心肌细胞氧化反应。
心肌细胞铁死亡可增加损伤相关分子模式(DAMP)的释放,DAMP可触发先天免疫系统,从而加速细胞的炎症反应。铁死亡后TLR4的激活是细胞炎症反应加重的主要机制之一[18]。铁死亡可促进TLR4激活,并导致NF-κB从细胞质转移到细胞核,并随后表达一系列炎症因子,如TNF-α、IL-1β和IL-6[18]。研究发现,TLR4信号通路激活在脓毒血症诱导的心脏损伤中发挥重要作用[19]。本研究结果显示,LPS组细胞TNF-α、IL-1β、IL-6及TLR4均表达高于对照组,提示LPS可促进心肌细胞的氧化反应。HU等[8]研究显示,Metrnβ可以通过cAMP信号通路改善阿奇霉素导致的心肌损伤。REBOLL等[5]研究显示,Metrnβ可以通过激活内皮细胞上的KIT受体酪氨酸激酶,减轻心肌梗死损伤。本研究结果显示,Metrnβ+LPS组细胞促炎症因子TNF-α、IL-1β、IL-6及TLR4表达均低于LPS组;这提示Metrnβ可通过抑制心肌细胞铁死亡及铁死亡诱导的TLR4表达升高,从而抑制心肌细胞炎症反应,减少各种促炎症因子释放及细胞死亡。
综上所述,Metrnβ可以减轻LPS引起的心肌细胞损伤,其机制可能与减少细胞氧化应激反应、炎症反应及铁死亡有关,而铁死亡又与氧化应激反应、炎症反应密切相关,其具体的相互作用及调控机制仍需进一步探讨。

