光照强度对菌藻共生系统处理海产养殖废水的性能影响及微生物群落变化
李盈盈,周 璐,荣宏伟,鲁锰业,王竞茵,崔佰慧,郭大滨
(广州大学土木工程学院,广东广州 510006)
随着全世界人口的增长和经济的提升,人们对营养需求日益增加,海产品逐渐成为主要的蛋白质来源,海产养殖业迅速扩张。自2002年以来,我国一直是世界上最大的水产品贸易国,水产品出口量一直位居世界第一[1]。根据《2021中国渔业统计年鉴》[2],2016年—2020年,我国海水养殖产量逐年增长,2020年我国海洋产品总产量达到5 224万t,其中海水养殖产量为2 135万t,约占海洋总产量的40.87%。
然而,在海产养殖过程中,大量的动物排泄物和未被使用的饲料会导致水体中的污染物含量剧增,如N、P和COD[3]。未经处理的废水直接排入水环境中可能会导致水体富营养化,对环境造成潜在风险。同时,为了预防和治疗鱼虾类疾病,水产养殖饲料中常常含有抗生素。70%~80%的抗生素未能被使用,残留的抗生素对水环境造成了严重的威胁[4]。其中,磺胺类是水产养殖废水中检出率较高的抗生素之一[5]。2019年,我国政府对水产养殖业提出“绿色健康发展”的相关意见,要求养殖废水中的污染物应在排放前被有效去除,实现养殖废水的循环利用。
近年来,基于微藻细菌共生系统去除污染物的技术逐渐兴起。微藻通过光合作用产生O2,供给细菌代谢繁殖。活性污泥中的细菌通过呼吸释放CO2,为微藻提供CO2进行光合作用[6]。通过这种共生机制,菌藻共生比传统活性污泥对氨氮和P的去除率更高[7]。值得注意的是,藻类的生长代谢与光照直接相关。Matos等[8]和Yan等[9]的研究表明,光照强度对微藻去除废水中的污染物有显著影响。当光照强度过高时,水中的微藻和细菌都会受到光抑制作用,导致出水水质变差[10]。Marcilhac等[11]的研究表明,在244 μmol/(m2·s)的光量子通量密度下,菌藻共生系统对N的去除率最大,可达8.5 mg N/(L·d),并发现氨氧化细菌受到微藻生长的影响。Meng等[12]发现光量子通量密度≥90 μmol/(m2·s)时,更利于氨氧化细菌和藻类的富集,对N和P的去除更加高效。Gao等[13]在光照强度为5 000 lux时获得了最佳养分去除效率,去除了98.1%的CODCr、70.7%的氨氮和90.0%的TP。由此可见,要达到菌藻共生系统的高效处理效率,光照强度是重要的因素。但目前缺少光照强度对微藻细菌共生系统处理海产养殖废水的相关研究,也没有对抗生素去除研究的报道。
本研究的目的是,采用悬浮态菌藻共生系统,通过改变光照强度,选取磺胺甲恶唑(SMX)为主要抗生素,探究光照强度对海产养殖废水中营养物质及抗生素的处理效果。同时,对微藻细菌活性、胞外聚合物(EPS)分泌量和微生物群落进行比较,得到最佳光照强度,为工程的实际应用奠定理论依据。
1 试验材料和方法
1.1 小球藻扩培
海水小球藻(GY-H4chlorellasp.)购自上海光语生物科技有限公司,采用BG11培养基培养。在500 mL锥形瓶中,按照藻液∶培养基=1∶5的体积比接种,放置于温度为25 ℃、光照强度为2 500 lux、明暗比为12 h∶12 h的光照培养箱中进行扩培。通过波长为680 nm的紫外分光光度法每天检测藻细胞的生长,得到OD680与海水小球藻干重的相关函数,如式(1)。
Y=0.341 63x-0.005 63,R2=0.998 54
(1)
其中:Y——海水小球藻干重,g/L;
x——检测得到的OD680。
1.2 活性污泥耐盐性驯化
好氧活性污泥取自广州南村污水处理厂。增加海水晶将废水盐度从0调节至3%,经过60 d驯化培养,获得耐盐活性污泥,将活性污泥作为接种菌种。
1.3 试验设计
本试验以体积为500 mL的锥形瓶作为序批式活性污泥法(SBR)反应器。环境温度为25 ℃,明暗比为12 h∶12 h,藻菌比为1∶3(120 mg/L∶360 mg/L),设置光照强度为2 000、4 500、7 000、9 500 lux,分别记为AS2000、AS4500、AS7000、AS9500。为保证菌藻充分接触,采用磁力搅拌器以200 r/min搅拌。24 h为1个周期,22 h搅拌,100 min沉淀,10 min出水,10 min进水。由于藻类沉降性较差,避免藻类过多流失,试验第1 d不排水,以母液形式加入污染物,后续每天体积交换率为25%。

1.4 水质分析方法
水样通过0.22 μm聚醚砜滤膜,测定进出水SMX含量。采用高效液相色谱法(1100,安捷伦,美国)测定SMX的含量。测定所用色谱柱为Agilent ZORBAX SB-C18(4.6 mm×250 mm,3.5 μm),柱温控制在30 ℃。流动相为甲醇-甲酸水(0.1%),体积比为49∶51,流速为0.2 mL/min,检测波长设为270 nm。根据试验开始时和试验结束时的SMX浓度计算SMX的去除率。
1.5 海水小球藻活性和微生物活性的表征
本试验通过叶绿素a衡量小球藻生长情况,使用95%乙醇测定叶绿素a含量,每2 d进行一次检测。取试验末期的菌藻混合物测定微藻和细菌活性。采用黑白瓶法测定菌藻混合液的光合产氧速率(SOGR)来表征海水小球藻活性[15]。各反应器的微生物活性以比氧吸收率(SOUR)、比氨氧化速率(SAUR)和比硝化速率(SNUR)表示[16]。
1.6 EPS提取
EPS主要包括松散结合的EPS(LB-EPS)和紧密结合的EPS(TB-EPS)[17]。取试验末期的菌藻混合物,采用热提取法提取LB-EPS和TB-EPS[18]。分析LB-EPS和TB-EPS中的总有机碳(TOC)、蛋白质(PN)和多糖(PS)含量。TOC通过TOC分析仪(TOC-LcpH/CPN,Shimadzu)测量,PN按照Lowry方法测量[19],用苯酚-硫酸法测定PS含量[20]。
1.7 高通量测序
取试验结束后接种污泥的试验组进行高通量测序。微生物多样性测序工作由Majorbio生物制药科技有限公司(中国上海)完成。整个测序基本流程主要包含DNA提取、PCR扩增及产物纯化、PCR产物的定量和均一化、测序文库构建以及双端测序。通用引物对341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGTATCTAATCC-3′)用于扩增靶向V3~V4区域的细菌16S rRNA区域[21]。然后将PCR产物在Illumina MiSeq平台上进行测序。生物信息学分析在Majorbio I-Sanger(https://cloud.majorbio.com/)上进行。
2 结果和讨论
2.1 小球藻生长情况
光合作用是光照损伤和自我恢复的动态平衡,而叶绿素是进行光合作用的主要光合色素。图1为不同光强下的叶绿素a含量。随着试验的推进,各试验组中的叶绿素a质量浓度分别从开始的1.67 mg/L左右上升至结束时的3.36、4.39、4.54、4.60 mg/L。在试验前期,小球藻处于快速生长阶段,并且在第4 d的生长速率达到最大,随后逐渐趋于平缓。但是当光照强度为7 000 lux和9 500 lux时,至试验末期,叶绿素a含量开始出现负增长。可能主要有以下两个原因:1)中高光强下,微藻生长不受限制,藻密度不断上升,最终造成自遮蔽现象,过量的小球藻无法捕获到足够的光能,光合效率下降,同时水中分泌的过量藻毒素对小球藻造成毒害作用;2)长期处于过高的光照强度下,小球藻吸收过量的光能会破坏光合色素,抑制光合作用而发生光抑制现象,同时高强度的光照会引起藻细胞膜的损伤,导致藻细胞的死亡[22]。当光照强度为2 000 lux时,由于活性污泥的遮蔽,藻细胞吸收的光能较弱,光合作用效率低下,小球藻生长受限,叶绿素a含量低下。
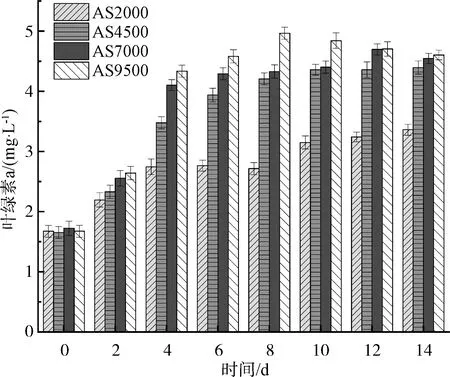
图1 不同光照强度下叶绿素a含量
2.2 CODCr的去除
图2为不同光强下CODCr的去除效率。经过14 d的共生培养,所有反应器的出水CODCr质量浓度均低于6 mg/L,平均去除率可以达到94%以上,光照强度为4 500 lux时,CODCr去除率最高,为96.87%。这说明不同光强下小球藻均能通过光合作用为菌藻共生系统提供DO,保障微生物的生长,并能较好地去除有机物。对不同光照强度下CODCr的去除率进行以光照强度为单因素的显著性分析,P值为0.059(>0.05),差异不显著。因此,在本试验的试验周期内,光照强度对菌藻共生系统去除CODCr没有显著影响。

图2 不同光照强度下CODCr去除率
2.3 氮素的去除
不同光照强度下,菌藻共生系统脱氮效率如图3(a)所示。当光照强度为4 500 lux时,TN去除效果最佳,为95.70%,其次分别为84.59%(2 000 lux)、76.05%(7 000 lux)和57.75%(9 500 lux)。
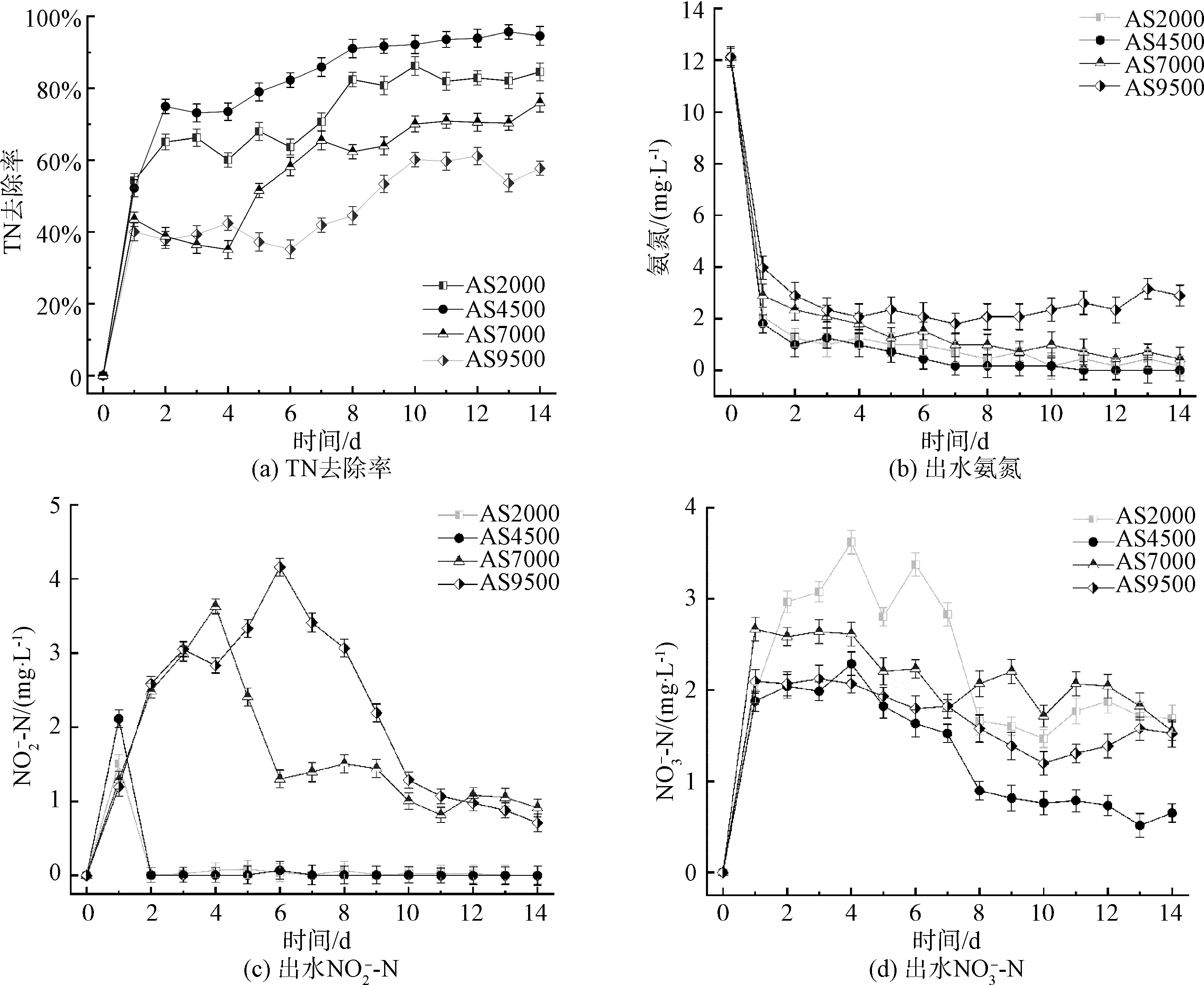
图3 不同光照强度下TN去除效率和氨氮出水含量
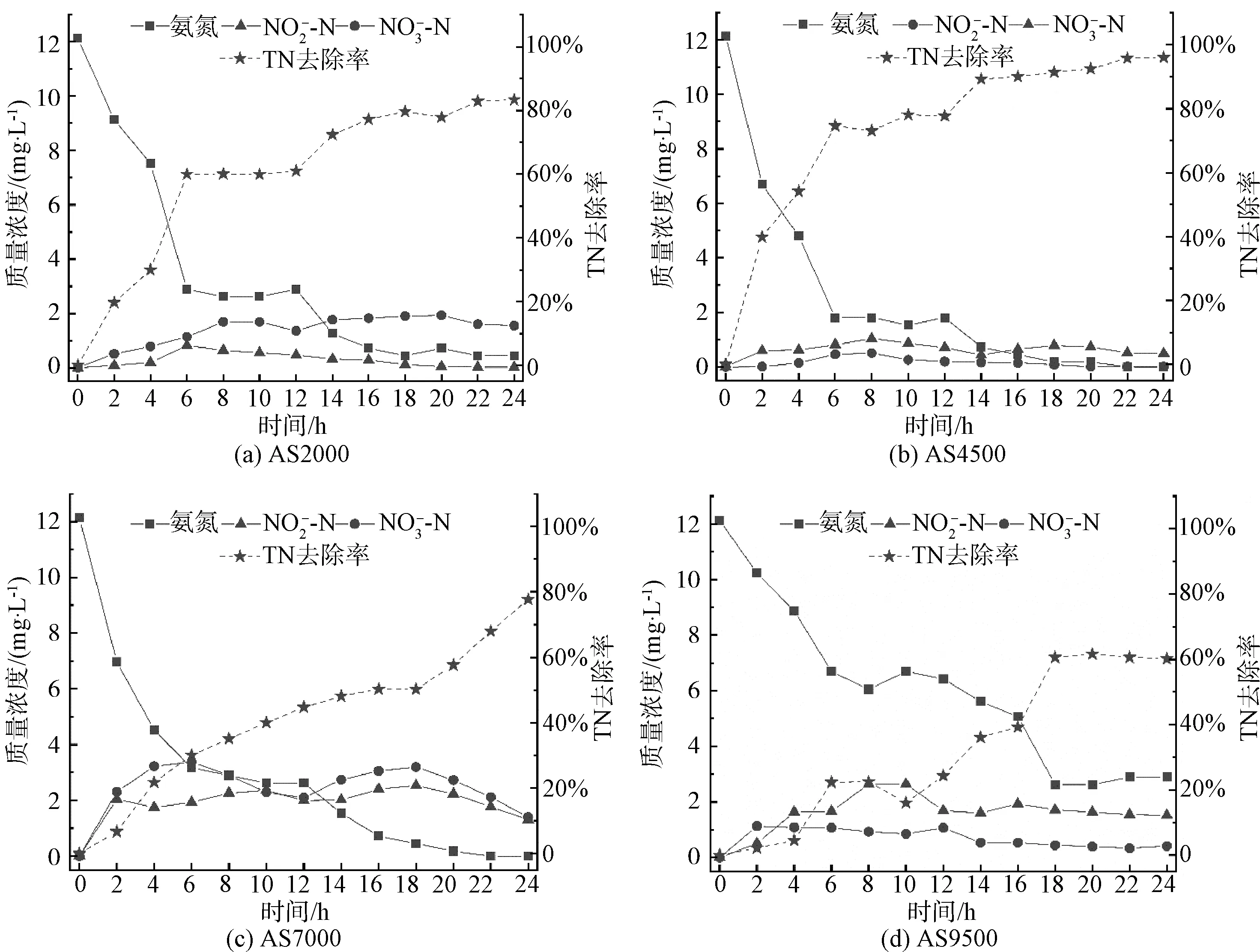
图4 一个试验周期内不同光照强度下出水氨氮含量和TN去除率
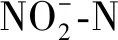
2.4 磷酸盐去除

图5 不同光照强度下去除率 Removal Rate under Different Light Intensities
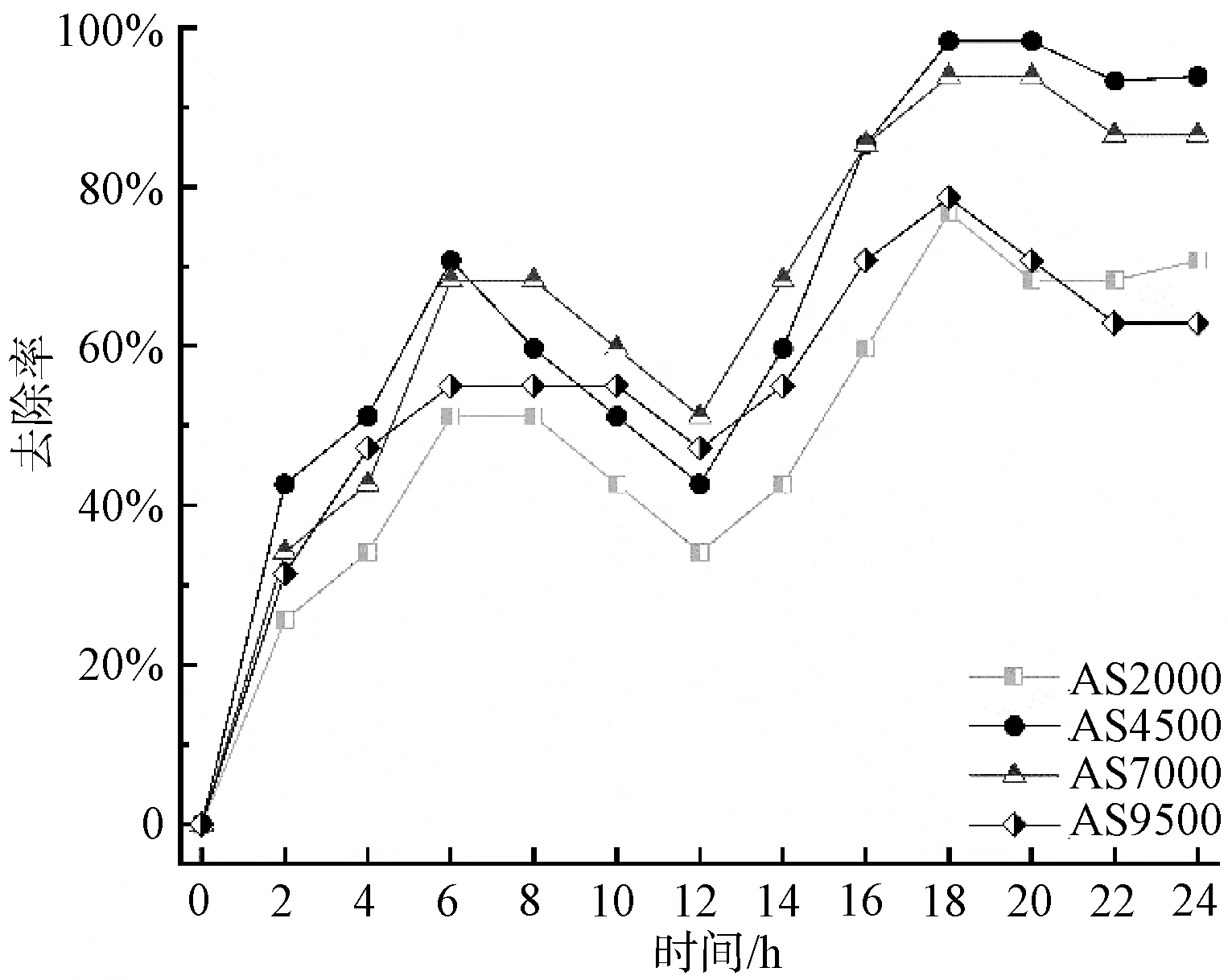
图6 一个试验周期内不同光照强度下去除率 Removal Rate under Different Light Intensities in a Experimental Period
2.5 SMX的去除
由图7可知,光照强度为4 500 lux时,SMX的去除率最高,为95.67%,比其余光照强度条件下分别高了7.99%(2 000 lux)、19.24%(7 000 lux)和61.32%(9 500 lux)。SMX的酸度系数(pKa)为5.6~6.6,在高于pKa的pH下,SMX会以带负电的形式存在,被带负电的微藻细胞排斥[25]。在本试验中,pH值始终维持在7.8以上。同时,SMX的水分配系数(LogKow)值低于1,为 0.89,表现出亲水性的特质,与细胞的吸附结合有限[26]。Rodrigues等[27]的研究也表明,菌藻共生系统对SMX的生物吸附非常低,只有1.26%。此外,Bai等[28]和Xiong等[29]的研究表明,SMX的生物吸收、生物累积和光降解非常低或微不足道。由于基于底物相互利用的协同机制,微藻细菌共生体可以更好地代谢药物化合物[30],对抗生素降解比其他生物处理系统更彻底和有效[31-32]。因此,本试验中,大部分SMX由细菌和微藻共同生物降解完成。在试验周期前4 d,各反应器去除SMX的去除效率迅速上升,之后各反应器的去除效率逐步降低,直到第8 d才逐步趋于稳定。在低光照强度至中高光照强度(2 000 ~7 000 lux)下,SMX的去除效率均比高光照强度条件下要高。由此可见,过高的光照强度不利于细菌和微藻协同作用去除SMX。当光照为9 500 lux时,光能充足,试验初期小球藻生长不受限,但是细菌受到的光照抑制作用是所有试验组中最高的,故SMX去除效率较低,到第4 d为50.8%。随后,对SMX的去除效率开始下降。这可能是因为,在第4 d,叶绿素a的增长速率达到最大,开始大量繁殖,在第8 d达到最高,为4.90 mg/L。小球藻的无限制生长,打破了和细菌之间的共生关系,变为竞争关系,共同生物降解SMX的模式也被打破。由于光照对细菌的抑制作用,微藻成为SMX的主要处理者,去除率始终维持在34.0%左右。在Yu等[33]的研究中,采用海水小球藻处理人工海产养殖废水中的SMX,去除率达到41%~50%。类似地,Chen等[26]采用小球藻处理磺胺类抗生素,去除率可达33%左右。因此,小球藻对磺胺类抗生素的去除率在33%~50%,与本试验高光照强度条件下的结果相似。
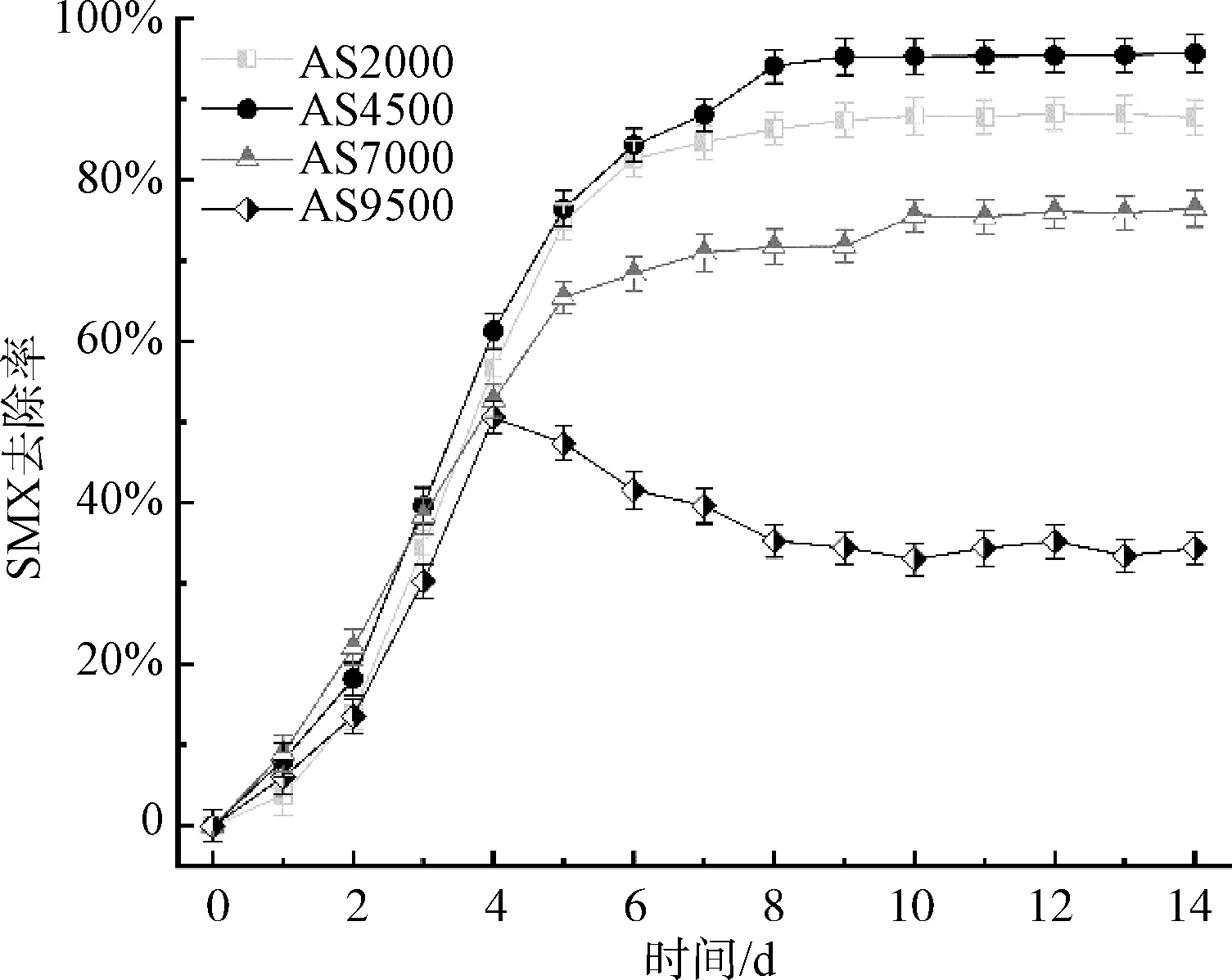
图7 不同光照强度下SMX去除率
图8为一个试验周期内不同光照强度下SMX的去除率。可以明显观察到,在光照阶段,即0~6 h和12~18 h,SMX去除效率迅速上升,0~6 h时最高可达70%左右;而黑暗阶段,即12~18 h和18~24 h,SMX的去除效率趋于平缓,总体增加只有10%左右。与本试验结果相同的还有在Hu等[34]的试验中,当SMX质量浓度为1 mg/L时,菌藻共生系统在光照条件下对SMX的去除率可达50%~80%,而在黑暗条件下只有15%~20%。这可能是因为,低浓度的SMX对共生系统中的小球藻几乎没有影响,并且EPS的过量产生降低了菌藻共生系统对SMX的敏感性[29]。

图8 一个试验周期内不同光照强度下SMX去除效率
2.6 微生物活性
如图9(a)所示,对不同光强下菌藻共生系统的小球藻活性进行了比较,2 000、4 500、7 000、9 500 lux时分别为23.55、30.93、21.09、16.06 μmol O2/(mg Chl-a·h)。小球藻活性随光照强度的增加,呈现先上升后下降的趋势。光照强度是影响微藻生长的主要环境因素,过低会限制光合速率,过高会对微藻产生光抑制作用[23]。本试验中,由于活性污泥对光照的遮蔽作用,在2 000 lux光照强度下微藻生长更加受到限制,活性降低。当光照强度为7 000 lux和9 500 lux时,试验初期光能充足,小球藻生长繁殖不受限制,叶绿素a含量迅速上升。到试验末期,自遮蔽现象加剧,光反应受到限制,无法提供足够的ATP和NADPH进行CO2的吸收利用,暗反应的效率被削弱,小球藻活性降低,叶绿素a含量也下降。

图9 微藻活性和细菌活性比较
如图9(b)所示,对不同光强下菌藻共生系统中细菌活性进行比较,包括细菌总活性SOUR、亚硝酸盐细菌活性SAUR和硝酸盐细菌活性SNUR。同微藻活性SOGR一样,随着光照强度的提升,呈现先上升后下降的趋势,2 000、4 500、7 000、9 500 lux时依次为38.92、44.57、16.26、10.01 mg O2/(g VSS·h)。同时,可以发现细菌活性与系统脱氮效率呈现正相关的趋势。光照强度越高,细菌总活性越低,光照对硝化细菌的抑制作用越高,这主要是因为参与硝化作用能量传导途径的AOB和NOB细胞色素均被强光破坏[35],从而无法进行高效的脱氮作用。然而,在低光强下,小球藻生长受到抑制,小球藻无法摄取到足够的O2,活性降低。
2.7 EPS分析
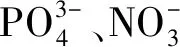
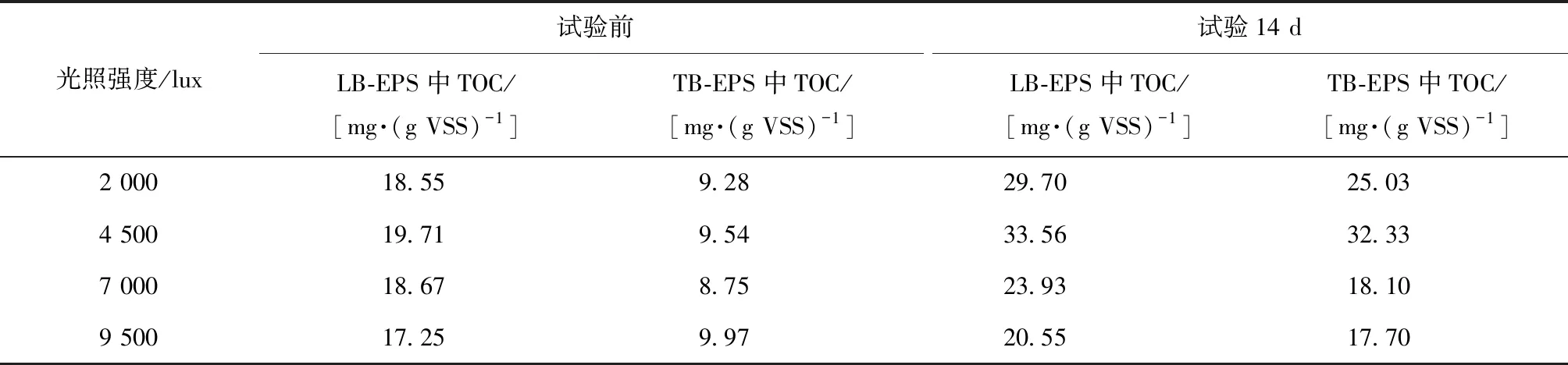
表1 不同光照强度菌藻共生系统试验前后的EPS中TOC含量
试验结束后EPS中PS和PN的含量及PN/PS如图10所示。光照强度为4 500 lux时,PS和PN含量最高,PS分别为20.07 mg/(g VSS)(LB-EPS)和26.83 mg/(g VSS)(TB-EPS),PN分别为48.76 mg/(g VSS)(LB-EPS)和59.65 mg/(g VSS)(TB-EPS)。在4个光照强度下,无论是LB-EPS,还是TB-EPS,PN含量均占主体。EPS中的PN越高,说明菌藻胶团内部的联结越紧密。同时,PN也具有稳定污泥絮体结构的作用,因此,更高的PN含量更利于活性污泥架构更加稳定的菌藻胶团,使得菌藻胶团实现更加高效的同步硝化反硝化过程。并且,由于PN对于SMX的转运作用[43],SMX可以在菌藻胶团内部逐渐降解,提高对SMX的去除率。

图10 不同光照强度下试验结束后EPS中PS和PN含量
2.8 微生物群落分析
2.8.1 α-多样性分析
α-多样性是指一个特定区域或者生态系统内的多样性,常用的度量标准有Chao 1、ACE、Shannon、Simpson、Coverage指数。Chao 1指数和ACE指数用于表征物种的丰富指数,Shannon指数和Simpson指数用于表征物种的多样性,Coverage指数主要指测序对物种的覆盖度。一般来说,Chao 1指数和ACE指数值越大,说明群落的丰富度越高;Shannon指数值越高,说明群落的多样性越高;而Simpson指数值越大,表明群落的Alpha多样性越差。
由表2可知,光照强度对菌藻共生系统中的微生物丰富度和多样性有影响。光照强度为4 500 lux试验组中的微生物群落结构最丰富,其次是2 000 lux和7 000 lux,最小的为9 500 lux,这说明过高的光照强度和过低的光照强度对于提高系统的微生物丰富度存在副作用。与之不同的是,光照强度的提高与微生物的多样性呈现负相关,光照强度越高,Shannon指数越低且Simpson指数越高,这可能是小球藻对高光照强度的趋向性并占据主体地位,同时不耐高光照强度的细菌丰度逐渐减少,系统中只有部分耐光细菌成为优势菌属,物种多样性下降。
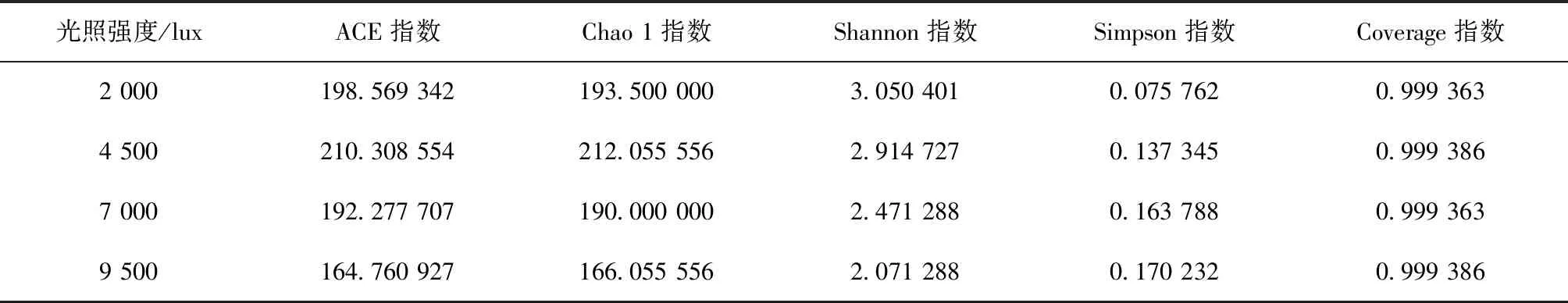
表2 不同光强菌藻共生系统微生物α-多样性指数
2.8.2 主成分分析(principal component analysis,PCA)
PCA用于分析样本间的差异和距离,样品组成越相似,反映在PCA图中的距离越近。不同光照下菌藻共生系统的PCA如图11所示。主成分(PC1)和主成分 2(PC2)是两个最主要的样品差异特征,最大比率分别为49.86%和28.12%。其中AS2000和AS4500的样品倾向聚集在一起,而AS7000和AS9500与之相较甚远,这说明光照强度会对微生物群落组成造成差异,在低光强下的差异较小,高光强下差异较大,这可能是某些细菌的不耐光性引起的。

图11 不同光照强度菌藻共生系统PCA
2.8.3 微生物群落结构组成
图12(a)为不同光强的菌藻共生优势细菌门水平的相对分布。各试验组中的优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门 (Planctomycetes)、蓝细菌门(Cyanobacteria)和脱硫杆菌门(Desulfobacterota)。其中变形菌门的丰度最高,2 000、4 500、7 000、9 500 lux时分别为84.32%、88.46%、75.38%、71.97%。Mével等[44]的研究表明,Proteobacteria 具有降解有机物和硝化-反硝化的功能。因此,本试验中,脱氮效果与Proteobacteria的丰度呈现正相关,并且在Proteobacteria丰度较高的光照强度为4 500 lux的共生系统中,脱氮效果最好。随着光照强度的增加,Bacteroidetes的丰度逐渐升高。这是由于藻类的生长会抑制Bacteroidetes的生长[45],但是到试验后期,高光照强度对藻细胞造成损伤,小球藻逐渐走向衰亡,Bacteroidetes生长不受限制,丰度增加。相似的是,Planctomycetes在高光照强度下的丰度也明显高于中低光强,许多研究[46-51]报道了藻华后Planctomy-cetes的高丰度。同时,长时间的高强度光照会使得共生系统中的Cyanobacteria丰度增加,蓝藻细菌的过度生长可能形成有害的藻华,并导致海产养殖系统的水质问题[52]。由此可见,光照强度会改变菌藻共生系统中的微生物群落结构,高强度的光照会降低硝化反硝化菌属的丰度水平,增加不利于系统长久稳定运行菌属的丰度。

图12 不同光照强度下的菌藻共生系统优势细菌相对分布
图12(b)为不同光照强度的菌藻共生优势细菌属水平的相对分布。其中,占比最高的为Unclassified_f_Rhodobacteraceae、Aestuariicoccus和Ruegeria,均属于α-变形菌纲的海洋红杆菌科。据报道,海洋红杆菌科是海洋微生物群的重要成员,占海洋原核生物DNA的40%[53],通过间接接触促进其他细菌物种的初始定殖和生物膜形成,是优秀的生物膜形成生物[54]。同时,海洋红杆菌科是B12营养缺陷原核生物和真核生物初级生产者的主要维生素供应商,如绿藻、硅藻、甲藻、球藻和褐藻,而维生素B12是许多真核藻类所必需的生长因子[55]。当光照强度为4 500 lux时,以上3种菌的丰度之和最高,这可能会增加小球藻的活性,并且促进菌藻共生系统中EPS的分泌,使得细菌和微藻之间的信号交换更加便利,提高系统的处理效能。随着光照强度的提高,Unclassified_f_Rhodobacteraceae和Aestuarii-coccus丰度之和逐步下降(2 000~9 500 lux时分别为62.03%、63.02%、41.70%和2.54%),而Ruegeria和Stappia丰度之和大幅提升(2 000~9 500 lux时分别为2.74%、3.84%、16.47%和53.88%)。这说明光照强度会改变微生物属水平的群落结构,提高光照强度,耐光的细菌会逐渐替代对光照不耐受的细菌。据报道[56],Ruegeria和Stappia的序列与光合细菌的序列非常相似,并且有助于在广泛的海洋环境中参与C和N循环的好氧和厌氧过程。同时,Muricauda、Marivita和Halomonas的丰度与光照强度也呈正相关的关系,研究[57-58]发现,Muricauda、Marivita和Halomonas属于需氧和化学异养菌,可以有效抑制微藻赤潮的发生。除此之外,光照强度对系统中的反硝化细菌也有明显的抑制作用,光照强度为9 500 lux时,Marinicella的丰度只有0.44%,2 000、4 500、7 000 lux时依次为7.54%、6.92%和6.61%。值得注意的是,Norank_f_Microscillaceae是SMX的降解菌,有利于降解高浓度SMX[59]。当光照强度为4 500 lux的系统中,Norank_f_Microscilla-ceae的丰度最高,为8.7%,而在9 500 lux的系统中,只有0.18%。由此可见,光照强度对微生物群落结构有较大影响,过高的光照强度会降低处理海产养殖废水的效能。
2.9 机理分析
3 结论
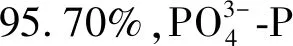
(2)光照强度过低会限制微藻进行光合作用,抑制微藻生长。光照强度过高会抑制细菌活性,无法为微藻提供足够的CO2进行暗反应,微藻活性受到影响。
(3)细菌和微藻活性越高,EPS分泌量越多,SMX对二者的急性伤害越小。PN的大量分泌可以促进SMX的转运,提高SMX的去除率。
(4)光照强度对菌藻共生系统的微生物群落结构有显著影响。过高的光照强度会降低物种的多样性和丰富度,使得系统中的细菌逐渐转变为耐光细菌。光照强度与Muricauda、Marivita和Halomonas等抑制藻华的菌属丰度呈正相关,与反硝化细菌Marinicella的丰度呈负相关。合适的光照强度有助于提高SMX降解菌Norank_f_Microscillaceae的丰度。

