弓形虫ROP5与ROP18的双基因缺失株构建及表型鉴定
陈 芸,刘 旗,张曼玉,耿小玲,蒋 蔚,王 权
(中国农业科学院上海兽医研究所,上海 200241)
刚地弓形虫(Toxoplasmagondii,T.gondii)为一种专性胞内寄生的顶复门原虫,可感染几乎所有温血动物的有核细胞[1]。全世界大约三分之一的人口感染了弓形虫[2]。流行病学调查显示,我国的弓形虫感染率为7.9%,低于世界平均水平,但呈现逐年上升的趋势[3]。弓形虫主要有三种感染途径:经口感染,经血液感染及先天性感染[4]。当机体感染弓形虫后,通常表现为隐性感染,但免疫力低下者(如艾滋病患者、恶性肿瘤患者、服用免疫抑制药物的患者等)感染弓形虫后会导致全身急性感染,严重时可导致死亡。此外,孕期感染弓形虫可导致流产、畸胎以及新生儿先天性弓形虫病等[5]。在畜牧业生产上,弓形虫可感染多种家畜,影响其生长发育与繁殖,并导致肉/奶产品质量下降,直接或间接带来巨大的经济损失,且食用被感染动物的肉制品或奶制品,也可将弓形虫传播给人类,严重威胁人类健康[6]。
弓形虫危害严重与其具有逃逸宿主的天然免疫的功能相关[7]。棒状体蛋白(rhoptries,ROPs)在入侵宿主过程中由弓形虫棒状体分泌,经虫体顶端释放至纳虫泡(parasitophorous vacuole,PV)或者宿主细胞胞质中,主要参与调节虫体入侵,增殖及PV形成等[8]。ROP18是一种高度多态性的棒状蛋白激酶,具有丝氨酸-苏氨酸蛋白激酶结构[9],能特异性结合宿主细胞内的免疫相关GTP酶(immunityrelated GTPases,IRGs),主要磷酸化IRGs中的Irga6的第102位、108位苏氨酸,防止Irga6在纳虫泡膜上积累并破坏纳虫泡的完整性[10]。此外,ROP18还可以靶向激活转录因子(activating transcription factor 6 beta,ATF6-β),导致其降解,从而干扰ATF6-β相关的免疫反应[11],还可抑制宿主的NF-κB信号通路[12]。近年来还发现弓形虫ROP18可通过线粒体凋亡途径抑制宿主细胞凋亡,维持线粒体膜电位和完整性,阻止细胞色素C从线粒体释放到细胞质中[13-14]。ROP5是由一组串联的、重复的高度多态性基因组成的假激酶[15],与ROP18协同作用可增加ROP18的磷酸化活性[16]。此外,ROP5也可直接与纳虫泡膜(parasitophorous vacuole membrane,PVM)上的IRGs结合,当弓形虫缺乏ROP18基因时,ROP5在逃逸宿主免疫方面发挥重要作用[17]。此外,Zheng等[18]发现ROP5的重组蛋白疫苗可以诱导细胞和体液(Th1/Th2)免疫应答,延长感染RH株小鼠的存活时间。Yuan等[19]研究发现ROP18核酸疫苗可增强昆明鼠对弓形虫特异性Th1型应答,并显著延长小鼠的存活时间。
上述表明ROP5、ROP18均为弓形虫重要的毒力因子,具有调节宿主天然免疫反应的功能,可能还具有其他尚待发现的功能。本研究利用CRISPR/Cas9基因敲除技术构建弓形虫RH株ROP5的单基因缺失株,并在此基础上构建ROP5与ROP18的双基因缺失株,为进一步研究ROP5与ROP18的作用机制及基因缺失弱毒株疫苗奠定基础。
1 材料与方法
1.1 细胞、虫株、质粒与小鼠 Vero细胞由本实验室液氮保存,复苏后培养于含10%胎牛血清的完全培养基;弓形虫RH株由本实验保存;弓形虫ROP18缺失株(ROP18-KO)由本实验前期试验构建并保存于液氮中;质粒pSAG1:CAS9::TgU6:sgUPRT与质粒pDHFR:UPRT-D为本实验室保存;pCas9-CAT质粒(Addgene,cat.no.80323)购自addgene;大肠杆菌TOP10感受态细胞购自天根生化科技(北京)有限公司;清洁级雌性昆明鼠购自上海杰思捷实验动物有限公司。
1.2 主要试剂 DMEM培养基、PBS、胰酶均购自Gibco公司;胎牛血清购自BI公司;基因组DNA提取试剂盒购自北京赛百盛基因技术有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;Phanta Max Super-Fidelity与ClonExpress MultiS One step Cloning Kit购自南京诺唯赞生物科技有限公司;结晶紫染色液购自碧云天生物技术公司;CFDA SE细胞增殖与示踪检测试剂盒购自碧云天生物技术公司。
1.3 CRISPR/Cas9基因敲除质粒和同源重组质粒的构建及鉴定 根据NCBI在线数据库获取弓形虫RH株ROP5基因全长序列(GenBank:HQ916455.1),利用CRISPR/Cas9基因敲除系统在线网站(http://crispr.mit.edu)设计ROP5的sgRNA引物,选取得分较高的sgRNA序列,并将sgRNA引物送金唯智公司合成。以pSAG1:CAS9::TgU6:sgUPRT质粒为模板,将pSAG1:CAS9::TgU6:sgUPRT质粒以3个片段的形式扩增(引物见表1),并将质粒中的sgRNA序列替换为ROP5的sgRNA序列。对PCR产物进行琼脂糖凝胶电泳及切胶回收纯化,再通过ClonExpress MuLtiS One step Cloning Kit进行连接。将同源重组后的产物转化至TOP10感受态细胞,再涂布于含有氨苄青霉素(Ampicillin,AMP)的固体培养基上,筛选单克隆菌落,并进行菌液PCR鉴定,扩增产物送至擎科生物科技有限公司测序。以pUPRT::DHFR-D质粒为模板,扩增pROP5::DHFR-D质粒骨架部分及DHFR抗性基因部分,以RH株DNA为模板扩增ROP5的5'UTR及3'UTR片段,并通过ClonExpress MuLtiS One step Cloning Kit进行连接,构建pROP5::DHFR-D质粒(引物见表2),转化至TOP10感受态细胞,挑取单菌落进行菌液PCR鉴定,分别扩增5'UTR与DHFR片段连接处,3'UTR与DHFR片段连接处、验证质粒是否构建成功,引物见表3。以相同方法构建pROP18::CAT-D质粒,其中以pCas9/CAT质粒为模板,扩增氯霉素抗性基因(CAT)。
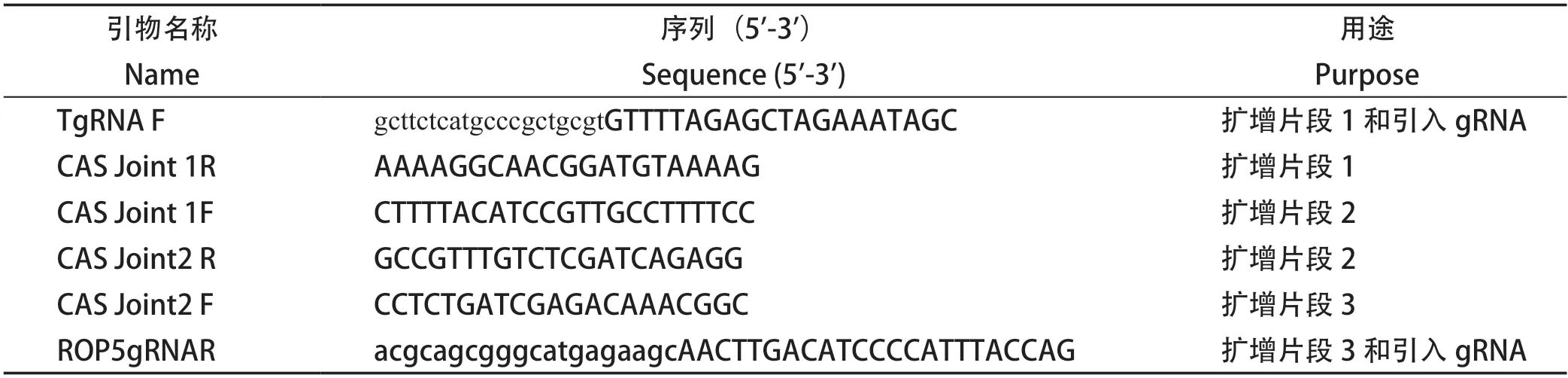
表1 构建pSAG1:CAS9::TgU6:sgROP5的引物Table 1 The primers for construction of pSAG1:CAS9::TgU6:sgROP5

表2 构建pROP5::DHFR-D的引物Table 2 The primers for construction of pROP5::DHFR-D
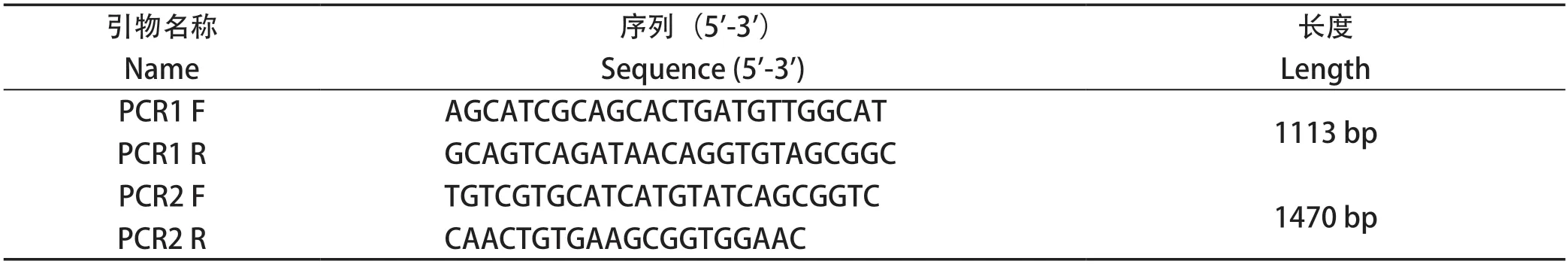
表3 验证pSAG1:CAS9::TgU6:sgROP5与pROP5::DHFR-D的引物Table 3 The primers for identification of pSAG1:CAS9::TgU6:sgROP5 and pROP5::DHFR-D
1.4ROP5缺失株的构建及验证 收集新鲜逸出的RH株速殖子,经孔径为5 μm的滤器过滤纯化后,用电转液Cytomix洗涤两遍并重悬虫体。将质粒pSAG1:CAS9::TgU6:sgROP5和pROP5::DHFR-D各30 μg(1∶1的比例)加入至1×107个纯化后的弓形虫RH株中,再加入一定量的电转液,使最终体积为300 μL,混匀后加入至2 mm间距的电击杯中,用Gene Pulser Xcell电穿孔系统(Bio-rad伯乐)按照以下参数电转:电压为1500 V,电容为25 μF,电阻为50 Ω。电转后的虫体转移至长满80%Vero细胞的6孔板中继续培养。培养48 h后,将培养基更换为含有3 μmol/L息疟定的培养基,对弓形虫进行药物筛选,并将继续增殖的弓形虫转移至含80%Vero细胞的96孔板中进行单克隆筛选,连续筛选3代后,扩大培养单克隆虫株,并进行PCR验证,引物见表4。
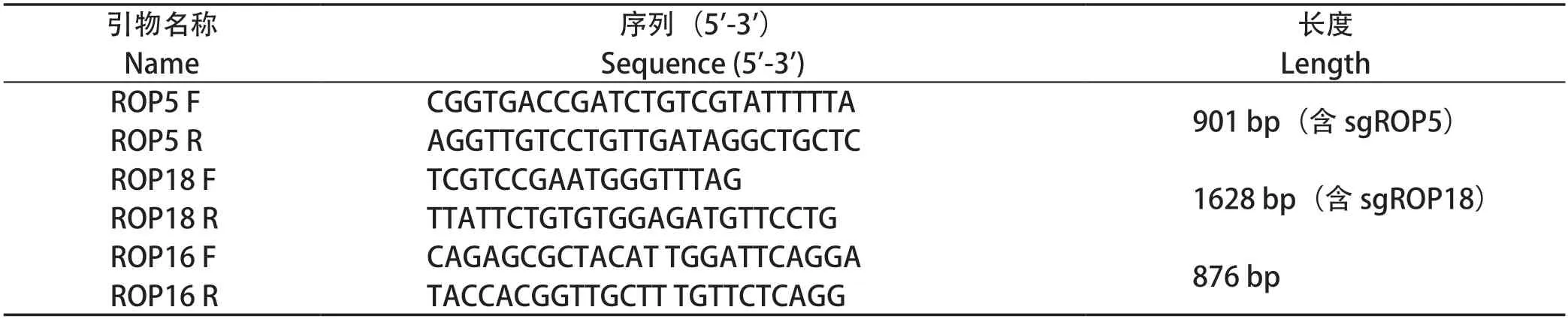
表4 用于鉴定ROP5-KO株和ROP5/ROP18-KO株的引物Table 4 The primers for identification of ROP5-KO strain and ROP5/ROP18-KO strain
1.5ROP5与ROP18双基因缺失株的构建及验证 将pSAG1:CAS9::TgU6:ROP18质粒和pROP18::CAT-D质粒各30 μg(1∶1的比例)加入至1×107个纯化的ROP5-KO弓形虫悬液中,总体积为300 μL,充分混匀后加入至间距为2 mm的电转杯,电转条件与参数同上,电转后继续放置于含Vero细胞的6孔板中培养,并用40 μmol/L的氯霉素进行药物筛选,再在96孔板中进行3次亚克隆。筛选后的单克隆虫株在6孔板中继续扩大培养后,提取基因组DNA,扩增ROP5基因片段及ROP18基因片段,验证双基因缺失株是否构建成功(引物见表4)。
1.6 入侵试验 将RH株、ROP5-KO株、ROP18-KO株、ROP5/ROP18-KO株用CFDA SE标记(具体试验步骤见说明书),标记完成后,将各虫株加入至含90%Vero细胞的6孔板中,每孔接种1×106个CFDA SE标记的弓形虫速殖子,37℃培养2 h后,PBS清洗未入侵Vero细胞的速殖子,继续培养12 h,细胞经胰酶消化后,用含10%FBS的DMEM完全培养基重悬,用Beckman Coulter Cytomics FC 500流式细胞仪检测弓形虫入侵Vero细胞的入侵率。
1.7 弓形虫增殖试验 将每种虫株(各5×105个速殖子)分别接种于含Vero细胞的6孔板中,每个虫株设3个重复孔。37℃培养12 h 后,PBS清洗除去未入侵细胞的虫体,并加入新鲜的含2%FBS的DMEM继续培养24 h,显微镜下计数100个假包囊,并统计每个假包囊中含有的速殖子个数。
1.8 噬斑试验 分别将RH株、ROP5-KO株、ROP18-KO株及ROP5/ROP18-KO株的速殖子(500个)接种于Vero细胞,继续培养7 d后,用PBS洗涤两遍,4%多聚甲醛室温固定30 min,再用结晶紫室温染色20 min,PBS洗去残留的结晶紫后,显微镜下观察各种虫株所形成的空斑大小。
1.9 对小鼠的毒力试验 本试验选取6~8周龄雌性昆明鼠作为试验动物,试验分4组,每组10只昆明鼠,分别接种0.5 mL生理盐水(对照组)、RH株、ROP5-KO株、ROP18-KO株、ROP5/ROP18-KO株各1000个速殖子,记录并统计各组小鼠的死亡时间及死亡只数。
1.10 数据统计 采用SPSS 17.0软件进行单因素方差分析。如果与对照组有差异再对不同试验组进行方法分析,结果用平均值±标准差(±SD)表示。
2 结果
2.1 pSAG1:CAS9::TgU6:sgROP5质粒与pROP5::DHFR-D质粒的构建及验证 利用NCBI在线数据库查询弓形虫ROP5基因序列信息,可知ROP5基因具有三个亚型,分别是ROP5A(GenBank:HQ916451.1),ROP5B(GenBank: HQ916448.1),ROP5C(GenBank: HQ916455.1)。本实验首先以RH株DNA为模板,扩增ROP5基因全长并测序,经BLAST对比得知,所扩增的ROP5基因与ROP5B、ROP5C的相似性均99%。将pSAG1:CAS9::TgU6:sgUPRT经3个片段扩增(图1A),并将UPRT的sgRNA替换成ROP5的sgRNA,环化连接构建pSAG1:CAS9::TgU6:sgROP5质粒,经PCR扩增含sgRNA片段并测序(图1B)。为了构建同源重组质粒,以弓形虫基因组DNA为模板,扩增ROP5的5'UTR、3'UTR,以pUPRT::DHFR-D质粒为模板扩增质粒骨架片段及DHFR抗性基因片段(图1C),连接成功后,对质粒进行PCR鉴定(图1D)。结果显示,用于敲除的两个质粒均构建成功。
图1 pSAG1:CAS9::TgU6:sgROP5质粒与pROP5::DHFR-D质粒的构建及验证Fig.1 Construction and verification of pSAG1:CAS9::TgU6:sgROP5 and pROP5::DHFR-D
2.2ROP5基因敲除株的筛选与鉴定 将pSAG1:CAS9::TgU6:sgROP5质粒和pROP5::DHFR-D质粒同时转染至弓形虫RH株速殖子中并经息疟定筛选,获得单克隆虫株。提取弓形虫DNA进行PCR鉴定,同时以RH株为对照。PCR产物经琼脂糖凝胶电泳的结果表明,以RH株DNA为模板扩增出ROP5基因的901 bp,且条带单一,但ROP5缺失株中无条带。此外,ROP5-KO株扩增出5'UTR与DHFR片段连接处1113 bp片段,3'UTR与DHFR片段连接处1470 bp片段,说明DHFR基因已重组至ROP5靶基因处,说明ROP5-KO株构建成功(图2)。
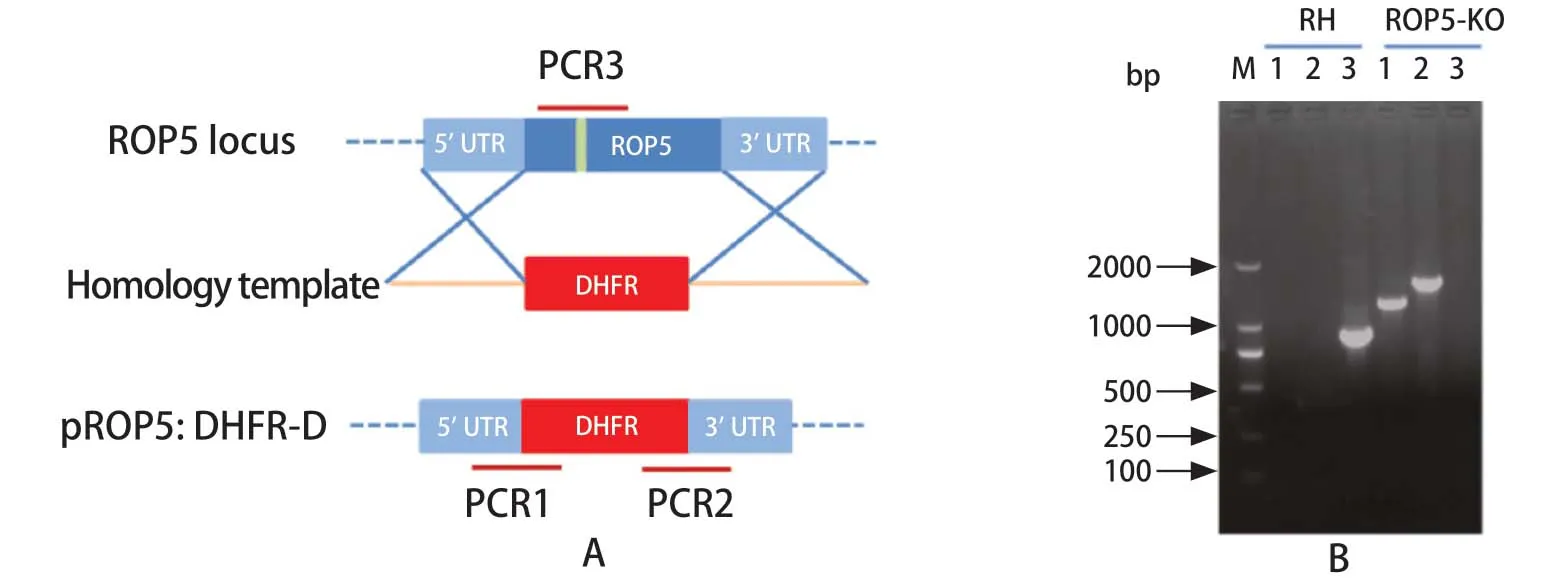
图2 ROP5基因缺失株的PCR鉴定Fig.2 PCR identification of ROP5-KO strain
2.3ROP5/ROP18双基因缺失株的筛选及鉴定 本实验室在前期研究中已成功构建pSAG1:CAS9::TgU6:sgROP18质粒和pROP18::CAT-D质粒。将两个质粒同时电转至构建成功的ROP5-KO株速殖子中,并通过40 μmol/L的氯霉素筛选。单克隆虫株扩大培养后提取基因组DNA进行PCR鉴定,同时以RH株为对照。结果显示,RH株中存在ROP5及ROP8基因,而基因缺失虫株中无条带,说明ROP5与ROP18的双基因缺失株构建成功(图3)。
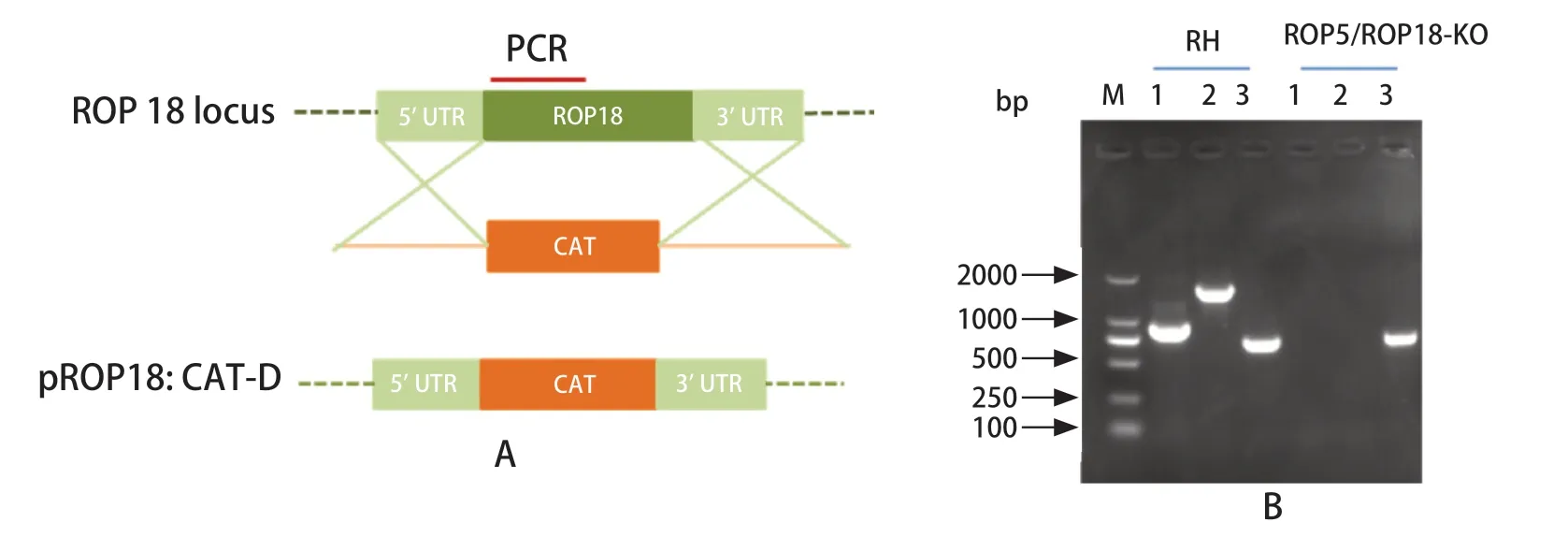
图3 ROP5/ROP18双基因缺失株的PCR鉴定Fig.3 PCR identification of ROP5/ROP18-KO strain
2.4 体外入侵及增殖试验 为了研究ROP5-KO株和ROP5/ROP18-KO株的表型变化,我们评估了ROP5-KO株和ROP5/ROP18-KO株的入侵能力、增殖能力。通过流式细胞仪分析可以得出(图4),RH株对Vero细胞的感染率为43.7%,而ROP5-KO株的感染率为34.8%,ROP18-KO株的感染率为29.3%,ROP5/ROP18-KO株的感染率为26.8%,说明缺失ROP5基因和ROP18基因均可导致弓形虫体外入侵细胞的能力降低。同时缺失ROP5及ROP18基因后,弓形虫的入侵能力明显低于RH株,也低于ROP5-KO株及ROP18-KO株。增殖试验结果可以看出,入侵36 h后,RH株假包囊中多为16个速殖子,而ROP5-KO株和ROP18-KO株,ROP5/ROP18-KO株中多为8个速殖子,且双缺失虫株的含16个速殖子的假包囊个数显著少于两种单基因缺失株,说明ROP5与ROP18双基因缺失后,显著降低弓形虫的增殖速率(图5)。

图4 流式细胞仪测弓形虫的入侵率Fig.4 Detection of T.gondii invasion rate by flow cytometry
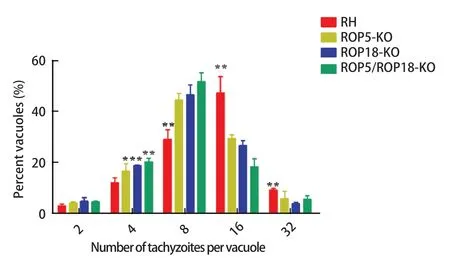
图5 体外增殖试验Fig.5 Proliferation experiment in vitro
2.5 噬斑试验 噬斑试验的结果同样可以看出,连续培养7 d后,ROP5-KO株、ROP18-KO株和ROP5/ROP18-KO株所形成的空斑面积小于RH株,且ROP5/ROP18-KO株所形成的空斑面积最小(图6)。说明ROP5与ROP18双基因缺失后,速殖子的生存能力降低,与体外入侵及增殖能力的试验结果一致。
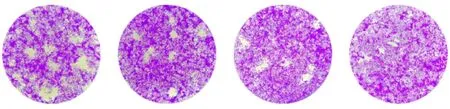
图6 噬斑试验Fig.6 Plaque assay
2.6 小鼠毒力试验 将RH株、ROP5-KO株、ROP18-KO株和ROP5/ROP18-KO株分别对昆明鼠进行腹腔接种,接种剂量为1×103个,记录各组昆明鼠的死亡时间。结果表明:RH株感染小鼠后,小鼠在第7 d全部死亡,但接种ROP5-KO株和ROP18-KO后,小鼠的存活时间均延长,且接种ROP5/ROP18-KO株后,小鼠的平均存活时间延长至9 d,说明当两者同时敲除后,可显著降低弓形虫的毒力(图7)。
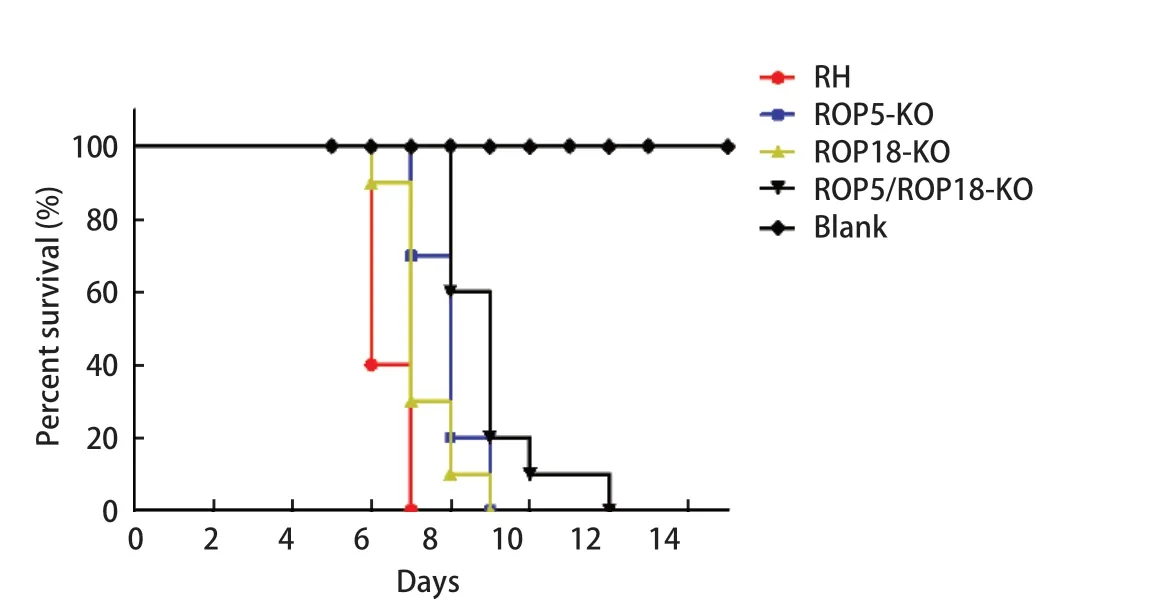
图7 缺失株对小鼠存活时间的影响Fig.7 Effects of mutant strains on the survival time of mice
3 讨论
CRISPR/Cas9系统是由CRISPR 序列元件与Cas9基因组成,然后通过一段序列特异性的guide-RNA分子引导核酸内切酶(Cas9)到特异靶点,从而定向完成基因组的编辑[20]。目前,CRISPR/Cas9基因敲除技术已成功应用于疟原虫[21]、利什曼原虫[22]、弓形虫[23-25]等多种寄生虫,提高了对寄生虫基因的编辑效率,有助于功能基因的分析及疫苗候选分子的筛选等。随着敲除技术的不断发展,针对单个sgRNA难以剪切的基因,可通过改造pSAG1:CAS9::TgU6:sgUPRT质粒,设计针对目的基因上下游的两个sgRNA,从而完成对整个目的基因片段进行剪切,提高基因敲除效率[26]。此外,为了进一步探索两个基因的协同作用,可构建针对目的基因的双基因缺失株,用不同的药物对阳性虫株进行筛选。目前已发现可用于弓形虫阳性筛选的药物有息疟定、氯霉素、霉酚酸等,用于阴性筛选的药物有5-氟尿嘧啶脱氧核苷(5-fluorodeoxyuracil)、6-硫黄嘌呤(6- thioxanthine)等。此外,Long等[27]还对基因敲除质粒进行改造,加入荧光标签蛋白(GFP和mCherry),通过荧光显微镜筛选阳性虫株。为了更利于探索弓形虫各基因之间的相互作用,CRISPR/Cas9技术的不断优化和升级,提高了基因编辑的效率及应用范围,促进对弓形虫各基因作用机制的研究,加快了对弓形虫特异性疫苗的研究。
本试验通过息疟定与氯霉素这两种药物对弓形虫缺失株进行阳性筛选,并成功构建了ROP5-KO株及ROP5/ROP18-KO株。表型试验结果表明,与RH相比,ROP5基因和ROP18基因单独缺失后,弓形虫的入侵及增殖能力、对小鼠毒力等方面均有明显下降,且ROP5/ROP18-KO株的入侵及增殖能力降低更为显著,且对小鼠毒力明显降低。在早期研究中,Fox等[28]对Ⅱ型弓形虫的多个ROP基因进行敲除,并发现ROP5和ROP18基因缺失后显著降低弓形虫对IRGs的抵抗力,并增加小鼠的存活率,说明ROP5和ROP18都是Ⅱ型弓形虫重要的毒力基因。本实验结果证明敲除RH株ROP5与ROP18后同样会导致RH株毒力降低,但RH株为强毒株,缺失株感染只延长了小鼠的存活时间,不能阻止小鼠死亡。Michael等[29]通过对Ⅱ型虫株ME49和强毒虫株VAND株进行基因比对,发现ROP5是导致强毒株和Ⅱ型虫株差异的主要毒力因子,且缺失ROP5基因可导致VAND虫株毒力显著减弱。Saeij等[30]也发现ROP18对小鼠毒力的差异主要表现在其表达水平不同,ROP18在Ⅰ型与Ⅱ型虫株体内表达量高,而在Ⅲ型虫株体内表达量低,当Ⅲ型虫株过表达ROP18Ⅰ或者ROP18Ⅱ,可恢复弓形虫对小鼠的毒力,说明ROP5与ROP18都是弓形虫重要的毒力因子。
目前,对弓形虫ROP5及ROP18的研究主要集中在IRGs方面。当弓形虫入侵宿主细胞时,宿主天然免疫系统发挥作用,产生大量的IFN-γ[31],IFN-γ进一步通过多种作用途径抑制弓形虫增殖并杀灭弓形虫[32-33]。IRGs可以聚集于纳虫泡膜表面,导致纳虫泡膜变形、穿孔甚至破裂,是宿主细胞抵抗胞内弓形虫的主要作用之一[34],一旦纳虫泡膜损坏,弓形虫将容易被宿主细胞细胞质溶解,从而清除弓形虫[35]。Zhao等[36]研究发现强毒株可以抵抗IRGs在PVM上聚集,从而避免被清除,中等毒力的Ⅱ型和无毒力的Ⅲ型寄生虫不能阻止IRGs的招募。造成这一显著差异的主要原因是不同虫株的ROP18和ROP5基因序列存在差异[37]。ROP18对阻止IRGs在纳虫泡上装配等方面发挥重要作用[38],它可磷酸化宿主Irga6核苷酸结合区域的两个苏氨酸,导致GTPase失去生物活性,抑制其在弓形虫空泡膜上的积累。ROP5在阻断IRG介导的免疫清除方面与ROP18具有协同作用[39]。此外,在缺乏ROP18时,ROP5可直接作用于IRGs,减少IRGs在PVM上富集[17]。
除了在抵抗IRGs方面发挥重要作用外,ROP5和ROP18还能抑制MHC-I对弓形虫抗原的递呈、减少CD8+T细胞识别和清除弓形虫[40]。此外,ROP18具有抑制宿主细胞凋亡的作用[14]。由此猜测这两者可能在其他方面也具有协同作用。构建ROP5与ROP18的双缺失株可为进一步研究两者的功能奠定基础。

