江苏省部分地区水禽肠道外致病性大肠杆菌的分离鉴定及生物学特性研究
郭长明,陈怀君,袁 橙,封 琦,王永娟,徐 海,吴 双,朱善元
(1.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,泰州 225300;2.广西大学动物科学技术学院,南宁 530004)
禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC)属于肠道外致病性大肠杆菌(Extraintestinal pathogenicEscherichiacoli,ExPEC)[1],所引起的禽大肠杆菌病可通过多种途径进行传播,其特征是多器官组织的损伤并伴有肝炎和心包炎等症状,是一种复杂的综合症[2]。水禽大肠杆菌感染发病率和死亡率高,给水禽养殖业造成了严重的经济损失。使用抗菌药物仍然是治疗水禽大肠杆菌病的主要手段,随着抗生素的广泛应用,使水禽大肠杆菌对常用抗生素的耐药性日益严重,多重耐药菌株增多,为临床上防控和治疗该病带来极大的挑战[3]。同时,不合理的使用抗菌药物,也导致动物体内抗菌药物的残留,细菌的耐药性可以通过动物源性食品传给人类,从而威胁到人类的健康[4-5]。
禽大肠杆菌血清型数量众多且复杂,并随着时间和地域改变,使用疫苗对该病进行防治存在难度。我国各地分离到的APEC血清型达50余种,常见的O抗原血清型为O2、O76、O78、O92和O93等[6]。研究表明,通过系统进化分群对禽大肠杆菌进行分类,其主要类型为B2和D型[6]。毒力相关因子在禽大肠杆菌感染的过程中发挥重要作用,如与宿主组织定植相关的黏附素(F1菌毛、P菌毛)、参与摄铁的耶尔森菌强毒力岛(high pathogenicity island,HPI)、肠细胞脱落位点毒力岛(locus of enterocyte effacement pathogenicity island,LEE)、Ⅲ型分泌系统2(ETT2毒力岛)、溶血素(hemolysin E,HlyE)、自转运蛋白温度敏感性血凝素(temperature-sensitive hemagglutinin,TSH)等。研究表明,部分毒力因子之间相互作用影响菌株的致病力,通常含有4个以上毒力因子的禽大肠杆菌具有致病性[6]。
2020年1月—2020年9月本实验室(江苏省兽用生物制药高技术研究重点实验室)在江苏省部分地区的水禽养殖场进行采样,并分离鉴定出禽大肠杆菌24株。通过对分离株进行分子进化分群、O抗原血清型、毒力基因和耐药情况的检测,旨在明确江苏省水禽大肠杆菌病的流行情况和为有效防治大肠杆菌病提供参考。加强对水禽致病性大肠杆菌流行病学的监测和防控,对水禽养殖业的健康发展和兽医公共卫生具有重要意义。
1 材料与方法
1.1 样品来源 24株禽大肠杆菌为本实验室于2020年1月—2020年9月从江苏部分地区水禽养殖场发病死亡水禽的肝脏、心脏、脑中分离获得。
1.2 主要试剂 2× RapidTaqMaster Mix、2×TaqMaster Mix均购自南京诺唯赞生物科技有限公司;LB培养基、麦康凯培养基、伊红美蓝培养基均购自英国OXOID公司;细菌基因组DNA提取试剂盒、DL2000 DNA Marker均购自宝生物工程(大连)有限公司;引物由苏州金唯智生物科技有限公司合成;大肠杆菌O抗原单因子血清购自中国兽医药品监察所;药敏纸片购自杭州滨和微生物试剂有限公司。
1.3 细菌的分离及16S rDNA PCR鉴定 用接种环在无菌条件下蘸取病死水禽的心脏、肝脏、脑组织,划线于麦康凯平板上,37℃培养16 h,挑取单个红色菌落接种于伊红美蓝培养基,37℃培养16 h,挑取金属光泽疑似大肠杆菌单菌落,接种于LB培养基,置于摇床180 rpm、37℃恒温培养6 h。分别取新鲜菌液1 mL,按细菌基因组DNA提取试剂盒说明书提取细菌基因组DNA。根据参考文献[11]合成大肠杆菌16S rDNA PCR鉴定引物(表1),对24株分离菌株进行PCR鉴定。PCR反应体系共25 μL:2×TaqMaster Mix 12.5 μL,上、下游引物各1.0 μL,模板2.0 μL,ddH2O 8.5 μL。PCR反应条件:95℃预变性3 min;95℃变性15 s,53℃退火15 s,72℃延伸30 s,共30个循环;72℃再延伸5 min。反应结束后,取2.0 μL的PCR产物进行1%琼脂糖凝胶电泳检测结果。

表1 16S rDNA和毒力相关基因引物序列Table 1 Primers for 16S rDNA and virulence-related genes
1.4 O抗原血清型鉴定 按照大肠杆菌O抗原定型血清说明书制备抗原,取抗原和血清各50 μL于载玻片上混匀,涂成直径约2 cm的圆膜,1 min内出现明显凝集颗粒判定为阳性。同时以抗原与0.5%石炭酸生理盐水混合物作对照,观察有无自凝集现象。
1.5 毒力相关基因PCR鉴定 根据参考文献[7-13]合成fimA、papC、irp2、eaeA、ECs3703、ECs3737、tsh、hlyE共8对毒力相关基因的检测引物。对24株分离株进行PCR检测,引物信息见表1。PCR反应体系共25 μL:2×TaqMaster Mix 12.5 μL,上、下游引物各1.0 μL,模板2.0 μL,ddH2O 8.5 μL。PCR反应条件:95℃预变性3 min;95℃变性15 s,退火(退火温度见表1)15 s,72℃延伸40 s,共30个循环;72℃再延伸5 min。反应结束后,取2.0 μL的PCR产物进行1%琼脂糖凝胶电泳检测结果。
1.6 细菌分子进化分群PCR鉴定 根据参考文献[7]合成大肠杆菌分子进化分群引物(引物信息见表2),采用三重PCR方法对分离菌株进行系统分群鉴定,大肠杆菌系统进化分群判定标准见图1。PCR反应体系共25 μL:2× RapidTaqMaster Mix 12.5 μL,3对上、下游引物各1.0 μL,模板1.0 μL,ddH2O 5.5 μL。PCR反应条件:95℃预变性3 min;95℃变性15 s,55℃退火15 s,72℃延伸15 s,共30个循环;72℃再延伸5 min。

图1 大肠杆菌系统进化分群判定标准Fig.1 Standard for the determination of the Escherichia coli phylogenetic group
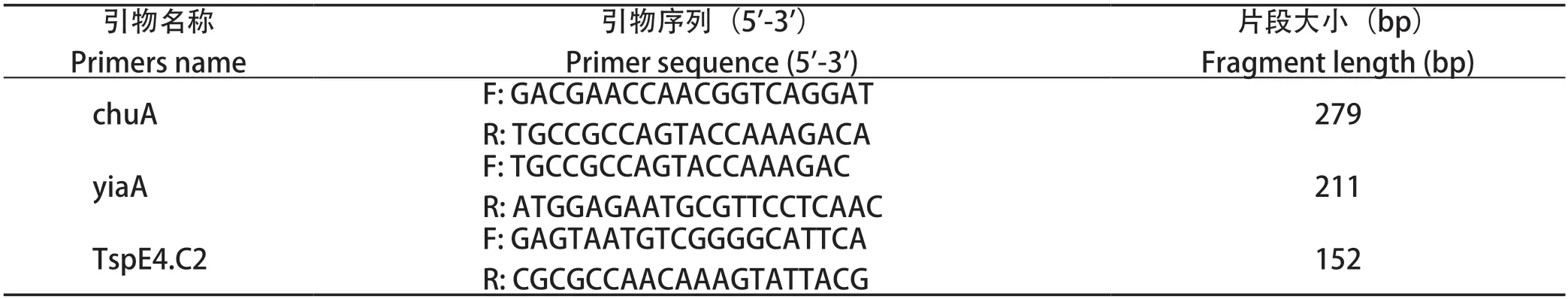
表2 大肠杆菌分子分群引物序列Table 2 Molecular clustering primer sequence of Eschorichia coli
1.7 药敏试验 选取24种抗菌药依据美国临床实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)制定的抗生素药敏试验标准,用Kirly-Baue纸片扩散法测定分离菌株耐药性。取100 μL细菌培养液涂板、贴药敏片,37℃培养18 h后观察结果并量取抑菌圈大小,依据抑菌范围解释标准进行结果判断。
2 结果
2.1 细菌的分离及16S rDNA PCR鉴定 用麦康凯培养基和伊红美蓝培养基分离培养大肠杆菌,再通过PCR鉴定,共分离到24株大肠杆菌。分离株在麦康凯和伊红美蓝培养基上的生长形态见图2,部分菌株16S rDNA PCR鉴定结果见图3。
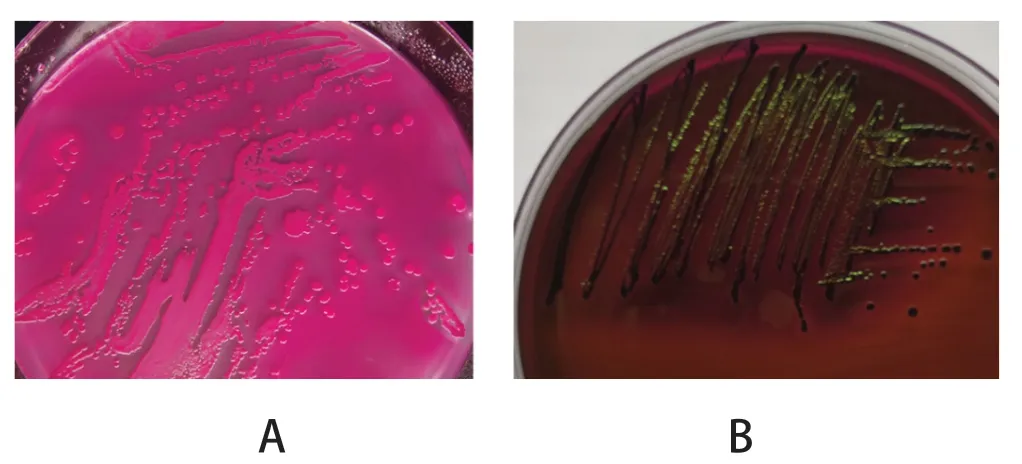
图2 大肠杆菌在麦康凯培养基(A)和伊红美蓝培养基上的形态(B)Fig.2 Morphology of Escherichia coli on MacConkey (A)and Eosin-methylene Blue medium (B)
图3 部分菌株16S rDNA PCR产物电泳结果Fig.3 Agarose gel electrophoresis of PCR products of 16S rDNA gene of some strains
2.2 O抗原血清型鉴定 对24株分离菌株进行O抗原血清型鉴定,鉴定结果如表3所示。其中,血清型为O16、O68、O87、O126、O138、O164型的菌株各1株,O65血清型菌株共8株,占全部菌株的33.3%,其他血清型10株。
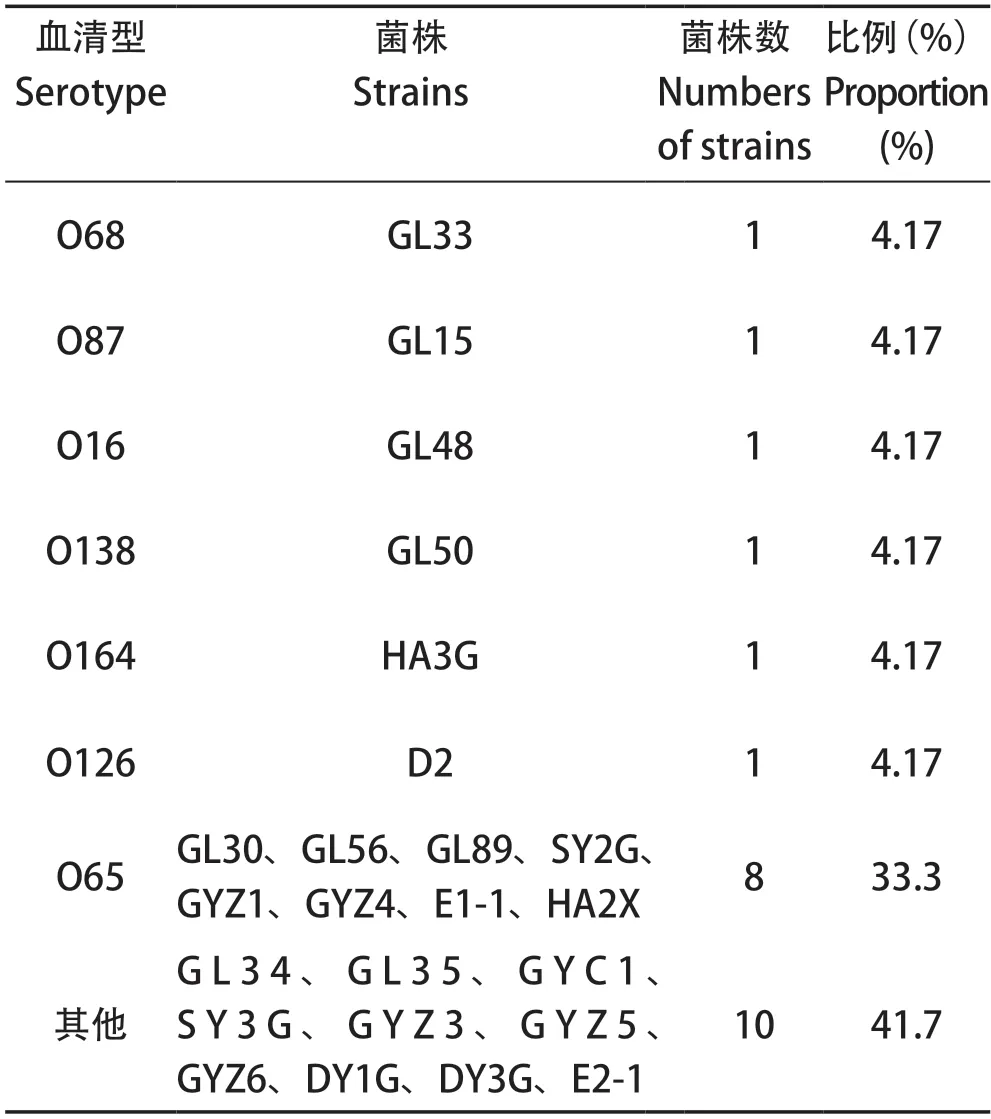
表3 24株禽致病性大肠杆菌的血清型分布Table 3 Serotype distributions of 24 strains of APEC
2.3 毒力基因的鉴定 通过PCR分别检测了24株禽大肠杆菌分离株8种毒力基因,由检测结果可知,除eaeA、papC、hlyE这3个毒力基因外,其余5种毒力基因均有检测到(图4~5)。其中fimA基因在所有菌株中被检出20株(83.3%)、ECs3737基因18株(75%)、ECs3703基因16株(66.7%)、tsh基因8株(33.3%),均有较高的分布率,为重要的APEC毒力基因,而irp2基因检测到3株阳性,检出率为4.2%。

图4 部分菌株毒力基因PCR产物凝胶电泳结果Fig.4 Agarose gel electrophoresis of PCR products of virulence genes of some strains
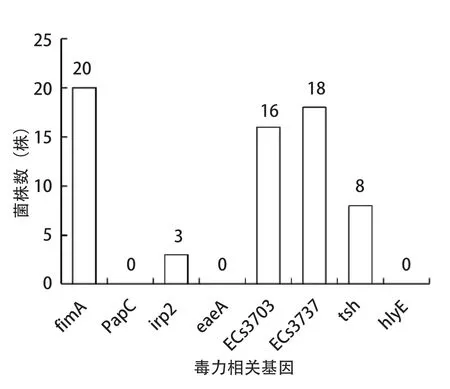
图5 8种毒力相关基因在24株APEC中的分布Fig.5 Distribution of 8 virulence-associated genes in 24 strains of APEC
对24株分离菌株毒力基因组合分布进行统计,结果如表4所示,含有4个毒力基因组合的菌株共7株(29.2%),其中基因组合为fimA+ECs3703+ECs3737+tsh有6株,fimA+ECs3703+ECs3737+irp2组合1株。3种基因组合共9株(37.5%),其中组合fimA+ECs3703+ECs3737有7株。

表4 不同毒力基因组合在分离菌株中的分布Table 4 Distributions of combination of different virulence genes in isolated strains
2.4 细菌分子进化分群鉴定 对24株水禽大肠杆菌进行系统进化分群鉴定,可观察到特异电泳条带chuA(279 bp)、yjaA(211 bp)和TspE4.C2(152 bp)(图6)。系统进化分群结果可知,非致病群A占45.8%(11/24),低致病群B1占33.3%(8/24),高致病群B2和D分别占8.3%(2/24)和1.3%(3/24)(表5)。
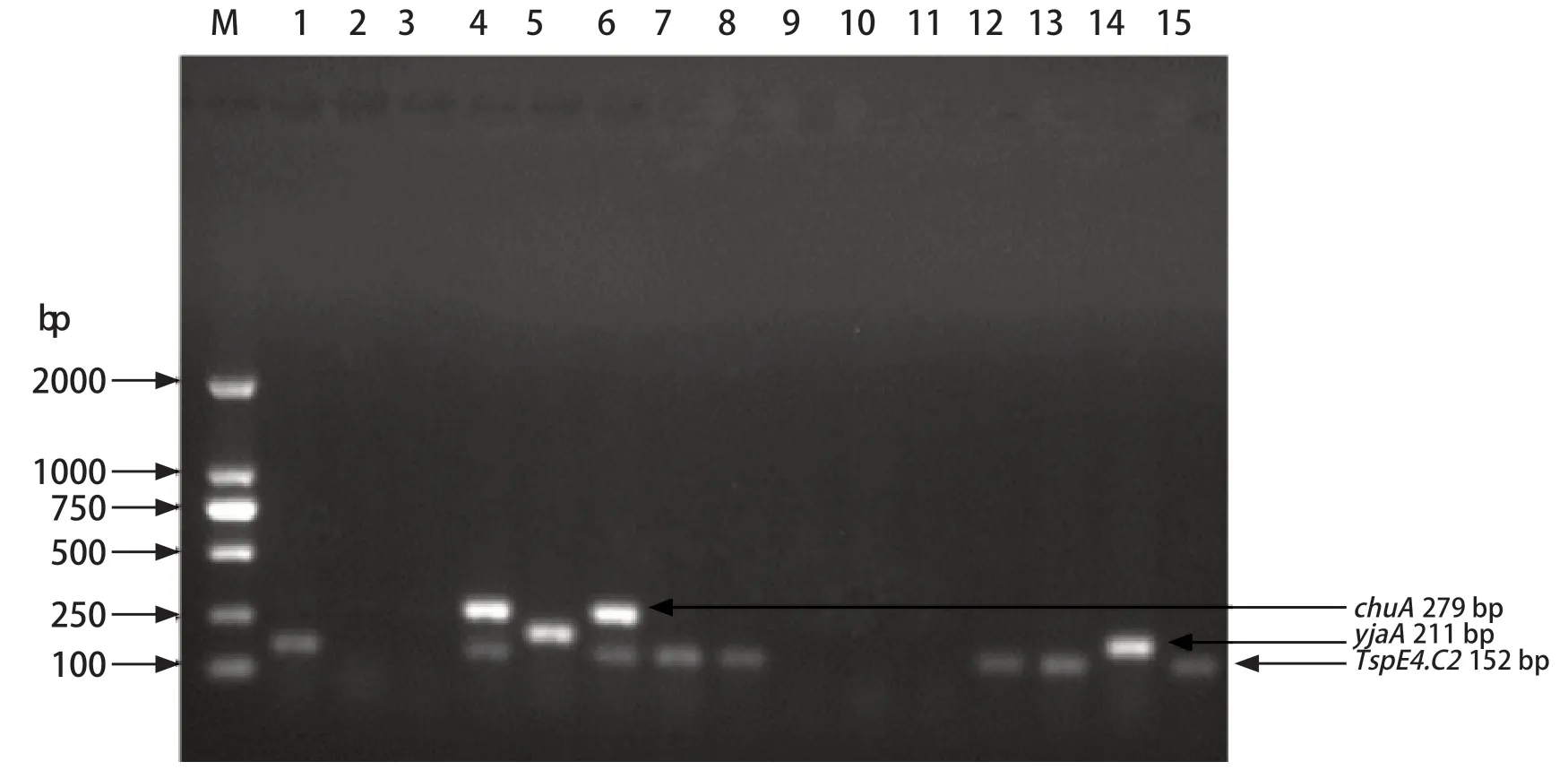
图6 部分菌株系统进化分群电泳结果Fig.6 Results of phylogenetic electrophoresis of some strains

表5 不同进化分群在分离菌株中的分布Table 5 Distribution of different evolutionary clusters in isolated strains
2.5 药敏试验 药敏试验结果显示,24株分离菌株对受试的抗菌药物表现出多重耐药。其中分离菌株均对恩诺沙星、强力霉素(100%)耐药,对四环素、万古霉素、红霉素的耐药率为91.7%。分离株对阿莫西林的敏感率仅为16.7%,但对阿莫西林/棒酸的敏感率为100%(表6)。多重耐药统计结果可知,在24株分离菌株中,耐10种以上药物的菌株占79.2%(19/24)(图7)。
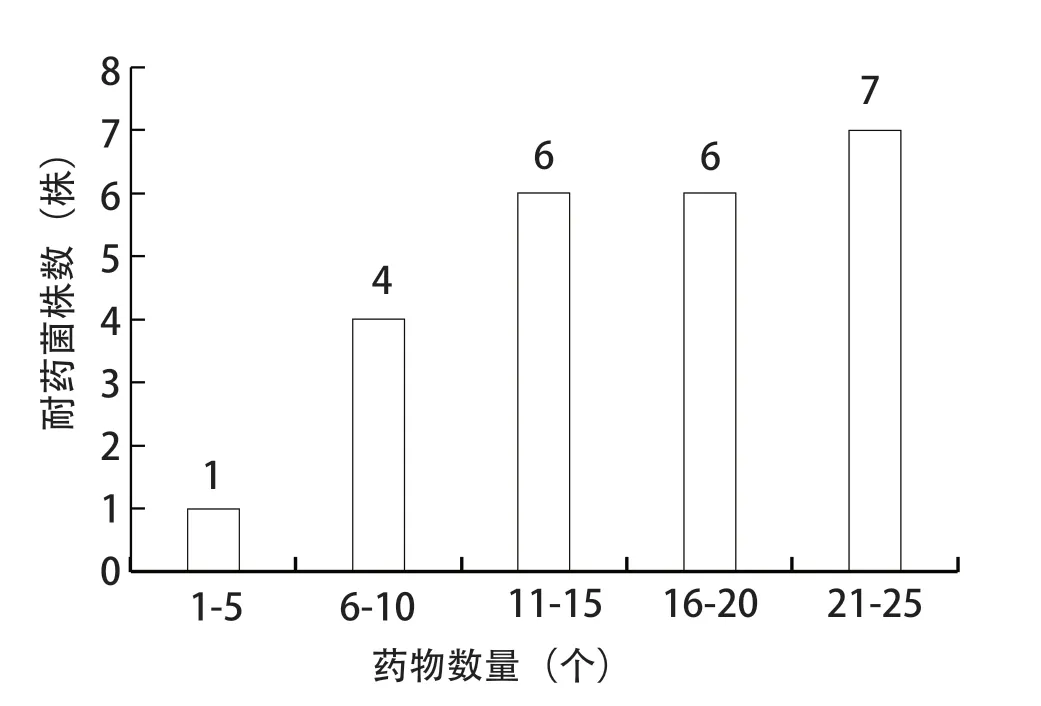
图7 24株APEC对24种抗生素的多重耐药统计结果Fig.7 Results of multiple drug resistance of the 24 APEC isolates to 24 antibiotics
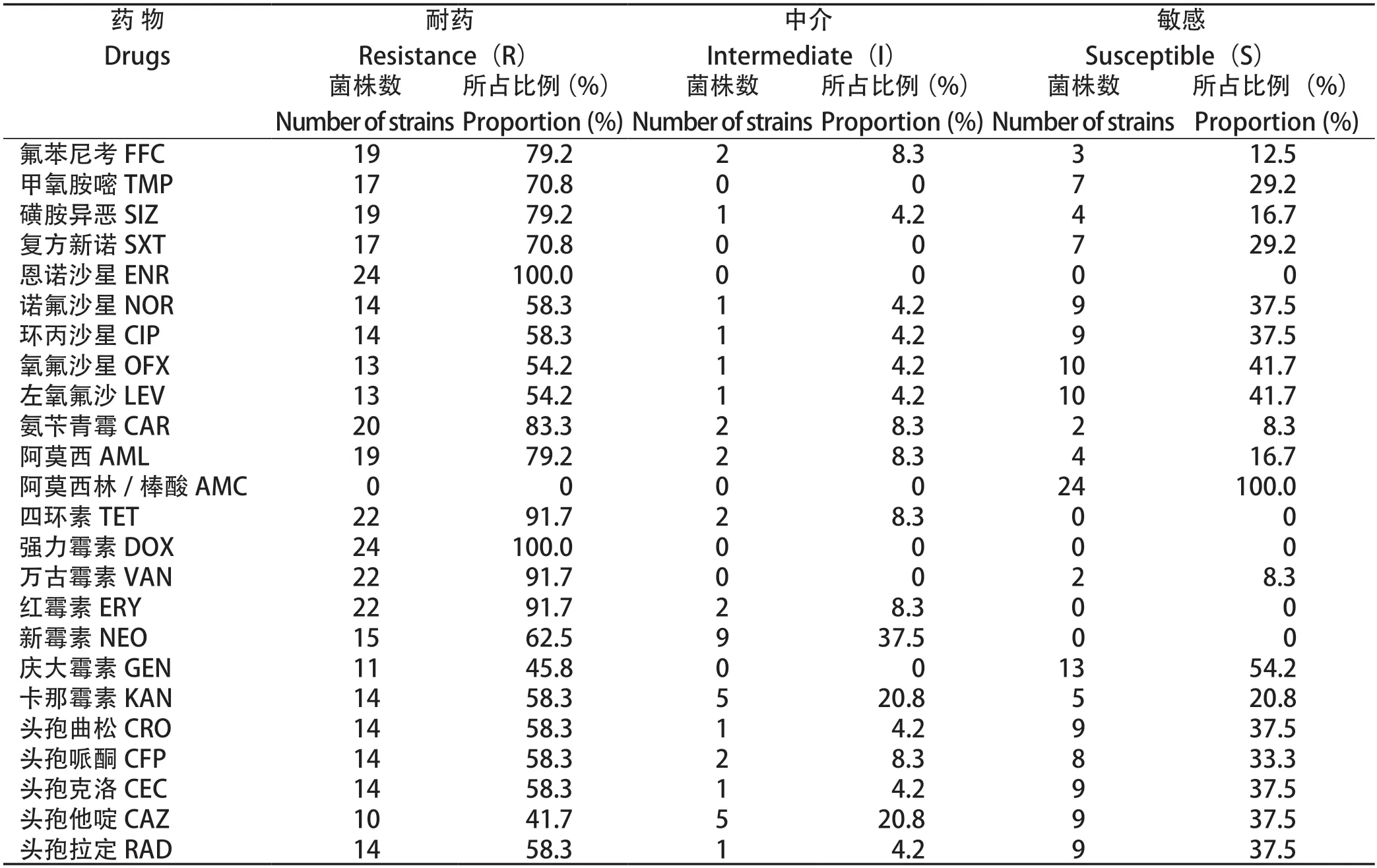
表6 24 株分离菌株的药敏试验Table 6 Drug sensitivity assay for 24 isolated strains
3 讨论
近年来,随着全球经济的发展,人类对肉蛋奶等动物相关产品的需求量也与日俱增,在养殖业规模不断扩大的同时伴随着动物疫病频发[14]。APEC具有复杂多样的血清型,因此,使用疫苗对该病进行预防较为困难。由于一些养殖场不合理地使用甚至滥用抗菌药物,致使细菌耐药性、多重耐药性问题日趋严重。若动物源食品中含有抗菌药物残留,会给人类和动物的健康带来不利影响。因此,对APEC进行分子流行病学调查十分必要,以便掌握其流行特点及规律,为精准防控该病奠定基础。
本研究分离得到的24株APEC,通过血清型鉴定发现,优势血清型主要为O65,与董向磊[15]报道的山东地区流行的优势血清型结果一致。但是与国内外其他研究报道的APEC优势血清型为O2、O76、O78、O92、O93、O119的结果差异较大[6,16-17]。研究表明,国内外不同地区的禽大肠杆菌分离株O抗原血清型存在一定差异,可能是采样地点、季节及时间的不同所导致。此外,水禽的跨地域销售运输和疫苗防控也可能使当地的优势血清型发生改变[18]。因此,需要针对各个地区流行的APEC血清型及相应的环境气候采取较为有效的防控措施。
系统进化分群是对大肠杆菌进行分型的一种重要的方法,可以追溯大肠杆菌进化起源[18]。本研究发现,24株分离菌株主要为A和B1进化分群,与Kobayashi等[19]研究报道的巴西某屠宰场的优势进化分群结果相一致,但与其他国家及国内某些地区研究结果不同,部分研究显示分离菌株的优势进化分群为B2群[6,20]。分离菌株的进化分群类型有所差异可能是由于采样地点、动物来源、饲养环境及采样时间的不同所致。
本研究设计合成的8种毒力基因与禽大肠杆菌的致病性、耐药性存有一定联系。fimA基因在所有分离菌株中的检出率为83.3%,ECs3737基因为75%,ECs3703基因为66.7%,均有较高的分布率,为重要的禽大肠杆菌毒力基因。而tsh、irp2基因在本研究中检出率略低,分别为33.3%、4.2%。24株分离菌株同时也存在多种毒力基因组合形式,含有4个及以上毒力基因组合的菌株共7株,其中,fimA+ECs3703+ECs3737+tsh基因型有6株,fimA+ECs3703+ECs3737+irp2基因组合为1株。3基因组合共9株,其中fimA+ECs3703+ECs3737基因组合有7株。携带毒力基因较多的菌株可能致病性也较强,各分离株的致病性尚需进一步验证。
药敏试验结果显示,分离菌株均为多重耐药菌株,其中79.2%(19/24)的菌株耐10种以上药物,由此可见,目前水禽大肠杆菌多重耐药现象较为严重,这可能与其血清型复杂、不合理使用抗菌药物有关[21]。APEC分离株对恩诺沙星、强力霉素两种药物的耐药率为100%,出现对同种药物耐药的现象,可能与江苏地区各养殖场的用药习惯有关,这些药物可能长期用于水禽大肠杆菌病的防控,导致耐药性的产生。Dou等[22]研究表明,在中国东部分离的243株APEC中,对四环素耐药的菌株占98%。本研究24株分离菌株中对四环素耐药的占91.7%,耐药率较高,与该研究结果一致。胡紫萌等[23]研究结果表明,分离的APEC对四环素、氟苯尼考、恩诺沙星、氧氟沙星的耐药率分别为100%、86%、70%、36%,钟舒红等[24]研究报道,在广西分离的禽源致病性大肠杆菌中,对氟苯尼考、恩诺沙星、庆大霉素的耐药率分别为47.8%、22.8%、26.5%,与本文研究结果均有所差异,这可能跟分离株的时空分布、各地的用药习惯不同有关。由本研究结果可以看出,国内不同地区的水禽大肠杆菌分离菌株均有不同程度的多重耐药现象,因此科学、合理、精准的使用抗菌药物对有效控制水禽大肠杆菌病的发生、减抗限抗的推广都具有重要意义。
本研究通过对江苏省部分规模化水禽养殖场分离的24株水禽肠道外致病性大肠杆菌进行O抗原血清型测定、毒力基因及系统进化分群检测及耐药性研究,为水禽致病性大肠杆菌致病机理及防控提供参考,同时为后续对禽大肠杆菌耐药机制的研究奠定基础。

