基于酿酒酵母的多片段质粒的构建
汤雅萍,程毅,王吐虹,陈佳,高春生,郭利桃,宋志强,唐超,严准,李智敏
基于酿酒酵母的多片段质粒的构建
汤雅萍,程毅,王吐虹,陈佳,高春生,郭利桃,宋志强,唐超,严准,李智敏*
(中国农业科学院麻类研究所,湖南 长沙 410205)
为避免现有的多片段质粒构建技术的弊端,提高多片段质粒构建效率,以构建树干毕赤酵母基因的敲除载体为例,利用酿酒酵母活体细胞重组系统,一次性将多个外源DNA片段和线性化质粒重组,形成环状质粒。通过引物设计在相互连接的DNA片段之间引入50 bp重叠序列,用PCR扩增DNA片段后,与线性化质粒一起转化酿酒酵母,再用PCR和测序等方法鉴定阳性酵母菌落中质粒的正确性。通过本方法构建的多片段质粒正确率高、耗时短。
质粒构建;多片段质粒;酵母同源重组系统
基因工程操作中常需要将多个DNA片段连接克隆到同一个载体质粒中,传统的方法是利用DNA内切酶酶切后再用DNA连接酶将2个片段连接起来构建质粒,每次构建最多只能连接2个片段[1],下一个DNA片段的构入必须以前一个成功构入DNA片段的质粒为基础。可见,传统方法受DNA片段内切酶位点的限制,工作量大,周期长。Gateway技术在表达载体构建上不需要人工酶切/连接,也可以在特定结构的载体上一次构入几个DNA片段[2],但Gateway技术需要在载体上预先设置attB重组位点,也不能随意进行多个DNA片段的连接。基于λ噬菌体Red/ET重组酶系统的质粒构建技术有一定优越性[3],但该方法需要预先在细菌中表达Red/ET系统的多个重组酶后才能用于多片段质粒的构建[4]。这些技术都有一定的壁垒,应用起来都不够便捷。目前较常用的、操作相对简单的是基于Gibson assembly 原理的无缝克隆试剂盒商业产品,但该产品对于多个DNA片段的质粒构建成功率较低。
酿酒酵母细胞内具有一套严谨且高效的DNA同源重组系统,保证了酵母遗传物质的修复和维护[5]。很多研究利用这一重组系统将外源DNA整合到酵母基因组上进行基因表达[6]或者利用这一重组系统进行酵母内部基因敲除[7]。有研究人员利用约50 bp的同源重组序列在酵母菌活体细胞内成功构建了质粒[8–9],但该研究只涉及1个外源基因片段与1个载体的重组连接。KUIJPERS等[10]利用酵母的重组系统并通过60 bp的重叠序列,实现了几个片段质粒的构建,但60 bp的重叠片段还是相对较长,这增加了引物合成的成本。本研究以构建树干毕赤酵母1个未知功能基因()的敲除载体为例,探讨1种更高效的多片段质粒构建方法,包括50 bp重叠序列引物设计、外源DNA片段制备、酿酒酵母转化以及阳性酵母菌落鉴定等4个主要步骤,完成该试验操作仅需3 d时间即可获得正确的、多片段组装的目标质粒。
1 材料与方法
1.1 试验材料
分别含有pS300质粒、p2076质粒和pHyg质粒的3个DH5α大肠埃希菌菌株和酿酒酵母()4741菌株以及树干毕赤酵母()CBS 6054菌株由中国农业科学院麻类研究所提供。
初始质粒pS300作为构建载体的骨架,其主要结构如图1所示。它包含pMB1 ori、f1 ori 2个原核细胞复制子和在大肠埃希菌中的筛选标记Amp 抗性基因,以及可在酵母宿主中自行复制的元件(CEN/ARS)和线性化酶切位点d III。p2076质粒中含有G418抗性基因,在本次质粒构建中作为酿酒酵母的阳性克隆筛选标记。pHyg质粒中含有潮霉素筛选标记Hyg抗性基因,作为基因敲除序列结构中的1个元件(在本试验中不作为筛选标记)。树干毕赤酵母CBS 6054菌株则提供基因的左、右侧翼片段序列,序列来源分别是v2.0 assembly中的Picst3|chr_3.1:98395- 99420和Picst3|chr_3.1:103936-105124(http://genome.jgi.do e.gov/Picst3/Picst3.home.html)。

图1 pS300质粒的主要结构
1.2 方法
1.2.1引物设计与外源DNA片段及初始质粒骨架的制备
试验预期构建的基因敲除载体质粒所需外源DNA片段和连接方向为pS300 线性质粒3→ 5G418抗性基因3→ 5左同源臂3→ 5Hyg抗性基因3→ 5右同源臂3→ pS300 线性质粒5,如图2所示。利用酵母重组系统构建质粒,要求在相邻2个DNA片段的接头处有约50 bp重叠序列。为使这些片段按规定顺序进行连接,用Primer premier 5.0设计好各个DNA序列的特异引物后在引物上添加相应的50 bp重叠序列,具体引物序列如表1,各片段间的50 bp 重叠序列区如图2所示。各个外源DNA片段可通过PCR扩增获得。提取pS300初始质粒后用d III酶切线性化;各个片段均用DNA凝胶试剂盒纯化回收。用NanoDrop 2000测定DNA片段浓度后,各个DNA片段均保存于–20 ℃冰箱中,备用。为便于后续基因敲除片段的线性化,设计引物时在左侧翼片段的左端和右侧翼片段的右端均加上II酶切位点。引物对S300–F和S300–R分别位于pS300质粒线性化d III酶切位点的左、右两侧(如图1所示)。
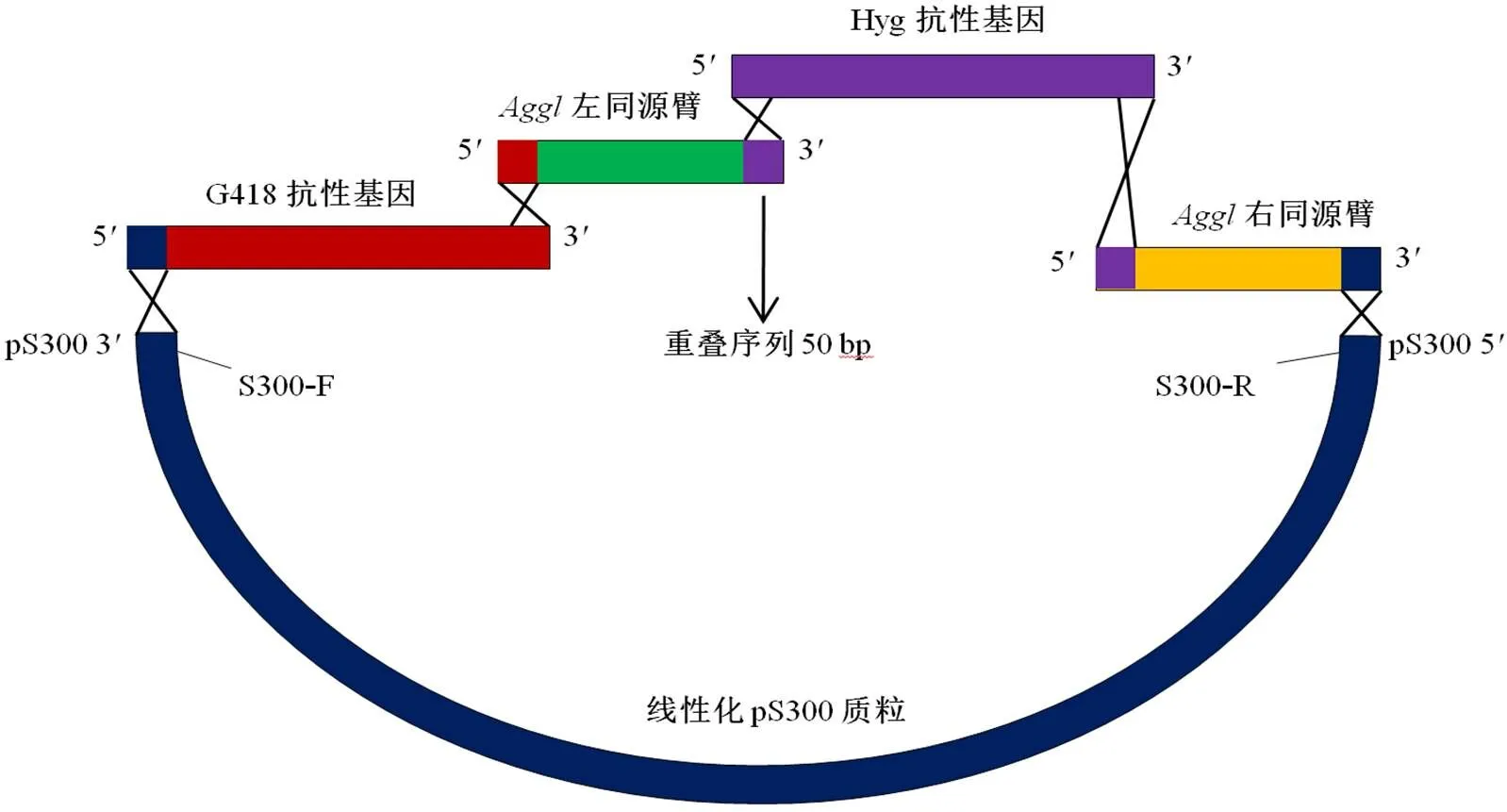
图2 外源DNA片段与pS300质粒连接的结构

表1 本试验所用的引物
序列单下划线为50 bp同源片段,双下划线是在引物中引入的II酶切位点。
1.2.2酿酒酵母的转化
根据GIETZ等[11]的“LiAc/SS carrier DNA/PEG”方法制备和转化酵母感受态,但稍有改动:加入的各个DNA和质粒溶液的量如表2所示,对照样品不加G418抗性基因的DNA片段,而用1.6 μL ddH2O 代替;总体积不超过10 μL。转化DNA片段后加500 μL新鲜的YPD培养液,在30 ℃、200 r/min摇床中活化4 h;随后取100 μL活化的细胞液用于涂皿。G418抗性基因以抗生素G418为筛选药物,制作含有200 μg/mL G418的YPD固体培养基作为筛选平皿。对照样品涂布于不含G418和含G418的2个培养皿中(以检验G418是否有效),而处理样品涂布于含G418的培养皿中;封皿后放于30 ℃恒温培养箱中培养36~48 h。在培养36 h时拍照。

表2 酵母转化时各个DNA片段的加入量
1.2.3阳性菌落的鉴定
从不含G418的对照样品平皿上挑取少许菌体接种于不含G418 的YPD培养液中(作为后续阳性菌落PCR鉴定的对照);从处理样品平皿中随机挑取9个阳性菌接种于含有200 μg/mL G418的YPD液体培养基中,在30 ℃、200 r/min培养过夜。采用PBC快速PCR模板制备方法[12]制备PCR模板。用S300–F、S300–R引物(在pS300质粒上的位置如图1所示)和CloneAmp HiFi PCR Premix (Clontech)对各个样品模板进行PCR扩增,1.2%凝胶电泳检测。如插入片段大小与预期(约5656 bp)相符,进一步用Yeast Plasmid Kit (Omega Biotek)提取质粒并将质粒DNA通过CaCl2–热激法[13]转化到大肠埃希菌DH5α中。对阳性DH5α菌落摇菌培养并提取质粒后用II和I分别进行单酶切和双酶切,通过凝胶电泳观察酶切情况,初步判断质粒构建是否正确;通过步移测序(由湖南擎科生物技术有限公司完成)进一步确定多片段载体构建质粒序列的正确性。
1.2.4作图
运用ApE软件制作圆形质粒图。
2 结果与分析
2.1 各个DNA片段和线性化质粒骨架的获取
用相应的引物和DNA模板扩增4个外源DNA片段,1.2%琼脂糖凝胶电泳。结果(图3)显示:第2泳道G418抗性基因目的条带位于2000 bp和1200 bp中间靠下位置,与预期的1432 bp片段长度相符;第3泳道左同源臂、第4泳道Hyg抗性基因和第5泳道右同源臂的目的条带的大小均与预期长度(表1)相符,初步证明PCR扩增结果正确;从大肠埃希菌提取的pS300质粒以超螺旋状态为主(第6泳道),证明质粒提取效果良好;pS300质粒经d III酶切后被线性化,电泳条带大小接近3000 bp(第7泳道),与预期的2872 bp长度相符。
经纯化后的各个DNA片段的浓度约为30 ng/μL,具体浓度如表2所示。转化酿酒酵母时,为保证各个片段之间量的比例约为1,各片段按表2取适当体积的DNA溶液加入酿酒酵母感受态中混合转化。
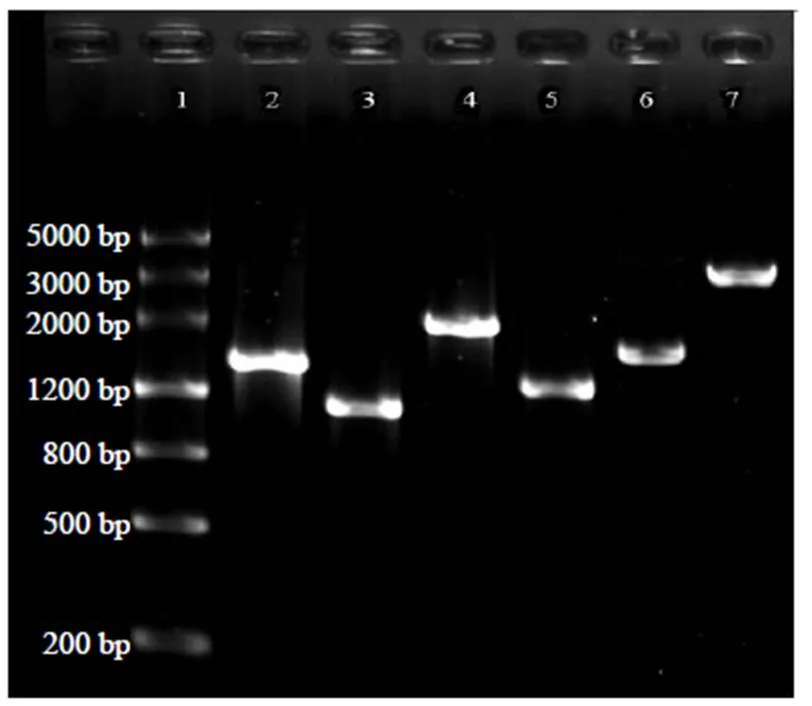
泳道1 DNA ladder;泳道2 G418抗性基因;泳道3 Aggl左同源臂;泳道4 Hyg抗性基因;泳道5 Aggl 右同源臂;泳道6 pS300质粒;泳道7 Hind III酶切线性化的pS300质粒。
2.2 转化酿酒酵母后获得的阳性克隆及PCR验证
将G418抗性基因、左同源臂、Hyg抗性基因、右同源臂和线性化pS300质粒等5个外源DNA片段共同转化酿酒酵母4741菌株感受态,转化结果如图4所示。对照样品的2个皿中,不含G418的平皿上长满了酵母菌体(图4–a),而含有G418的平皿上没有长出任何菌落(图4–b)。加G418抗性基因的处理样品长出了超过100个克隆的阳性菌落(图4–c)。可见缺少G418抗性基因的对照样品不能形成带有G418抗性的质粒,而加有G418抗性基因的处理样品平皿中的单菌落在酵母活体细胞同源重组系统作用下形成了环状化的带有G418抗性的质粒。

图4 多片段共转化酿酒酵母的平皿筛选结果
在处理样品皿(图4–c)上随机挑取9个阳性菌落进行PCR鉴定,结果显示:对照菌没有扩增出任何条带(图5泳道2);而随机挑取的9个阳性菌落中有6个(图5泳道3、5、6、7、10和11)能扩增出稍大于5000 bp的目的条带,该条带的大小与预期的4个DNA片段(G418抗性基因、左同源臂、Hyg抗性基因和右同源臂)的大小之和(约5656 bp)相符;另外3个阳性菌落的PCR扩增片段(图4泳道4、8和9)大小约1600 bp,与预期不符。初步证明已经成功构建了由4个外源DNA片段与质粒组成的复杂载体,多片段质粒构建成功率约为66.7%。由于构建好的质粒在酵母细胞中的拷贝数较低,为获得较多的质粒,将图5第3泳道对应的菌株DNA转化大肠埃希菌DH5α菌株,用于下一步酶切和测序验证,并将该质粒命名为knockout plasmid。
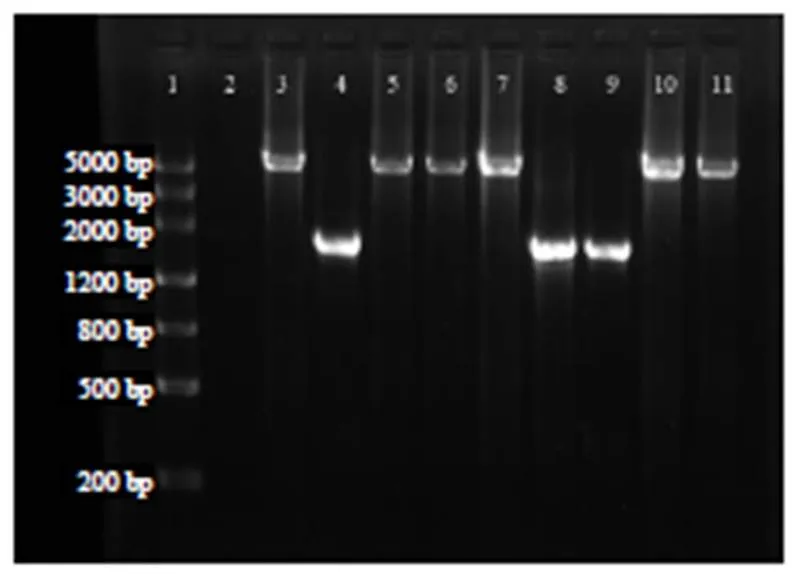
泳道1 DNA ladder;泳道2 对照4741菌株;泳道3~11 处理样品的阳性菌落。
2.3 酶切和测序进一步检验构建的多片段质粒
为验证knockout plasmid质粒中是否含有预设的2个II酶切位点以及1个I酶切位点(Hyg抗性基因本身带有该酶切位点),对从大肠埃希菌中提取的knockout plasmid 质粒进行酶切和电泳分析。各个外源DNA片段拼接的预期质粒结构和设置的酶切位点如图6–a所示。在序列位置1 bp和4089 bp位置设有酶切位点II(表1),在1842 bp位置有酶切位点I。用II和I分别对knockout plasmid质粒进行单酶切和双酶切的结果如图6–b所示。II的单酶切产物在电泳图上有1条带位于3000~5000 bp(图6–b,第3泳道),这个结果与预期相符。因为在预期的圆形质粒上有2个II位点,能将质粒切成4089 bp和4292 bp 2个片段,这2个片段长度较大且片段大小接近,在1.2%琼脂糖凝胶电泳上难以分开而只形成一条带。用I进行单酶切后有单一的条带,条带位置远大于DNA ladder 的5000 bp条带(图6–b,第4泳道),与预期的knockout plasmid质粒8382 bp相符。用II和I对该质粒进行双酶切,结果产生3条带:一条带在3000~5000 bp,另外2条带分别在DNA ladder 2000 bp带的上、下位置。从质粒结构图谱上可知II和I双酶切可以形成3个片段,片段大小分别为4292、2247、1842 bp。可见,双酶切的结果也与预期相符。酶切结果进一步说明由多个DNA片段组合的质粒已经构建成功。

a 4个DNA片段与pS300质粒连接的结构与酶切位点示意图;b 构建完成后的质粒酶切电泳情况。泳道1 DNA ladder;泳道2 SsAggl knockout plasmid;泳道3 Pvu II酶切;泳道4 Nde I酶切;泳道5 Pvu II和Nde I双酶切。
为验证构建的质粒中各个外源DNA片段的连接是否正确,进一步对knockout plasmid质粒进行测序分析。步移测序分析结果显示:线性化pS300质粒的3端(G418–F引物上的同源序列)与G418抗性基因的5端成功连接(图7–a,测序结果为反向互补序列);下一个连接点的测序峰图结果显示G418抗性基因3端与左同源臂的5端连接正确(图7–b);左同源臂3端与Hyg抗性基因5端成功正确连接(图7–c);Hyg抗性基因的3端与右同源臂的5端成功正确连接(图7–d);右同源臂的3端也与pS300 5端重组位置一致(图7–e)。测序结果的连接处序列与表1中各个DNA片段头、尾处的50 bp重叠序列的碱基均一致,说明连接方向为pS300 3→5G418抗性基因3→ 5左同源臂3→5Hyg抗性基因3→5右同源臂3→pS300 5'的树干毕赤酵母基因敲除载体质粒构建成功。

a 线性化pS300 3'与G418抗性基因5'端的连接点(反向互补序列);b G418抗性基因3'端与Aggl左同源臂5'端的连接点;c Aggl左同源臂3'端与Hyg抗性基因5'端的连接点;d Hyg抗性基因3'和Aggl右同源臂5'端的连接点;e Aggl右同源臂3'和pS300 5'端的连接点。彩色粗线段标记的是引物重叠序列。
3 结论与讨论
本研究中,以构建树干毕赤酵母基因的敲除载体为例,利用酿酒酵母活体细胞重组系统,一次性将多个外源DNA片段和线性化质粒重组形成环状质粒,用该方法构建多片段质粒的阳性酵母菌落中,大部分能够形成正确重组连接的质粒,而少数阳性菌落含有错误连接。这些错误质粒仅连接了G418抗性基因片段,可能是由于非同源末端连接修复(NHEJ)引起的[14]。虽然最终转化有少数错误的质粒,但是这种多片段质粒的构建方法仍是非常简便而高效的。在笔者多次用不同的多片段构建质粒的试验中(相关数据未在本文中显示),阳性克隆的正确率均在50%以上,且只要适当增加阳性菌落的检测数量,即可从中获得正确组装的重组质粒。
本试验介绍的多片段质粒构建方法包含3个主要步骤:1)含50 bp重叠序列的引物的设计;2)外源DNA片段的制备和酿酒酵母转化;3)阳性酵母菌落的鉴定。这一过程只需3 d时间。可见,本试验描述的多片段质粒构建方法的成功率和效率都相对较高。由于本方法属于同源重组,片段之间还可以实现“无缝”连接或者按需求添加酶切位点。虽然克隆单一外源片段的商业化无缝克隆试剂盒效果相对稳定,但是面对多片段质粒构建时用此类试剂盒仍然需要分步进行、多次克隆才能实现,构建周期大幅增加。细菌Red/ET重组方法也需要大约50 bp的重叠序列,且需要预先在宿主菌中协同高效表达重组系统相关的酶(Redα/Redβ 或RecE/RecT等)[15],相对本方法的材料要求更高。而Gateway技术只能在特定序列位点进行重组[16],难以用于有序的多片段组装:因此,本研究的多片段质粒构建方法相对更为简便而高效,可以广泛用于构建各种复杂片段或载体质粒。
[1] 胡蓉,汪慧慧,刘勇,等.甘蓝型油菜基因在拟南芥中的种子特异性表达及过表达分析[J].湖南农业大学学报(自然科学版),2021,47(1):17–22.
[2] MAGNANI E,BARTLING L,HAKE S.From Gateway to MultiSite Gateway in one recombination event[J].BMC Molecular Biology,2006,7:46.
[3] MARESCA M,ERLER A,FU J,et al.Single-stranded heteroduplex intermediates inλred homologous recombination[J].BMC Molecular Biology,2010,11:54.
[4] 付喜爱,张德显,周维,等.细菌λ Red重组技术的应用及其影响因素[J].动物医学进展,2015,36(1):91–95.
[5] KROGH B O,SYMINGTON L S.Recombination proteins in yeast[J].Annual Review of Genetics,2004,38:233–271.
[6] 胡翰,于宾宾,何启盖.猪β防御素2成熟肽在酵母中的表达[J].微生物学报,2011,51(5):704–709.
[7] RUNGUPHAN W,KEASLING J D.Metabolic engineering offor production of fatty acid-derived biofuels and chemicals[J].Metabolic Engineering,2014,21:103–113.
[8] 陈向岭,袁汉英,何炜,等.通过同源重组构建酿酒酵母新型表达质粒[J].中国科学C辑:生命科学,2005,35(1):37–43.
[9] FANG F,SALMON K,SHEN M W Y,et al.A vector set for systematic metabolic engineering in[J].Yeast,2011,28(2):123–136.
[10] KUIJPERS N G A,SOLIS-ESCALANTE D,BOSMAN L,et al.A versatile,efficient strategy for assembly of multi-fragment expression vectors inusing 60 bp synthetic recombination sequences[J].Microbial Cell Factories,2013,12:47.
[11] GIETZ R D,SCHIESTL R H.High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method[J].Nature Protocols,2007,2(1):31–34.
[12] LIU Y Y,CHEN J,CHENG Y,et al.A simple and rapid technique of template preparation for PCR[J].Frontiers in Microbiology,2022,13:1024827.
[13] 王世伟,李旭业,张伟伟.优化感受态细胞制备方法提高转化效率的研究[J].齐齐哈尔大学学报(自然科学版),2009,25(2):86–90.
[14] CHEN S Y,LEE L D,NAILA T,et al.Structural basis of long-range to short-range synaptic transition in NHEJ[J].Nature,2021,593:294–298.
[15] MURPHY K C.λ recombination and recombineering[J]. EcoSal Plus,2016,7(1),dio:10.1128/ecosalplus.ESP-0011-2015.
[16] KARIMI M,INZÉ D,DEPICKER A.GATEWAY™ vectors for-mediated plant transformation[J]. Trends in Plant Science,2002,7(5):193–195.
Construction of multi-fragments plasmid based on
TANG Yaping,CHENG Yi,WANG Tuhong,CHEN Jia,GAO Chunsheng,GUO Litao,SONG Zhiqiang,TANG Chao,YAN Zhun,LI Zhimin*
(Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha, Hunan 410205, China)
To enhance the efficiency of multi-fragment plasmid construction and overcome the limitations of current techniques, this study introduced a method that utilized the recombination system withinliving cell. This approach enabled the simultaneous integration of multiple exogenous DNA fragments with linearized plasmid into a circular plasmid, using the construction of an-gene knockout vector foras an example. The method involved designing primers to introduce 50 bp overlapping sequences between interconnected DNA fragments, followed by PCR amplifying of these fragments. Subsequently, the linearized plasmids were co-transformed with the DNA fragments intocells. Validation of the plasmids accuracy was then performed in positive yeast colonies through PCR and sequencing. This method offers a high level of precision and considerably reduces the time required for constructing multi-fragments plasmids.
vector construction; multi-fragments plasmid; yeast homologous recombination system
Q782
A
1007–1032(2023)04–0421–07
10.13331/j.cnki.jhau.2023.04.007
2022–12–09
2023–07–24
中国农业科学院科技创新工程(ASTIP–IBFC–04);湖南省自然科学基金项目(2015JJ3128);湖南省植保植检站植物防疫防控科研项目(HNZB202104)
汤雅萍(1997—),女,湖北武汉人,硕士研究生,主要从事作物黑粉病研究,82101205263@caas.cn;*通信作者,李智敏,博士,副研究员,主要从事谷类作物真菌病害研究,lizhimin@caas.cn
汤雅萍,程毅,王吐虹,陈佳,高春生,郭利桃,宋志强,唐超,严准,李智敏.基于酿酒酵母的多片段质粒的构建[J].湖南农业大学学报(自然科学版),2023,49(4):421–427.
TANG Y P,CHENG Y,WANG T H,CHEN J,GAO C S,GUO L T,SONG Z Q,TANG C,YAN Z,LI Z M.Construction of multi-fragments plasmid based on[J].Journal of Hunan Agricultural University(Natural Sciences),2023,49(4):421–427.
http://xb.hunau.edu.cn

责任编辑:毛友纯
英文编辑:柳正

