牛卵泡颗粒细胞CART与候选受体的分子对接及其功能
郝琴琴,任静,成俊丽,朱芷葳,许冬梅,贾雪纯,李鹏飞
牛卵泡颗粒细胞CART与候选受体的分子对接及其功能
郝琴琴,任静,成俊丽,朱芷葳,许冬梅,贾雪纯,李鹏飞*
(山西农业大学生命科学学院,山西 太谷 030801)
通过同源建模预测牛卵泡颗粒细胞(GCs)可卡因–苯丙胺转录肽(CART)与候选受体ZMPSTE24的三维结构,运用分子对接技术分析二者的结合模式,探究其分子互作关系;选取3头健康成年母牛,分离GCs,转染、、、2沉默序列,提取总RNA,并采用qRT–PCR检测TEDDM1、AGTR2、CMKLR1、ZMPSTE24等4个候选受体沉默后mRNA的相对表达量;采用CCK–8法测定各试验组和对照组GCs增殖情况;采用ELISA法检测各组培养液中雌激素(E2)的质量浓度,研究此4个候选受体在牛卵泡GCs中的功能。结果表明:ZMPSTE24与CART存在1个结合位点、9个盐桥、17个氢键;4个候选受体试验组的mRNA相对表达量均极显著(<0.01)低于siNC组和空白组的,表明、、、在GCs中沉默效果良好;、、、沉默后,各试验组的细胞增殖率和培养液中E2质量浓度均极显著(<0.01)低于阳性对照组(不加CART)的。可见,4个候选受体基因沉默后,CART对GCs增殖和E2分泌仍具有抑制作用。
牛;卵泡颗粒细胞;CART候选受体;分子对接
牛是单胎动物,通常1个发情期内有2~3个卵泡波,最终仅有1个优势卵泡发育成熟并释放卵子:因此,排卵卵泡的数量和质量直接影响优良种畜扩繁及胚胎工程技术的应用[1–3]。KOBAYASHI等[4]研究发现,可卡因–苯丙胺转录肽(CART)通过下丘脑–垂体–卵巢轴直接作用于牛卵泡颗粒细胞(GCs),抑制促卵泡素(FSH)介导的雌激素(E2)分泌、cAMP表达,对牛卵泡发育起显著负调控作用,是抑制卵泡优势化的重要因子。对CART受体的研究,对单胎家畜良种扩繁和胚胎移植技术的应用具有重要意义。对提高母牛繁殖性能的研究[5–6]大多集中于超数排卵技术的应用,该技术主要在母牛发情期间,通过皮下注射FSH,使卵巢上多个卵泡发育成熟,并利用人工授精和胚胎移植技术实现优良种畜扩繁,但其在养殖户中难以普及。前期对影响牛繁殖性能的卵泡生长发育和闭锁机理进行了探究,发现GCs中的CART影响卵泡发育,且证实了其功能[7–9]。然而,由于CART受体立体结构复杂,抽提后蛋白质活性难以保留且易表达重组蛋白,致使牛卵泡GCs中CART的受体至今仍未被明确。VICENTIC等[10]研究发现,125I–CART61–102能与AtT20细胞特异性结合;LAKATOS等[11]认为,CART55–102可通过G蛋白偶联受体(GPCRs)介导AtT20胞外信号调节激酶(ERK)通路,表明AtT20细胞内存在CART受体;NAGELOVÁ等[12]研究发现,125I–CART61–102在低浓度下能与大鼠肾上腺嗜铬细胞瘤PC12细胞发生特异性结合。相比于超数排卵技术,通过研究CART受体,厘清牛卵泡发育机制,进而提高排卵率的方法具有成本低、效果好、风险低等优点。李鹏飞[13]通过转录组测序、蛋白质组学分析及同源建模等将跨膜附睾蛋白1(TEDDM1)、血管紧张素Ⅱ受体–2型(AGTR2)、趋化因子样受体1(CMKLR1)作为CART候选受体;成俊丽等[14]通过膜蛋白抽提、亲和免疫层析和Label–free蛋白质组学等技术将ZMPSTE24)作为CART候选受体,但ZMPSTE24与CART的结合关系及所有候选受体的具体功能尚不明确。本研究中,通过同源建模和分子对接技术分析ZMPSTE24与CART的互作关系,并运用RNA干扰(RNAi)技术对、、2、在牛卵泡GCs中的功能进行探讨,初步分析其对卵泡生长发育的调控作用,以期为改善母牛繁殖性能提供依据。
1 材料与方法
1.1 试验动物及样品采集
选取3头12月龄健康西门塔尔母牛(来自山西省文水县肉牛屠宰场),屠宰后摘取双侧卵巢,置于4 ℃预冷磷酸盐缓冲液(DPBS)中,采集GCs。
1.2 方法
1.2.1同源建模和分子对接
在NCBI数据库中分别获取ZMPSTE24与CART的氨基酸序列,运用Discovery Studio 2019中PDB_nr95分别对二者氨基酸序列进行BLAST比对,运用MODELER搜索相似性高的X衍射晶体结构作为三维结构模型,绘制拉氏构象进行蛋白模型质量评估。
在ZDOCK中分别提交ZMPSTE24和CART的PDB文件,将RMSD Cutoff设置为6.0,Interface Cutoff设置为9.0,Maximum Number of Clusters设置为60,进行对接计算,获取ZMPSTE24和CART的初步结合构象;运用Gromacs 2019进行动力学模拟。
1.2.2GCs分离及小干扰RNA(siRNA)细胞转染
分离卵巢中直径>5 mm的卵泡,经无菌DPBS清洗后置于盛有DPBS的无菌培养皿中,刮取内壁GCs,将DPBS和GCs的混合溶液转移至离心管中,1400 r/min离心7 min,弃上清,获取GCs,于体外培养。当细胞密度达到80%~90%时,将GCs接种于6孔板培养,每48 h更换一次培养液,培养120 h后,参照RAW siRNA转染试剂说明书进行转染。si、si、si、si和si序列由生工生物工程(上海)股份有限公司设计合成,具体序列列于表1。

表1 siRNA细胞转染所用siRNA序列
1.2.3总RNA提取与反转录及qRT–PCR反应
采用Trizol法提取各组细胞总RNA,运用核酸蛋白定量仪测定总RNA纯度及浓度,合格后参照RT Reagent Kit With gDNA Eraser说明书进行反转录。20 μL反应体系:总RNA 10 μL、RT Primer Mix 1 μL、Primer Script RT Enzyme Mix I 1 μL、5×Primer Script Buffer 2(for Real time) 4 μL、RNase–Free ddH2O 4 μL。
从NCBI数据库中获取牛、、、的mRNA核酸序列,运用Primer 3.0在线设计特异性引物,交由生工生物工程(上海)股份有限公司合成,具体序列列于表2。采用qRT–PCR检测各候选受体沉默后mRNA的相对表达量。每个候选受体分别设1个试验组,2个对照组(空白组和siNC组),每组重复3次。以牛为内参基因,建立10 μL反应体系:cDNA 1 μL、上游及下游引物各0.4 μL、SYBR®Premix ExⅡ 5 μL、ddH2O 3.2 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,循环40次。
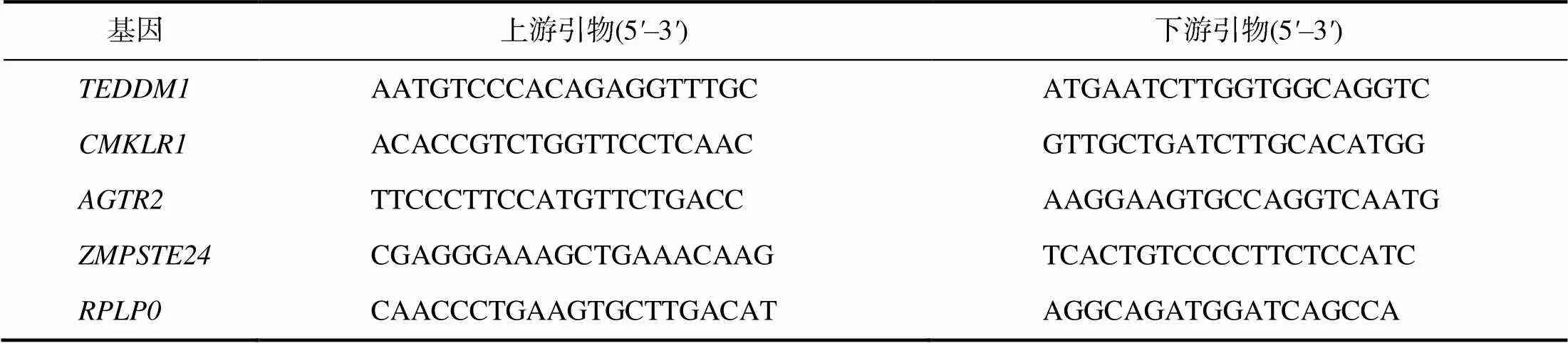
表2 qRT–PCR检测引物序列
1.2.4GCs增殖率与E2质量浓度的测定
设4个试验组(si组、si组、si组和si组)和4个对照组(空白组、RFect组、siNC组和阳性组),每组重复3次。于96孔板中进行培养,每孔中加入100 μL各组细胞悬浮液,37 ℃、5% CO2培养箱放置24 h后,参照CCK–8试剂盒说明书操作,采用酶标仪测定各组450 nm值,计算细胞增殖率。将各组细胞培养液3000 r/min离心15 min,取100 μL上清,采用ELISA试剂盒进行测定。运用ELISACalc,以标准品5000、2500、1000、500、250、0 pg/mL为横坐标,450 nm值为纵坐标拟合标准曲线,计算各组E2质量浓度。
1.2.5统计学分析
采用2–ΔΔCt法计算各基因在牛卵泡GCs中的mRNA相对表达量,以为内参基因均一化表达水平,各基因相对表达量为2–ΔΔCt;每个试验重复3次,运用GraphPad Prism 8.0对所有结果进行检验分析。
2 结果与分析
2.1 CART和ZMPSTE24模型构建结果
运用Discovery Studio 2019分别对受体ZMPSTE24和配体CART进行同源建模。结果显示,ZMPSTE24与蛋白CAAX prenyl protease 1(PDB ID为5syt)氨基酸序列一致性达91.3%,符合建模一致性大于30%的条件:因此,以CAAX prenyl protease 1为模板建模,ZMPSTE24的立体结构如图1–a所示。CART与蛋白Phosphoribosy lanthranilate isomerase(PDB ID为1v5x)的氨基酸序列一致性为47%:因此,以该蛋白为模板进行建模,CART的立体结构如图1–b所示。
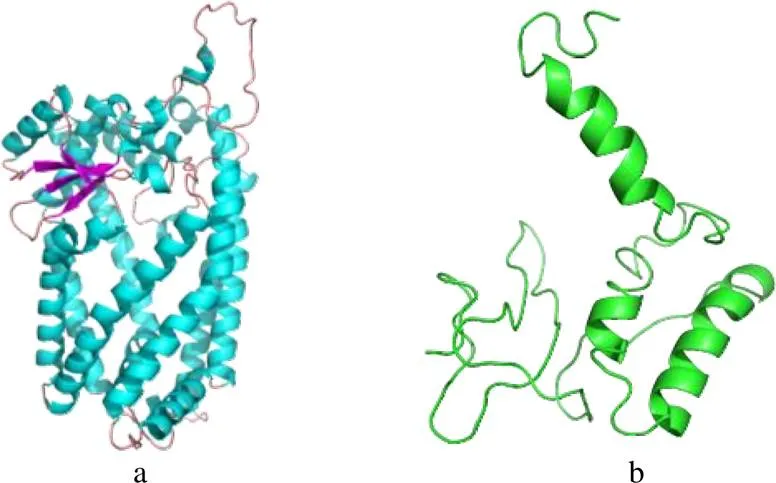
a、b 分别为ZMPSTE24和CART。
2.2 CART和ZMPSTE24模型评价结果
ZMPSTE24拉式构象(图2–a)显示,97.82%的氨基酸残基位于允许区(绿色区域),数值大于90%,符合立体化学能量规则,表明该模型合理;CART拉式构象(图2–b)显示,91.82%的氨基酸残基位于允许区,表明该模型可靠,可进行分子对接计算。
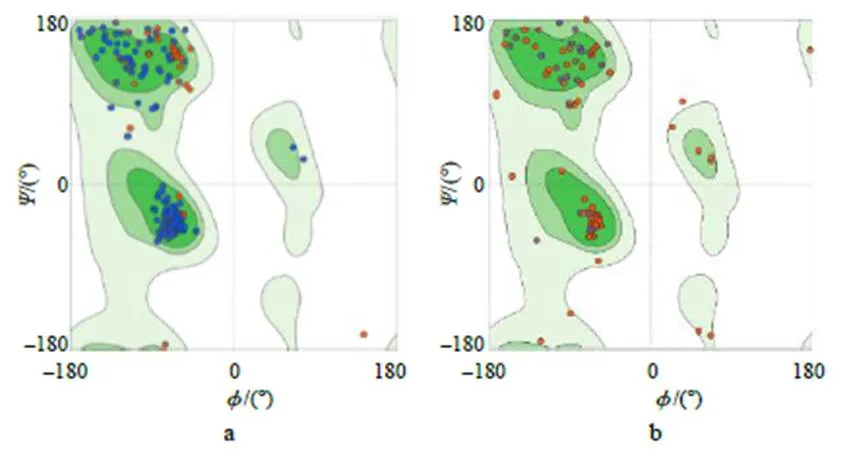
a、b 分别为ZMPSTE24和CART。
2.3 ZMPSTE24与CART分子对接结果
对ZMPSTE24与CART对接的复合体(图3)进行优化,结果显示,均方根偏差(RMSD)曲线变化趋于稳定(图4),表明复合体结构已达到理想状态,可进行对接分析。分析ZMPSTE24与CART的互作关系,结果显示:ZMPSTE24与CART存在1个结合位点、9个盐桥、17个氢键;结合部位CART(配体)的接触面积、极性接触面积、非极性接触面积分别为5.116 8、3.114 8、2.004 8 nm2,ZMPSTE24(受体)的接触面积、极性接触面积、非极性接触面积分别为5.236 6、2.890 3、2.346 2 nm2,表明ZMPSTE24可能为CART受体。

紫色示CART;绿色示ZMPSTE24。
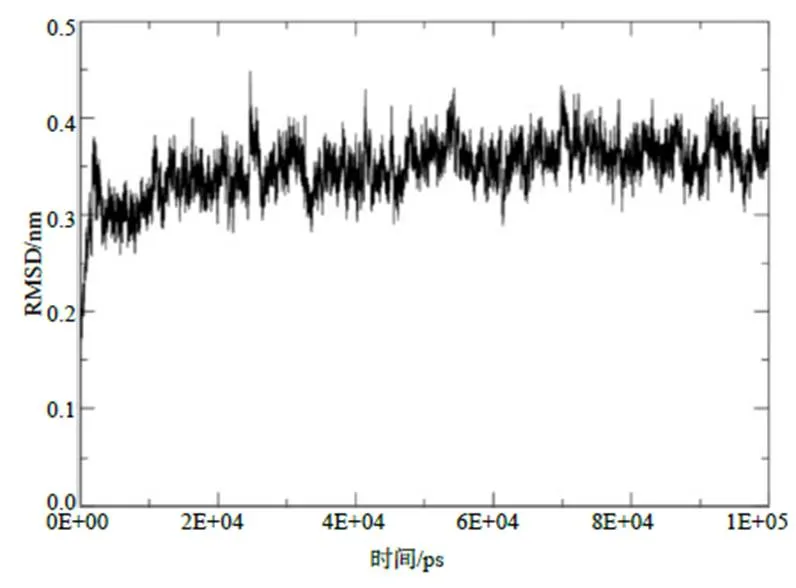
图4 CART–ZMPSTE24复合体的RMSD曲线
2.4 CART候选受体转染siRNA后mRNA的相对表达情况
图5显示,4个候选受体试验组的mRNA相对表达量均极显著(<0.01)低于siNC组和空白组的,siNC组和空白组mRNA的相对表达量间的差异无统计学意义(>0.05),这与预期的结果一致,表明、、、在GCs中沉默效果良好。

“**”示与对照组和siNC组相比差异有统计学意义(P<0.01)。
2.5 CART候选受体对GCs增殖的影响
从图6可知,各试验组细胞增殖率极显著(<0.01)低于阳性对照组,与空白对照组、siNC组、RFect组的组间差异无统计学意义(>0.05),表明、、、沉默后细胞增殖率变化不显著。
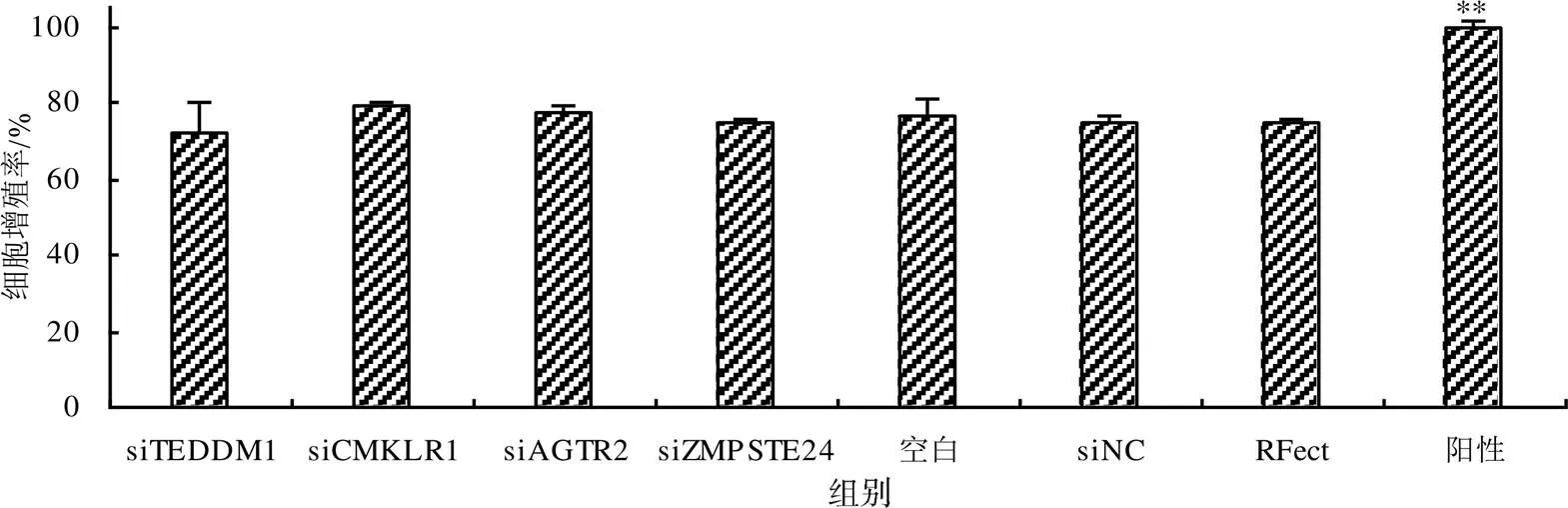
“**”示阳性对照组与其他组相比差异有统计学意义(P<0.01)。
2.6 CART候选受体对GCs中E2分泌的影响
E2质量浓度分析结果(图7)显示,不加CART的阳性对照组E2质量浓度极显著(<0.01)高于si、si、si、si组,各试验组E2质量浓度与空白对照组、siNC组、RFect组间的差异无统计学意义(>0.05),表明各候选受体沉默后培养液E2的质量浓度无显著变化。
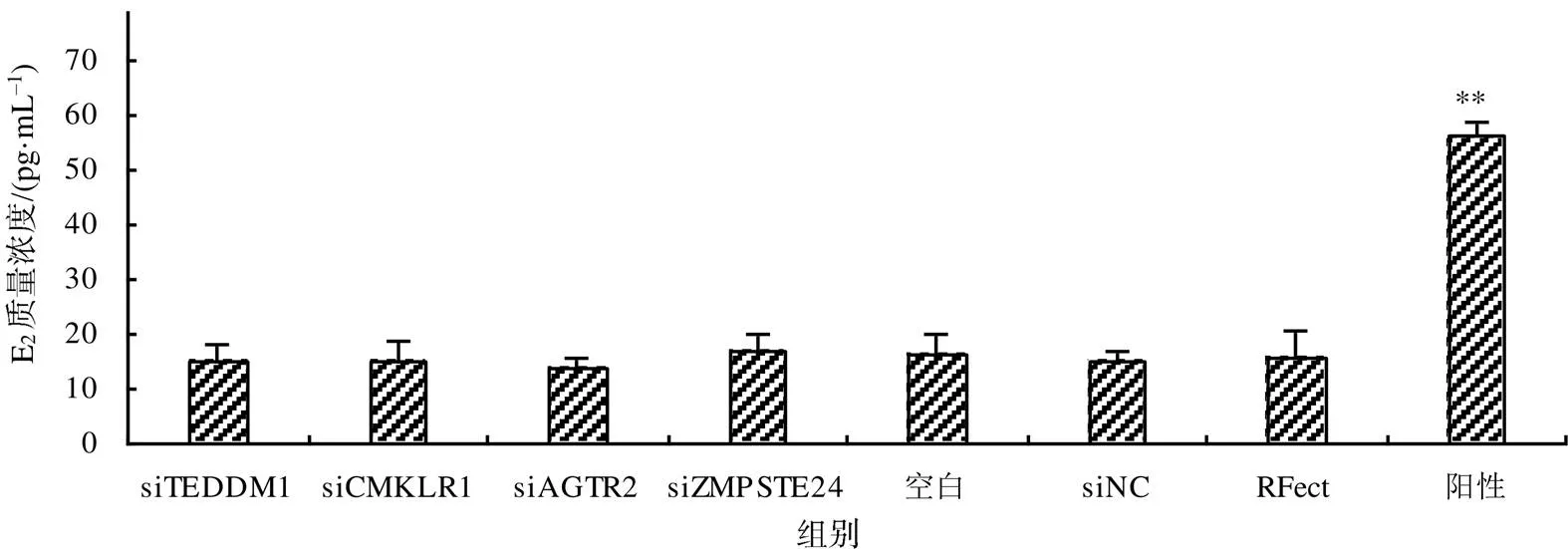
“**”示阳性对照组与其他组相比差异有统计学意义(P<0.01)。
3 结论与讨论
本研究中,采用RNAi技术将CART候选受体、、、沉默后,CART对GCs增殖和E2分泌仍具有抑制作用。TEDDM1、AGTR2是7次跨膜螺旋的GPCRs。GPCRs胞内区域募集的G蛋白、第二信使等下游信号分子,主要通过cAMP信号通路、磷脂酰肌醇信号通路参与体内的多种生理活动[15]。研究表明,褪黑素(Mel)可抑制人卵巢颗粒细胞的凋亡和水牛卵母细胞cAMP的合成[16–17],在体外成熟过程中补充Mel可以促进猪低品质卵母细胞的成熟,提高其囊胚率[18],Mel还可促进牛、水牛卵母细胞体外成熟及胚胎体外发育[19–20]。这些发现表明Mel可能与TEDDM1、AGTR2存在颉颃作用,从而导致两者在牛卵泡GCs中的功能未被检测出来。后续可进一步在培养液中添加Mel,探究TEDDM1、AGTR2在牛卵泡GCs中的功能。蛋白翻译后的修饰有磷酸化和糖基化等方式,CMKLR1分子中存在4个O–糖基化位点、1个N–糖基化位点和50个磷酸化位点[14],推测磷酸化是CMKLR1蛋白翻译后的主要修饰方式,而磷酸化影响细胞周期,进而影响CMKLR1基因功能表达鉴定。ZMPSTE24是1种金属蛋白酶,广泛分布于哺乳动物组织,其蛋白结构中包含1个锌结合位点、1个三联氨基酸残基部分和GPCRs家族标志[21]。目前对ZMPSTE24的功能研究较少,本研究未检测出其对牛卵泡GCs的影响,分析其原因可能为ZMPSTE24在卵泡GCs中表达量较少。
CART属于下丘脑神经肽,其受体为典型GPCRs,在动物体内能够调节摄食、参与神经疼痛、调控卵泡发育等。基于相关神经肽受体研究方法,研究人员对CART受体展开探究。ABRAHAM等[22]利用免疫组化技术共定位发现,CART和CCK–1受体在大鼠大脑中与动物摄食相关的伏隔核吻侧部、杏仁核基底部侧复合体显著表达,在缺乏CCK–1受体导致的肥胖大鼠和正常大鼠的以上区域中CART免疫反应比较发现,缺乏CCK–1受体的肥胖大鼠的免疫反应强度显著降低,推测CART可能与CCK–1受体相互作用,调控动物摄食。YOSTEN等[23]对坐骨神经慢性收缩(DH–SC)神经性疼痛大鼠的脊髓背角进行RNA测序,发现GPR160是差异表达最大的转录本;利用免疫组化和免疫共沉淀技术发现CART与GPR160存在相互作用,通过大鼠静脉注射GPR160抗体,结果显示激酶ERK和CREB的磷酸化减弱,表明CART诱导大鼠DH–SC中GPR160介导的ERK/CREB信号通路,促进机械过敏反应发生。本研究中,采用RNAi技术对CART候选受体功能进行研究。该方法主要通过人工合成靶基因序列的dsRNA,转染细胞后诱导对应序列mRNA特异性降解,致使特定基因表达缺失,具有高效、简便、特异性强等特点,已被证明是目前研究哺乳动物基因功能的有效方法[24–25]。本研究中,从转录水平上分析CART候选受体在牛卵泡GCs中的功能,、、、沉默后,CART仍抑制GCs增殖和E2分泌,也可能是此4个候选受体本身表达丰度低,致使沉默后所起作用效果不显著。鉴于CART受体结构的复杂性,利用过表达、肽段合成等技术进行配体–受体结合分析具有一定困难[26],后续可采用X射线晶体衍射和荧光共振能量转移等技术对CART受体进行深入研究。
[1] RAJAKOSKI E.The ovarian follicular system in sexually mature heifers with special reference to seasonal,cyclical,end left-right variations[J].Acta Endocrinologica.Supplementum,1960,34(Suppl 52):1–68.
[2] ZHOU J W,PENG X W,MEI S Q.Autophagy in ovarian follicular development and atresia[J].International Journal of Biological Sciences,2019,15(4):726–737.
[3] 李华振,储明星.基因调控哺乳动物繁殖性能的研究进展[J].中国草食动物科学,2021,41(3):48–53.
[4] KOBAYASHI Y,JIMENEZ-KRASSEL F,IRELAND J J,et al.Evidence of a local negative role for cocaine and amphetamine regulated transcript(CART),inhibins and low molecular weight insulin like growth factor binding proteins in regulation of granulosa cell estradiol produ- ction during follicular waves in cattle[J].Reproductive Biology and Endocrinology,2006,4:22.
[5] WU B,ZAN L.Enhance beef cattle improvement by embryo biotechnologies[J].Reproduction in Domestic Animals,2012,47(5):865–871.
[6] KANITZ W,BECKER F,SCHNEIDER F,et al. Superovulation in cattle:practical aspects of gonadotropin treatment and insemination[J].Reproduction,Nutrition,Development,2002,42(6):587–599.
[7] LV L H,JIMENEZ-KRASSEL F,SEN A,et al. Evidence supporting a role for cocaine- and amphetamine- regulated transcript(CARTPT) in control of granulosa cell estradiol production associated with dominant follicle selection in cattle[J].Biology of Reproduction,2009,81(3):580–586.
[8] SEN A,BETTEGOWDA A,JIMENEZ-KRASSEL F,et al.Cocaine- and amphetamine-regulated transcript regulation of follicle-stimulating hormone signal transdu- ction in bovine granulosa cells[J].Endocrinology,2007,148(9):4400–4410.
[9] LI P F,MENG J Z,ZHU Z W,et al.Detection of genes associated with follicle development through transcriptome analysis of bovine ovarian follicles GCs[J].Current Bioinformatics,2018,13(2):127–140.
[10] VICENTIC A,LAKATOS A,KUHAR M J.CART (cocaine- and amphetamine-regulated transcript) peptide receptors:specific binding in AtT20 cells[J].European Journal of Pharmacology,2005,528(1/2/3):188–189.
[11] LAKATOS A,PRINSTER S,VICENTIC A,et al. Cocaine- and amphetamine-regulated transcript(CART) peptide activates the extracellular signal-regulated kinase (ERK) pathway in AtT20 cells via putative G-protein coupled receptors[J].Neuroscience Letters,2005,384(1/2):198–202.
[12] NAGELOVÁ V,PIRNÍK Z,ŽELEZNÁ B,et al.CART (cocaine- and amphetamine-regulated transcript) peptide specific binding sites in PC12 cells have characteristics of CART peptide receptors[J].Brain Research,2014,1547:16–24.
[13] 李鹏飞.牛卵泡可卡因–苯丙胺调节转录肽(CART)受体的筛选[D].太谷:山西农业大学,2014.
[14] 成俊丽,郝庆玲,侯淑宁,等.牛卵泡颗粒细胞CART相互作用蛋白鉴定及受体筛选[J].畜牧兽医学报,2020,51(12):3046–3056.
[15] AUDET M,BOUVIER M.Restructuring G-protein- coupled receptor activation[J].Cell,2012,151(1):14–23.
[16] WOO M M,TAI C J,KANG S K,et al.Direct action of melatonin in human granulose-luteal cells[J].The Journal of Clinical Endocrinology and Metabolism,2001,86(10):4789–4797.
[17] 郭振伟.褪黑素对水牛卵母细胞体外成熟的影响及其机制的探究[D].南宁:广西大学,2016.
[18] YANG L,WANG Q K,CUI M S,et al.Effect of melatonin on the in vitro maturation of porcine oocytes,development of parthenogenetically activated embryos,and expression of genes related to the oocyte developmental capability[J].Animals,2020,10(2):209.
[19] TIAN X Z,WANG F,HE C J,et al.Beneficial effects of melatonin on bovine oocytes maturation:a mechanistic approach[J].Journal of Pineal Research,2014,57(3):239–247.
[20] LIN T,LEE J E,KANG J W,et al.Melatonin supplementation during prolonged in vitro maturation improves the quality and development of poor-quality porcine oocytes via anti-oxidative and anti-apoptotic effects[J].Molecular Reproduction and Development,2018,85(8/9):665–681.
[21] 郝庆玲.牛卵泡颗粒细胞CART受体的鉴定[D].太谷:山西农业大学,2021.
[22] ABRAHAM H,COVASA M,HAJNAL A.Cocaine- and amphetamine-regulated transcript peptide immunore- activity in the brain of the CCK-1 receptor deficient obese OLETF rat[J].Experimental Brain Research,2009,196(4):545–556.
[23] YOSTEN G L,HARADA C M,HADDOCK C,et al. GPR160 de-orphanization reveals critical roles in neuropathic pain in rodents[J].The Journal of Clinical Investigation,2020,130(5):2587–2592.
[24] BRIOSCHI M,BANFI C.The application of gene silencing in proteomics:from laboratory to clinic[J]. Expert Review of Proteomics,2018,15(9):717–732.
[25] GEBERT M,JAŚKIEWICZ M,MOSZYŃSKA A,et al.The effects of single nucleotide polymorphisms in cancer RNAi therapies[J].Cancers,2020,12(11):3119–3138.
[26] 杨振霖,吴蓓丽.G蛋白偶联受体的结构研究与药物研发[J].科学通报,2018,63(14):1361–1373.
Molecular docking and functions of interaction between CART and candidate receptors in bovine follicular granulosa cells
HAO Qinqin,REN Jing,CHENG Junli,ZHU Zhiwei,XU Dongmei,JIA Xuechun,LI Pengfei*
(College of Life Sciences, Shanxi Agricultural University, Taigu, Shanxi 030801, China)
The three-dimensional structure of Cocaine Amphetamine Transcription Peptide(CART) and the candidate receptor ZMPSTE24 in bovine follicular granulosa cells(GCs) were predicted using homologous modeling. The binding mode between these two molecules was analyzed through Macromolecular docking technology to explore their molecular interactions. Follicular GCs were isolated from three healthy adult cows and transfected with silenced sequences for,,and. Total RNA was extracted, and qRT-PCR was employed to assess the relative mRNA expression after silencing the four candidate receptors(TEDDM1, AGTR2, CMKLR1 and ZMPSTE24). The proliferation of GCs in both experimental and control groups was evaluated using the CCK-8 method. Additionally, the mass concentration of estrogen(E2) in the culture medium of each group was determined using the ELISA method, aiming to investigate the functions of these four candidate receptors in bovine follicular GCs. The results revealed one binding site, nine salt bridges, and seventeen hydrogen bonds between ZMPSTE24 and CART. The relative mRNA expression levels of the four candidate receptor test groups were significantly(<0.01) lower than those of the siNC group and blank group, confirming effective silencing of,,andin GCs. Following the silencing of,,and, the cell proliferation rate and E2mass concentration in the culture medium of each experimental group were significantly(<0.01) reduced compared to the positive control group(without CART). These findings indicated that even after the silencing of the four candidate receptor genes, CART continues to exert inhibitory effects on GCs proliferation and E2secretion.
bovine; follicular granulosa cells; CART candidate receptor; molecular docking
S823.3
A
1007–1032(2023)04–0461–07
10.13331/j.cnki.jhau.2023.04.013
2022–03–19
2023–08–06
国家自然科学基金项目(31873002);山西省应用基础研究计划面上项目(20210302123380);山西省现代农业产业技术体系建设专项
郝琴琴(1996—),女,山西翼城人,硕士研究生,主要从事动物生殖生理研究,1571934599@qq.com;*通信作者,李鹏飞,博士,教授,主要从事动物生殖生理研究,adamlpf@126.com
郝琴琴,任静,成俊丽,朱芷葳,许冬梅,贾雪纯,李鹏飞.牛卵泡颗粒细胞CART与候选受体的分子对接及其功能[J].湖南农业大学学报(自然科学版),2023,49(4):461–467.
HAO Q Q,REN J,CHENG J L,ZHU Z W,XU D M,JIA X C,LI P F.Molecular docking and functions of interaction between CART and candidate receptors in bovine follicular granulosa cells[J].Journal of Hunan Agricultural University(Natural Sciences),2023,49(4):461–467.
http://xb.hunau.edu.cn

责任编辑:邹慧玲
英文编辑:柳正

