沙棘果油对超抗原诱导的特应性皮炎小鼠激素抵抗的干预作用及机制Δ
王欣欣 ,陈小艳 ,李思佳 ,张文莲 ,王 昆 ,窦德强 (1.辽宁中医药大学药学院,辽宁 大连 116600;.包头医学院基础医学与法医学院,内蒙古 包头 01060;.应急总医院病理科,北京 10008;.辽宁中医药大学中医学院,沈阳 11087;5.包头医学院第一附属医院病理科,内蒙古 包头 01010)
特应性皮炎(atopic dermatitis,AD)是儿童常见的皮肤炎症性疾病,病情迁延,容易复发。在全球范围内,AD 的发病率均表现出逐年上升的趋势[1—2]。针对我国儿童和青少年群体进行的第3次全国范围内流行病学调查显示,AD患病率已从1998年的0.69%上升到2014年的12.94%[3]。多国治疗指南均推荐外用糖皮质激素(glucocorticoid,GC)为AD局部治疗的一线药物[4—5]。然而,一些患者在外用GC治疗时,随着治疗时间延长会出现激素抵抗,影响治疗效果[6]。因此,寻找安全有效的替代或补充治疗方法,干预AD 治疗时的激素抵抗具有重要的公共卫生意义。超抗原(superantigen,SAg)是一类来源于细菌或病毒的蛋白质,其不需要抗原呈递细胞加工,可以直接高效地激活免疫细胞[7]。且有研究表明,AD 患者皮损局部异常定植的金黄色葡萄球菌产生的SAg参与了激素抵抗的发生[8—9]。
中药沙棘是植物沙棘HippophaerhamnoidesL.的干燥成熟果实,自古就被蒙医、藏医及中医用于皮肤疾病的治疗。沙棘果油是从沙棘果实中提取的重要生物活性物质,具有抗炎、抗氧化、免疫调节等作用[10—11]。本课题组前期研究发现,沙棘果油可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路调节AD小鼠的免疫应答,改善Th1/Th2失衡,回调皮损局部皮肤屏障功能的蛋白表达,修复皮肤屏障[12]。本研究拟在前期研究的基础上,利用AD 模型深入分析沙棘果油对SAg诱导的小鼠AD激素抵抗的干预作用及相关机制,为从天然产物中寻找AD 激素抵抗的干预措施提供参考。
1 材料
1.1 主要仪器
本研究所用仪器主要包括:ASP6025型全自动组织脱水机、EG1150H eagle 型包埋机、RM2235 型组织切片机(德国Leica公司),BSZY23S-Y型电子天平(北京赛多利斯仪器系统有限公司),2800UV/VIS型紫外分光光度仪[尤尼柯(上海)仪器有限公司],Biofuge primo R 型低温高速离心机(美国Thermo Fisher Scientific 公司),ESP200型电泳仪、4200SF型凝胶成像分析系统(上海天能科技有限公司)。
1.2 主要药品与试剂
沙棘果油(批号GR-134-161229)购自辽宁东宁生物药业有限公司,主要成分为脂肪酸(主要包括油酸33.10%、棕榈油酸27.52%、软脂酸26.87%)、谷甾醇和β-胡萝卜素;2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB,批号BCCC2721,纯度≥99%)购自美国Sigma公司;地塞米松片(批号200311,规格0.75 mg/片)购自广东南国药业有限公司;兔源糖皮质激素受体α(glucocorticoid receptor alpha,GRα)抗体、兔源GRβ 抗体、兔源G蛋白抑制性α 亚单位1(G protein inhibitory subunit 1,Gαi1)抗体、兔源Gαi3 抗体、兔源核糖体蛋白S6 激酶1(ribosomal protein S6 kinase 1,S6K1)抗体、兔源磷酸化S6K1(phosphorylated S6K1,p-S6K1)抗体、兔源蛋白激酶B1/2(protein kinase B,AKT1/2)抗体、兔源磷酸化AKT(phosphorylated AKT,p-AKT)抗体、兔源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号分别为ab2768、ab233165、ab3580、ab23315、ab32529、ab59208、ab300473、ab38449、ab8245)均购自英国Abcam 公司;FITC 标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗(批号GB22303)购自武汉塞尔维生物科技有限公司;IgE、白细胞介素4(interleukin 4,IL-4)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号分别为SEA545 Mu、SEA077Mu)均购自武汉云克隆科技股份有限公司;BCA 蛋白浓度测定试剂盒、超敏ECL 化学发光试剂盒(批号分别为P0012S、P0018S)均购自上海碧云天生物技术有限公司。
1.3 动物
本研究所用动物为SPF级BALB/c小鼠,雌雄各半,6~8周龄,体重(20±2) g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号为SCXK(辽)2020-0001。小鼠购入后饲养于SPF级标准动物室内,室内温度为(24±2) ℃,相对湿度为(50±10)%,保持昼夜节律交替。饲养期间食用标准饲料,常规适应性饲养7 d。本实验方案已通过包头医学院动物伦理委员会批准(批准号为2022第59号)。
2 方法
2.1 动物分组、造模与给药
将50只小鼠按照随机数字表法分为5组,即正常对照组(A组)、模型组(B组)、地塞米松干预组(阳性对照,C组)、沙棘果油干预组(D组)、地塞米松+沙棘果油干预组(E 组),每组10 只。除A 组外,其余各组均采用DNCB+葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)法制备AD小鼠模型。具体造模方法是在文献[12]的基础上改进的:实验第1天,给所有小鼠背部皮肤做除毛处理(除毛面积约2 cm×3 cm);于实验第1、3、5 天,使用2.5%SEB 溶液(20 μL)、1%DNCB 溶液(200 μL)涂抹于B、C、D、E组小鼠背部皮肤,每天1次,共3次;自实验第7 天起,使用2.5%SEB 溶液(20 μL)、0.5%DNCB 溶液(20 μL)涂抹于B、C、D、E 组小鼠左耳部皮肤处进行激发,每3 天激发1 次,共10 次。自实验第7 天起,分别使用地塞米松(1.5 mg/kg,剂量根据文献[13]设置)和/或沙棘果油(10 mL/kg)[12]对C、D、E组小鼠进行灌胃,每天1次,连续28 d。实验第35天,麻醉取血后处死小鼠(取血处死前,肉眼观察所有小鼠左耳部皮肤外观),取各组小鼠眼眶血,在4 ℃下以4 000×g离心10 min,取上清置于-80 ℃冰箱中冻存。
2.2 病理组织学观察
取部分小鼠左耳部皮肤组织,用4%多聚甲醛固定,经脱水、透明、浸蜡等常规步骤处理后,制作蜡块并切片(厚度为5 μm)。常规行苏木素-伊红(HE)染色后在显微镜下观察各组小鼠左耳部皮肤组织形态特点,并测量各组小鼠左耳部皮肤表皮层厚度。
2.3 血清中IgE、IL-4水平的检测
采用ELISA 法检测。取“2.1”项下冻存血清,常规解冻处理后,按相应试剂盒说明书方法操作,检测各组小鼠血清中IgE、IL-4水平。
2.4 耳部皮肤组织中GRα、GRβ表达的检测
2.4.1 耳部皮肤组织中GRα、GRβ阳性细胞数检测
采用免疫荧光单标法检测。取小鼠左耳部皮肤组织,放入4%多聚甲醛中固定8 h,经脱水、透明、浸蜡等常规步骤处理后,制作石蜡切片(厚度为5 μm),经二甲苯及梯度乙醇脱蜡、抗原修复后,以5%牛血清白蛋白(albumin from bovine serum,BSA)封闭1 h,分别滴加GRα、GRβ 抗体(稀释比例均为1∶500),4 ℃孵育过夜,洗片后滴加荧光二抗(稀释比例1∶1 000),复染淬灭后封片。在荧光显微镜下采集图像,于200 倍放大倍数下计数每个视野中GRα、GRβ 阳性细胞数(二者阳性表达均呈绿色荧光),同一张切片计数5个视野,计数平均每个视野中的阳性细胞数,作为该样本的阳性细胞数进行结果分析。
2.4.2 耳部皮肤组织中GRα、GRβ蛋白表达水平检测
取小鼠左耳部皮肤组织,采用组织匀浆细胞裂解法提取核蛋白和总蛋白,采用Western blot 法检测核蛋白中GRα 蛋白表达水平及总蛋白中GRβ 蛋白表达水平。以BCA 法测定蛋白浓度,用裂解液调整蛋白浓度至6.25 mg/mL,沸水浴中变性5 min。取50 μg变性后的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(在80 V电压下电泳30 min,然后调整电压至120 V 继续电泳120 min),湿法转膜(电压70 V,转膜时间70 min),以5%BSA封闭1 h;分别加入GRα、GRβ、GAPDH抗体(稀释比例均为1∶500),4 ℃孵育过夜;次日室温复温1 h,以TBST 清洗5 min×6 次,加入二抗(稀释比例1∶1 000),室温孵育2 h;再以TBST 清洗5 min×6 次,加入ECL 发光液,采用凝胶成像系统曝光显影,并用系统自带的软件测定条带灰度值。以目的蛋白条带灰度值与内参蛋白(GAPDH)条带灰度值的比值作为该样本中目的蛋白的相对表达水平。
2.5 耳部皮肤组织中AKT/S6K1 信号通路相关蛋白表达的检测
采用Western blot 法检测。取小鼠左耳部皮肤组织,采用组织匀浆细胞裂解法提取总蛋白,具体方法及步骤同“2.4.2”项下。其中,Gαi1、Gαi3、S6K1、p-S6K1、AKT1/2、p-AKT 一抗的稀释比例均为1∶500,二抗的稀释比例为1∶1 000。
2.6 统计学方法
采用SPSS 26.0软件进行统计分析。符合正态分布且方差齐的数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 小鼠左耳外观及耳组织病理学观察结果
A组小鼠左耳部皮肤外观无明显红肿等炎症表现;显微镜下显示该组小鼠左耳部皮肤表皮层细胞层次清晰、排列规整,真皮层无明显血管扩张及炎症细胞浸润。B组小鼠左耳部皮肤红肿、增厚、脱屑,部分区域溃烂;显微镜下显示该组小鼠左耳部皮肤表皮层明显增厚,角化过度伴角化不全,真皮层血管扩张,大量炎症细胞浸润。C、D组小鼠的左耳部皮肤红肿程度、过度角化现象及炎症细胞浸润程度相较于B组均明显减轻。E组小鼠的左耳部皮肤炎症表现趋于消退,过度角化现象消失,炎症细胞浸润极少。结果见图1(C、D组图略)。
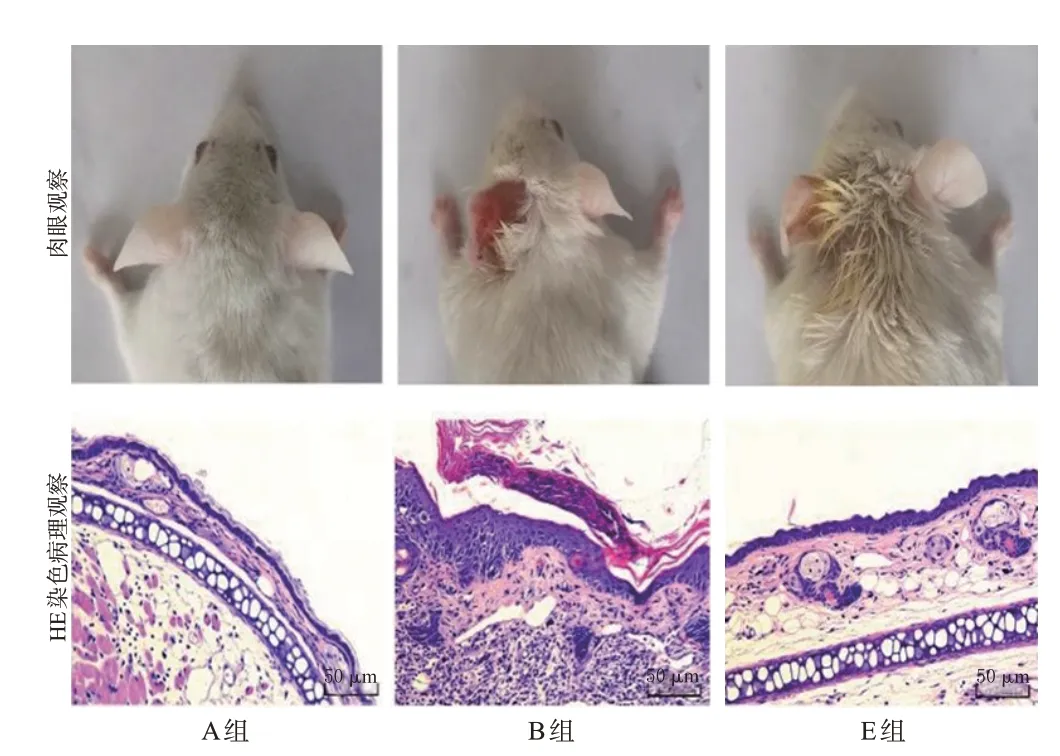
图1 各组小鼠左耳部皮肤外观及耳组织病理学观察的显微图
统计分析结果显示,与A组[(8.2±1.6) μm]比较,B组小鼠左耳部皮肤的表皮层厚度[(64.5±7.2) μm]显著增加(P<0.05);与B组比较,C、D、E组小鼠左耳部皮肤的表皮层厚度[分别为(39.1±5.4)、(34.5±5.0)、(20.9±3.5) μm]均显著减小(P<0.05);与C组比较,E组小鼠左耳部皮肤的表皮层厚度显著减小(P<0.05)。
3.2 小鼠血清中IgE、IL-4水平测定结果
与A 组比较,B 组小鼠血清中IgE、IL-4 水平均显著升高(P<0.05);与B组比较,C、D、E组小鼠血清中IgE、IL-4水平均显著降低(P<0.05);与C组比较,E组小鼠血清中IgE、IL-4水平均显著降低(P<0.05)。结果见表1。
表1 各组小鼠血清中IgE、IL-4 水平测定结果(±s,n=10)
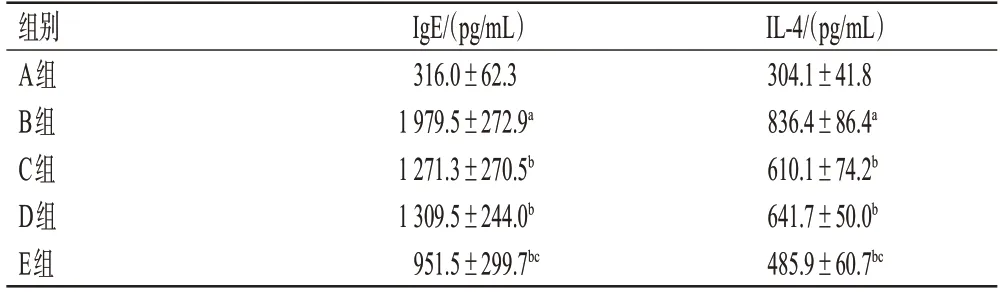
表1 各组小鼠血清中IgE、IL-4 水平测定结果(±s,n=10)
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与C组比较,P<0.05。
IL-4/(pg/mL)304.1±41.8 836.4±86.4a 610.1±74.2b 641.7±50.0b 485.9±60.7bc组别A组B组C组D组E组IgE/(pg/mL)316.0±62.3 1 979.5±272.9a 1 271.3±270.5b 1 309.5±244.0b 951.5±299.7bc
3.3 小鼠耳部皮肤组织中GRα、GRβ表达的测定结果
3.3.1 GRα、GRβ阳性细胞数测定结果
与A组比较,B组小鼠GRα阳性细胞数差异无统计学意义(P>0.05),GRβ阳性细胞数显著增加(P<0.05);与B组比较,C组小鼠GRα阳性细胞数差异无统计学意义(P>0.05),D、E 组小鼠GRα 阳性细胞数显著增加(P<0.05),C组小鼠GRβ阳性细胞数显著增加(P<0.05),E组小鼠GRβ阳性细胞数显著减少(P<0.05);与C组比较,D、E 组小鼠GRα 阳性细胞数显著增加(P<0.05),GRβ阳性细胞数显著减少(P<0.05)。结果见图2、表2。
表2 各组小鼠耳部皮肤组织中GRα、GRβ表达情况的测定结果(±s,n=10)
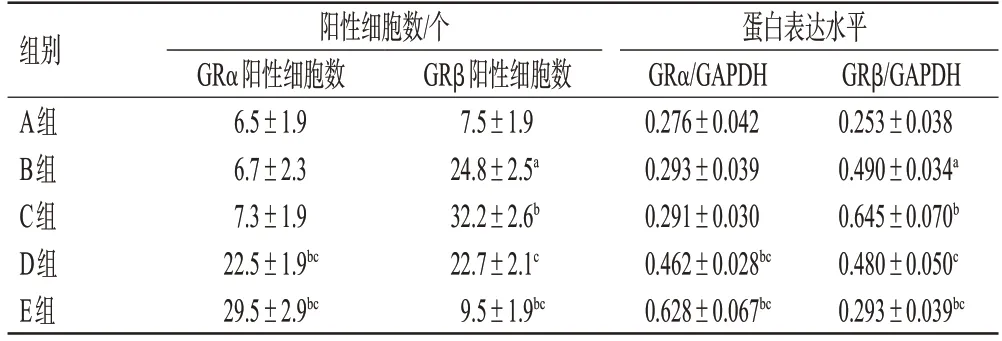
表2 各组小鼠耳部皮肤组织中GRα、GRβ表达情况的测定结果(±s,n=10)
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与C组比较,P<0.05。
组别A组B组C组D组E组阳性细胞数/个GRα阳性细胞数6.5±1.9 6.7±2.3 7.3±1.9 22.5±1.9bc 29.5±2.9bc GRβ阳性细胞数7.5±1.9 24.8±2.5a 32.2±2.6b 22.7±2.1c 9.5±1.9bc蛋白表达水平GRα/GAPDH 0.276±0.042 0.293±0.039 0.291±0.030 0.462±0.028bc 0.628±0.067bc GRβ/GAPDH 0.253±0.038 0.490±0.034a 0.645±0.070b 0.480±0.050c 0.293±0.039bc

图2 各组小鼠耳部皮肤组织中GRα、GRβ表达的免疫荧光图
3.3.2 GRα、GRβ蛋白表达水平测定结果
与A组比较,B组小鼠核蛋白中GRα蛋白表达水平差异无统计学意义(P>0.05),总蛋白中GRβ 蛋白表达水平显著升高(P<0.05)。与B组比较,C组小鼠核蛋白中GRα 蛋白表达水平差异无统计学意义(P>0.05),D、E 组小鼠核蛋白中GRα 蛋白水平及C 组小鼠总蛋白中GRβ蛋白表达水平均进一步升高(P<0.05),E组小鼠总蛋白中GRβ 表达水平显著降低(P<0.05)。与C 组比较,D、E 组小鼠核蛋白中GRα 蛋白表达水平显著升高(P<0.05),总蛋白中GRβ 蛋白水平显著减低(P<0.05)。结果见表2、图3。
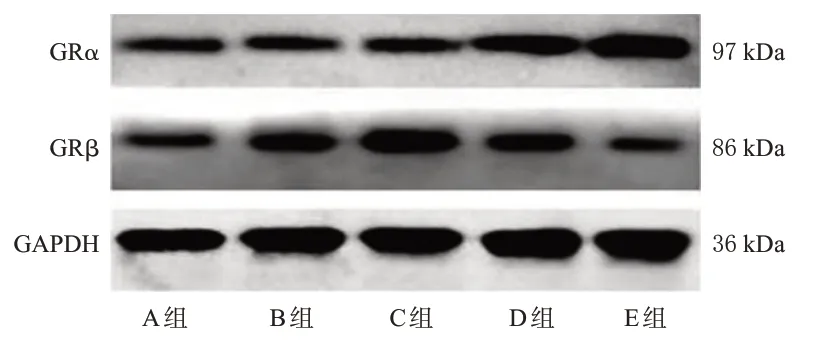
图3 各组小鼠耳部皮肤组织中GRα、GRβ蛋白表达的电泳图
3.4 小鼠耳部皮肤组织中AKT/S6K1 信号通路相关蛋白表达的测定结果
与A组比较,B组小鼠Gαi1、Gαi3、p-S6K1、p-AKT的蛋白表达水平均显著升高(P<0.05);与B组比较,C、D、E组小鼠Gαi1、Gαi3、p-S6K1、p-AKT的蛋白表达水平均显著降低(P<0.05);与C 组比较,D、E 组小鼠Gαi1、p-S6K1、p-AKT 的蛋白表达水平及E 组小鼠Gαi3 的蛋白表达水平均显著降低(P<0.05)。结果见图4、表3。
表3 各组小鼠耳部皮肤组织中AKT/S6K1信号通路相关蛋白表达水平测定结果(±s,n=10)

表3 各组小鼠耳部皮肤组织中AKT/S6K1信号通路相关蛋白表达水平测定结果(±s,n=10)
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与C组比较,P<0.05。
p-AKT/GAPDH 0.288±0.042 0.758±0.081a 0.595±0.077b 0.482±0.050bc 0.448±0.070bc组别A组B组C组D组E组Gαi1/GAPDH 0.274±0.045 0.764±0.066a 0.591±0.067b 0.493±0.042bc 0.452±0.057bc Gαi3/GAPDH 0.296±0.050 0.761±0.063a 0.562±0.084b 0.506±0.036b 0.443±0.037bc S6K1/GAPDH 0.798±0.074 0.834±0.039 0.801±0.054 0.785±0.047 0.813±0.061 p-S6K1/GAPDH 0.280±0.050 0.727±0.043a 0.570±0.053b 0.462±0.067bc 0.477±0.059bc AKT1/2/GAPDH 0.785±0.076 0.812±0.034 0.755±0.049 0.763±0.029 0.778±0.084
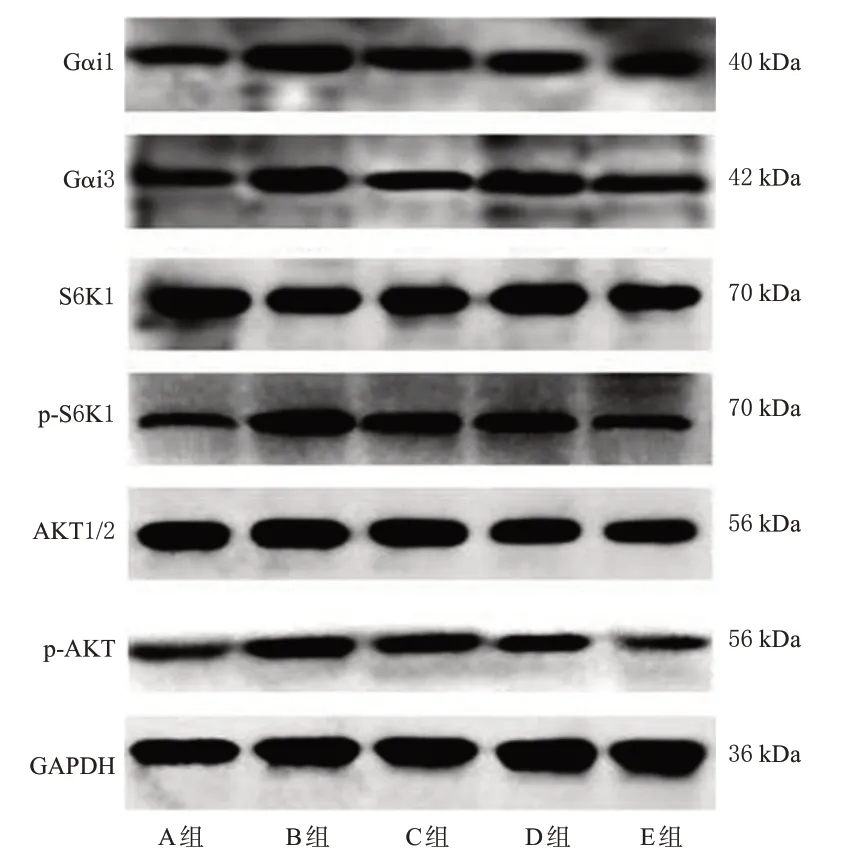
图4 各组小鼠耳部皮肤组织中AKT/S6K1信号通路相关蛋白表达的电泳图
4 讨论
中国医学科学院的研究人员早在20世纪60年代就对我国境内沙棘的资源分布及药理作用展开了研究,在后续的动物实验中证实沙棘油具有抗炎作用且无明显毒性[14]。近年来,随着对沙棘研究的深入,更多学者聚焦于沙棘果油的抗炎作用[15]。关于沙棘油在皮肤科的应用,早有报道其除了具有美容功效外,对皮肤烧伤、紫外线损伤、皮炎损伤等也有效,可促进皮肤再生、减轻组织炎症、促进伤口愈合[16]。在外用GC 进行AD 治疗时,即便严格遵守用药规范,仍有可能随着病程和治疗时间的延长出现激素抵抗,影响治疗效果[17]。本研究结果显示,使用DNCB 联合SEB 刺激后,小鼠皮肤组织炎症表现明显,血清IgE、IL-4 水平显著升高;沙棘果油联合地塞米松对AD小鼠炎症反应的抑制作用较二者单独应用时更为显著,表现为皮损局部的炎症表现趋于消退,小鼠血清中IgE、IL-4 水平降低。本研究结果进一步验证了沙棘果油在皮肤炎症性疾病中的抗炎作用。
GC需要与细胞内的GRα结合形成复合物转运至细胞核内方能发挥作用,GRβ是GC负调控因子,能够抑制GRα 的活性[18]。本课题组通过免疫荧光单标法检测了各组小鼠皮损部位皮肤组织中GRα、GRβ 阳性细胞数量。结果发现,使用DNCB 联合SEB 刺激后,小鼠皮肤组织中GRα 阳性细胞数与正常小鼠比较差异无统计学意义,GRβ阳性细胞数显著增加。作为GC负调控因子,GRβ 阳性细胞数的增加抑制了GC 作用的发挥,促使激素抵抗发生。使用地塞米松(常用的GC 药物)干预后,AD 小鼠皮肤组织中GRα 阳性细胞数与干预前比较差异无统计学意义,而应用沙棘果油或沙棘果油联合地塞米松干预后,小鼠皮肤组织中GRα 阳性细胞数显著增加;单独应用地塞米松干预时,GRβ 阳性细胞数增加最为显著,而沙棘果油单用或者联合地塞米松应用后能够减少GRβ阳性细胞数,抑制激素抵抗。为了进一步验证GRα、GRβ 的蛋白表达情况,本课题组分别提取了各组小鼠皮肤组织中的核蛋白和总蛋白,并检测了GRα、GRβ 蛋白在皮肤组织中的表达情况。结果显示,使用DNCB联合SEB刺激后,小鼠皮肤组织核蛋白中GRα蛋白表达水平与正常小鼠比较差异无统计学意义,总蛋白中GRβ 蛋白表达水平显著升高。应用沙棘果油或沙棘果油联合地塞米松干预后,AD 小鼠皮肤组织核蛋白中GRα 蛋白表达水平升高,总蛋白中GRβ 蛋白表达水平降低。所得结果与免疫荧光单标法结果互为佐证,证实了沙棘果油对激素抵抗型AD小鼠的GRα、GRβ表达具有调节作用,其可通过上调GRα的表达及入核转位增强地塞米松的作用,抑制激素抵抗;并且可通过上调GRα的表达及增加地塞米松入核转位,进一步促进地塞米松发挥作用。G 蛋白偶联受体(G-protein-coupled receptors,GPCRs)属于一大类大型膜蛋白受体,在静息状态下能与鸟嘌呤核苷酸结合蛋白的异源三聚体结合形成G蛋白,而G蛋白包括Gα、Gβ和Gγ这3个亚基。当GPCRs被激活后,受体构象发生变化,Gα与二聚体Gβγ分离,进而启动信号转导。Gαi1、Gαi3是Gα亚基中2种重要的蛋白,有研究发现Gαi1、Gαi3 不仅能与GPCRs 结合,还能与胞外配体结合[19]。本研究发现,Gαi1、Gαi3、p-AKT、p-S6K1蛋白在DNCB联合SEB刺激小鼠中均呈现出表达增加的特点,这表明AKT/S6K1信号通路呈活化状态,启动了炎症反应。单独使用地塞米松、沙棘果油干预或二者联合应用时,Gαi1、Gαi3、p-AKT、p-S6K1蛋白表达均呈下降趋势,与在激素抵抗型AD 小鼠中的表达情况存在显著差异,其中以地塞米松与沙棘果油联合应用时降低最为显著。这表明沙棘果油对激素抵抗型AD小鼠的干预作用可能是通过抑制AKT/S6K1信号通路而发挥的。
综上所述,沙棘果油对SAg 诱导的AD 小鼠激素抵抗具有干预作用,该作用可能是通过抑制Gαi1/3诱导的AKT/S6K1 信号通路而发挥的。然而,本研究仅限于从动物实验获取沙棘果油干预AD 小鼠激素抵抗的证据,对其作用及机制的了解尚浅。本课题组后续拟通过体外实验对沙棘果油有效成分促使GRα 的入核过程及激活的信号通路进行研究,以进一步探索沙棘果油对AD激素抵抗的干预作用及机制。

