玉屏风颗粒通过调节EMT对Lewis荷瘤小鼠肿瘤转移的影响Δ
林映雪 ,崔海鹏 ,王领弟 ,杨昌硕 ,庄朋伟 #(.承德医学院附属医院药学部,河北 承德 067000;.承德医学院病理生理学教研室,河北 承德 067000;.天津中医药大学中药学院,天津 009)
上皮-间充质转化(epithelial-mesenchymal transition,EMT)是上皮细胞失去极性,并转化成间质细胞表型的过程。EMT可破坏上皮屏障功能的完整性,诱发恶性肿瘤组织的上、下皮细胞转化成间质细胞,使细胞间连接(紧密连接、黏附连接、桥粒/半桥粒等)解体,导致细胞表面的上皮标志物[如E-钙黏蛋白(E-cadherin)、细胞角蛋白、紧密连接蛋白1(Zona occludens 1,ZO-1)等]表达水平逐渐降低,而间充质标志物[如N-钙黏蛋白(Ncadherin)、波形蛋白(vimentin)、纤连蛋白等]表达水平升高,最终使肿瘤细胞具备转移和侵袭能力[1—2]。因此,抑制肿瘤细胞EMT,改善上皮屏障功能,可能是治疗肿瘤的有效靶点。
传统中医药具有靶点多、副作用少的特点,近年来有关其在治疗肿瘤方面的研究愈加深入。中医认为肿瘤发生的病因之一为“正气内虚”,正不抗邪,邪气经人体三焦、腠理等通道,四处侵染[3],即出现肿瘤的转移和侵袭。玉屏风散由黄芪、白术、防风3味药组成,是补气固表的经典方剂,目前其制剂有丸剂、颗粒剂、胶囊剂、口服液等多种剂型[4]。研究表明,玉屏风散及其各组分可通过提高机体免疫功能、促进肿瘤细胞凋亡、抑制肿瘤细胞增殖、减缓肿瘤细胞侵袭和转移等起到防治肿瘤的作用[5]。但是关于玉屏风散对肿瘤细胞EMT 及上皮屏障功能完整性影响的研究较少。鉴于此,本研究基于Lewis 荷瘤小鼠自发肺转移模型,以玉屏风颗粒为受试药物,对上述问题进行探讨,为进一步研究玉屏风散及其相关制剂防治肿瘤的机制提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有Ⅸ53型倒置显微镜、Ⅸ71型显微镜图像采集系统(日本Olympus 公司),CFX96 Touch型实时定量PCR仪、Amersham Imager 600型凝胶检测成像系统(美国Bio-Rad公司)。
1.2 主要药品与试剂
玉屏风颗粒(批号200213,规格5 g/袋)购自国药集团广东环球制药有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)(H+L)抗体(批号A0208、A0216)均购自上海碧云天生物技术有限公司;Carazzi 苏木素染色液(批号G4510)、伊红染色液(批号G1100)、免疫组化试剂盒(批号SA00011)均购自北京索莱宝科技有限公司;兔源癌胚抗原检测抗体(批号A12421)、兔源E-cadherin单克隆抗体(批号A3044)均购自武汉爱博泰克生物科技有限公司;兔源β-连环蛋白(β-catenin)多克隆抗体(批号51067-2-AP)、兔源vimentin多克隆抗体(批号10366-1AP)均购自美国Proteintech公司;RNAprep pure动物组织总RNA提取试剂盒(批号DP431)、FastQuant cDNA 第一链合成试剂盒(批号KR106)、SuperReal PreMix SYBR Green qPCR检测试剂盒(批号FP204)均购自天根生化科技(北京)有限公司。
1.3 实验动物
本研究所用动物为SPF级雌性C57BL/6纯系小鼠,共35只,体重(20±2) g,购于北京维通利华实验动物技术有限公司,动物生产合格证号为SCXK(京)2016-0006。小鼠饲养期间给予普通饲料和洁净水。本研究所有动物实验均严格遵循动物实验“3R”原则,严格按照《实验动物福利伦理审查指南》(GB/T 35892-2018)执行,并经承德医学院医学伦理委员会审查通过后实施(伦理审查证号2019055)。
1.4 细胞株
LLC小鼠Lewis肺癌细胞株购于上海诺百生物科技有限公司。
2 方法
2.1 肺癌细胞悬液的制备
将LLC细胞常规培养并传代3次后,调整细胞密度为1×107个/mL,接种至5 只小鼠的右腋下,每只0.2 mL。接种第10天左右,待瘤体长至约1 000 mm3时将小鼠脱颈处死。将生长良好的肺癌组织经匀浆、过滤、离心、稀释后制成细胞密度为1×107个/mL 的肺癌细胞混悬液[6]。
2.2 动物造模、分组及给药
采用随机数字表法将剩下30只小鼠分为正常组、模型组、玉屏风颗粒组,每组10只。取“2.1”项下细胞悬液0.2 mL 接种于模型组和玉屏风颗粒组小鼠的右腋皮下处,当该处出现小结节并不断增长时,判定小鼠自发肺转移模型制备成功[7]。
精密称取玉屏风颗粒,以蒸馏水溶解,制成质量浓度为4 g/mL的玉屏风颗粒给药液,每日现配现用。接种细胞悬液的第10天开始灌胃给药,正常组和模型组小鼠给予蒸馏水,玉屏风颗粒组小鼠给予40 g/kg玉屏风颗粒(根据前期预实验结果,选择20倍临床等效剂量为受试剂量),给药体积均为0.01 mL/g。每天给药1 次,连续15 d。
2.3 一般情况观察
给药后每天定时观察小鼠的状态,包括毛发色泽、饮食、排便、精神、活动等。
2.4 肺组织肿瘤转移灶计数及肺转移抑制率计算
给药结束后将小鼠脱颈处死,取出肺组织,经生理盐水漂洗后在显微镜下对肺组织肿瘤转移灶进行计数。转移灶为类圆形小突起,呈结节状或半透明点状,部分转移灶可能融合到一起。根据肺结节直径将其分为4级:Ⅰ级<0.5 mm;0.5 mm≤Ⅱ级≤1 mm;1 mm<Ⅲ级≤2 mm;Ⅳ级>2 mm[8]。计算肺表面转移结节总数和肺转移抑制率:肺表面转移结节总数=Ⅰ级结节数量×1+Ⅱ级结节数量×2+Ⅲ级结节数量×3+Ⅳ级结节数量×4;肺转移抑制率(%)=(模型组平均肺表面转移结节数-玉屏风颗粒组平均肺表面转移结节数)/模型组平均肺表面转移结节数×100%。
2.5 肺组织肿瘤转移灶观察
取小鼠左肺组织,经4%多聚甲醛固定后,再经梯度脱水、常规石蜡包埋、切片(5 μm)、苏木素-伊红(HE)染色,于显微镜下观察肺组织肿瘤转移灶。
2.6 肺组织癌胚抗原表达检测
取“2.5”项下小鼠肺组织石蜡切片,常规脱蜡、抗原修复、封闭后,滴加癌胚抗原一抗(稀释比例1∶200),4 ℃孵育过夜;次日洗涤后,滴加HRP 标记的山羊抗兔IgG(H+L)二抗(稀释比例1∶50),室温孵育50 min;以DAB显色,苏木素染液复染细胞核,脱水封片,于显微镜下观察肺组织中癌胚抗原的表达情况。每张切片在显微镜下选取3个视野,以棕黄色为阳性表达,采用Image J 软件计算平均光密度值,平均光密度值越大表示癌胚抗原的表达水平越高。
2.7 肺组织中EMT相关基因mRNA表达水平检测
采用qRT-PCR 法进行检测。每组随机选取5 只小鼠的肺组织,采用Trizol 法提取组织中总RNA,按FastQuant cDNA 第一链合成试剂盒操作将其反转录为cDNA 后,按SuperReal PreMix SYBR Green qPCR 检测试剂盒说明书进行PCR 扩增。扩增反应条件为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火/延伸32 s,共40 个循环。以GAPDH 为内参,采用2-ΔΔCt法,以对照组为参照进行标准化处理,计算EMT 相关基因mRNA 的相对表达水平。PCR引物由笔者采用Primer 3.0软件自行设计,经NCBI数据库核查后,由上海生工生物工程技术有限公司合成。引物序列及扩增产物长度见表1。

表1 引物序列及扩增产物长度
2.8 肺组织中EMT相关蛋白表达水平检测
采用Western blot 法进行检测。每组取3 只小鼠的肺组织,匀浆,提取总蛋白,按照BCA 试剂盒说明书操作进行蛋白定量。取45 μg 变性后总蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转膜,以5%脱脂奶粉封闭;加入相应一抗(E-cadherin稀释比例1∶1 000、vimentin 稀释比例1∶1 000、β-catenin 稀释比例1∶1 000、β-actin 稀释比例1∶5 000),4 ℃孵育过夜。次日将条带洗涤后再加入相对应的二抗(稀释比例1∶10 000),25 ℃孵育1 h。孵育结束后,以TBST 缓冲液洗涤、超敏ECL化学发光试剂盒显影,采用凝胶成像仪进行检测分析。采用Image Pro Plus 软件进行光密度分析,以EMT 相关蛋白条带光密度值与内参蛋白(β-actin)条带光密度值的比值表示目的蛋白的相对表达水平。
2.9 统计学方法
采用SPSS 23.0 软件对数据进行统计分析,Graphpad Prism 8软件作图。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 一般情况观察结果
与正常组比较,模型组小鼠精神萎靡,活动减少,毛发晦暗无光泽;与模型组比较,玉屏风颗粒组小鼠精神状态较好,毛发稍有光泽。
3.2 肺组织肿瘤转移灶计数及肺转移抑制率计算结果
与正常组比较,模型组、玉屏风颗粒组小鼠肺组织中出现了肿瘤转移灶;与模型组比较,玉屏风颗粒组小鼠肺表面转移结节总数显著减少(P<0.05),其肺转移抑制率为46.52%。结果见表2。
表2 各组小鼠肺组织肿瘤转移灶计数及肺转移抑制率测定结果(±s,n=10)

表2 各组小鼠肺组织肿瘤转移灶计数及肺转移抑制率测定结果(±s,n=10)
a:与模型组比较,P<0.05。
组别正常组模型组玉屏风颗粒组肺表面转移结节总数/个-1.87±0.95 1.00±0.00a肺转移抑制率/%--46.52
3.3 肺组织肿瘤转移灶HE染色结果
与正常组比较,模型组小鼠左肺组织出现肿瘤转移灶,与邻近组织有明显的分界;与模型组比较,玉屏风颗粒组小鼠肿瘤转移灶变小,组织大体形态有所恢复。HE染色结果见图1。

图1 各组小鼠肺组织肿瘤转移灶HE染色显微图
3.4 肺组织癌胚抗原表达检测结果
与正常组(平均光密度值为52.17±7.00)比较,模型组小鼠肺组织癌胚抗原的表达(平均光密度值为258.40±15.65)显著增强(P<0.05),且呈散在性分布;与模型组比较,玉屏风颗粒组小鼠肺组织癌胚抗原的表达(平均光密度值为50.48±7.03)显著减弱(P<0.05)。免疫组化染色结果见图2。
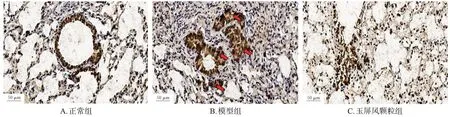
图2 各组小鼠肺组织癌胚抗原表达检测的免疫组化图
3.5 肺组织中EMT相关基因mRNA表达水平测定结果
与正常组比较,模型组小鼠肺组织中E-cadherin mRNA 表达水平显著降低(P<0.05),vimentin、β-catenin mRNA表达水平均显著升高(P<0.05);与模型组比较,玉屏风颗粒组小鼠肺组织中E-cadherin mRNA表达水平显著升高(P<0.05),vimentin、β-catenin mRNA 表达水平均显著降低(P<0.05)。结果见表3。
表3 各组小鼠肺组织中EMT 相关基因mRNA 的表达水平测定结果(±s,n=5)

表3 各组小鼠肺组织中EMT 相关基因mRNA 的表达水平测定结果(±s,n=5)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05。
组别正常组模型组玉屏风颗粒组β-catenin/GAPDH 1.00±0.00 1.70±0.20a 0.75±0.07b E-cadherin/GAPDH 1.00±0.00 0.45±0.12a 0.70±0.03b vimentin/GAPDH 1.00±0.00 1.67±0.13a 1.09±0.04b
3.6 肺组织中EMT相关蛋白表达水平测定结果
与正常组比较,模型组小鼠肺组织中E-cadherin 蛋白表达水平显著降低(P<0.05),vimentin、β-catenin蛋白表达水平均显著升高(P<0.05);与模型组比较,玉屏风颗粒组小鼠肺组织中E-cadherin蛋白表达水平显著升高(P<0.05),vimentin、β-catenin蛋白表达水平均显著降低(P<0.05)。结果见表4、图3。
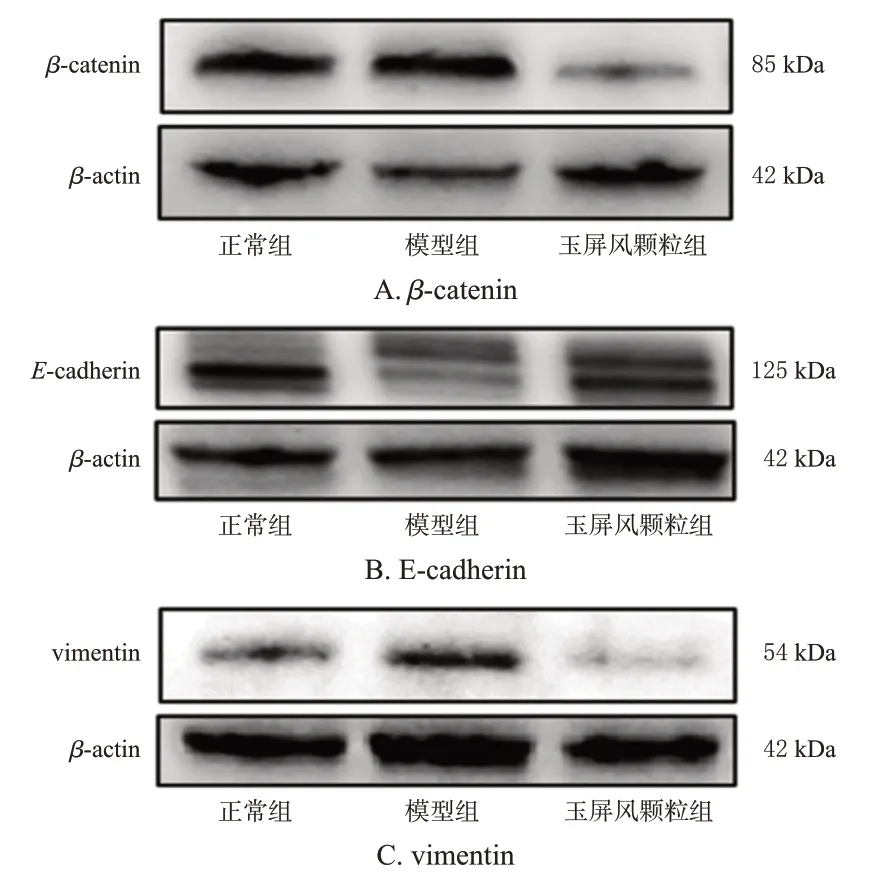
图3 各组小鼠肺组织中EMT相关蛋白表达的电泳图
表4 各组小鼠肺组织中EMT 相关蛋白表达水平测定结果(±s,n=3)

表4 各组小鼠肺组织中EMT 相关蛋白表达水平测定结果(±s,n=3)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05。
组别正常组模型组玉屏风颗粒组β-catenin/β-actin 0.76±0.03 1.27±0.06a 0.44±0.03b E-cadherin/β-actin 1.02±0.03 0.67±0.02a 0.88±0.02b vimentin/β-actin 0.46±0.01 0.74±0.03a 0.17±0.01b
4 讨论
恶性肿瘤的发生发展不仅与肿瘤细胞的快速增殖有关,还与肿瘤细胞的迁移和侵袭密切相关,而肿瘤细胞的迁移和侵袭又是一个复杂的、多步骤的过程[8]。传统中医认为“正气虚弱,腠理不密”是肿瘤发生和转移的重要条件。在病理状态下,正气亏虚,癌毒可以由经络、三焦、腠理等通道进行转移[3]。上皮屏障是由上皮细胞间连接及细胞间的黏附物构成的一种物理及生物学功能性屏障,是机体对抗环境因素的主要防御系统[9]。而上皮屏障功能的完整性与肿瘤细胞的侵袭、迁移能力密切相关[10]。因此,笔者认为上皮屏障功能异常可能是“腠理不密”的组织病理学基础。
EMT与上皮屏障功能密切相关,其过程受到众多参与维持上皮特性的细胞黏附分子的调节。EMT 在肿瘤细胞迁移和侵袭的过程中起着关键作用,是肿瘤细胞侵袭、迁移的初始步骤[11]。EMT的重要分子特征是上皮细胞膜表面的E-cadherin等上皮标志物被vimentin等间充质标志物取代,形成间充质结构,使肿瘤细胞游离并突破基底膜从而进行迁移和侵袭[12]。E-cadherin 作为一类单通道跨膜蛋白,其胞外结构域能够介导相邻细胞间产生亲和作用,即黏附连接,有助于维持屏障功能的完整性[13]。当E-cadherin 表达下降时,同表型细胞-细胞间黏附和连接被破坏,这一过程被认为是细胞脱离原发肿瘤侵入周围组织,并迁移到远端的作用基础[14]。vimentin也是EMT的重要标志物,其会使上皮细胞失去极性、黏附力减弱,从而破坏细胞的紧密连接结构,促进细胞迁移,故其在癌组织中过表达会驱动EMT的发生[15]。本研究结果发现,玉屏风颗粒可显著抑制肿瘤转移,使肺组织形态有所恢复,减少肺组织癌胚抗原的表达。同时,经玉屏风颗粒干预后,EMT相关因子E-cadherin的表达显著下调,提示玉屏风颗粒可抑制模型小鼠的EMT,修复上皮细胞屏障功能。
β-catenin 是一类重要的黏附分子[16],可介导钙黏蛋白黏附受体与细胞骨架连接。正常情况下,E-cadherin与β-catenin 结合,形成E-cadherin/β-catenin 复合物以稳定细胞间的联系[13]。而当机体受刺激时,E-cadherin 黏着度降低,β-catenin 从细胞膜上脱落下来,激活下游靶基因,导致EMT 产生[17]。本研究结果显示,玉屏风颗粒可使模型组小鼠肺组织中β-catenin的表达显著下调,提示玉屏风颗粒可能是通过降低β-catenin 的表达抑制模型小鼠的EMT。
综上所述,玉屏风颗粒可能是通过减少β-catenin的表达抑制EMT的发生,从而改善小鼠的上皮屏障功能,进而降低肿瘤细胞侵袭、转移的能力,发挥抑制肿瘤的作用。本研究从形态学和分子生物学角度初步证实了玉屏风颗粒对EMT 的调控作用,为探寻肿瘤转移的预防策略提供了一定的实验基础,同时也为进一步阐明玉屏风散及其相关制剂治疗肿瘤的机制提供了参考。

