小分子抑制剂SYHA1809在比格犬体内的药动学研究Δ
刘晓琳 ,杨汉煜 ,王小彦 ,康 凯 1,,梁 敏 [1.河北医科大学药学院,石家庄 050011;.石药中奇制药(石家庄)有限公司,石家庄 050035]
贫血是慢性肾病(chronic kidney disease,CKD)的一种常见并发症,可降低患者的免疫力,影响患者的生活质量,甚至会增加血管疾病和死亡的风险[1]。美国心脏协会表示贫血是CKD患者的非传统心血管危险因素[2]。由于红细胞生成刺激剂(erythropoiesis-stimulating agents,ESAs)的低反应性和铁剂治疗的诸多不良反应,目前仍有许多肾性贫血患者未得到有效治疗,很大比例的CKD合并贫血患者仍然不能达到正常血红蛋白的水平[3]。低氧诱导因子(hypoxia-inducible factor,HIF)是细胞适应低氧环境的关键性转录因子,目前已证实约有100多个基因受其调控,在红细胞生长、肿瘤生长和血管生长等方面发挥着重要作用[4—5]。脯氨酰羟化酶(prolyl hydroxylase domain,PHD)作为HIF 依赖性红细胞生成调节剂的发现,推动了肾性贫血新治疗药物的开发[6]。靶向PHD的小分子抑制剂研究已经成为当前治疗贫血/缺血及炎症等疾病的策略之一。目前全球上市的HIFPHD 抑制剂包括Roxadustat、Molidustat、Daprodustat、Vadadustat、Enarodustat 5个产品,其中Roxadustat作为国内唯一上市的HIF-PHD抑制剂受到许多质疑,最终未能获得美国FDA 批准上市[7]。因此,开发结构新颖、药效更好、安全性更佳的小分子HIF-PHD抑制剂仍然迫切。
SYHA1809 是经石药集团初筛后获得的一类创新型HIF-PHD抑制剂,拟用于肾性贫血患者。本研究团队前期药效学实验结果显示,SYHA1809 对PHD 1~3 均有很强的抑制作用,并能升高人Hep3B 细胞中HIF-1α、HIF-2α 的表达,还可上调正常小鼠和双肾摘除小鼠(贫血动物模型)血浆红细胞生成素(erythropoietin,EPO)浓度,上调顺铂诱导的贫血小鼠的红细胞和血红蛋白浓度。基于此,本研究拟以比格犬为研究对象,采用液相色谱-串联质谱(LC-MS/MS)法考察SYHA1809 的药动学行为,以期为该新药的临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有TSQ Quantum Vantage型三重四极杆串联质谱仪(日本Shimadzu公司)、5804R型高速离心机(德国Eppendorf公司)、H-101型多功能漩涡混合器(上海康禾光电仪器有限公司)、CPA225D型分析天平[赛多利斯科学仪器(北京)有限公司 ]。
1.2 主要药品与试剂
SYHA1809、罗沙司他(内标)对照品(批号分别为20190412、H20190301,纯度均大于99.0%)均由石药集团中奇制药技术(石家庄)有限公司提供;二甲基亚砜(DMSO)为分析纯,购自天津市科密欧化学试剂有限公司;甲酸、乙酸铵均为色谱级,购自上海阿拉丁生化科技股份有限公司;水为娃哈哈纯净水。
1.3 动物
本研究所用动物为健康比格犬,体重为6~12 kg,共30只,雌雄各半,购自北京玛斯生物技术有限公司,动物生产许可证号为SCXK(京)2021-0002,合格证号为110318210100027738,使用许可证号为SYXK(冀)2021-007。比格犬给药前禁食不少于12 h,自由饮水。
2 方法与结果
2.1 色谱条件
色谱柱为ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 µm),以2 mmol/L 醋酸铵溶液(含0.1%甲酸)(A)-乙腈(B)为流动相进行梯度洗脱(0~0.5 min,45%B;0.5~1.0 min,45%B→75%B;1.0~1.8 min,75%B;1.8~2.0 min,75%B→95%B;2.0~2.5 min,95%B;2.5~2.6 min,95%B→45%B;2.6~3.0 min,45%B);柱温为40 ℃;流速为0.4 mL/min;进样量为1 μL。
2.2 质谱条件
离子源为加热电喷雾电离源,采用负离子选择反应监测(selected reaction monitoring,SRM)模式扫描;SYHA1809、内标的离子监测通道分别为m/z418→374.1、351.1→173.1;碰撞能量分别为19、37 V;S-Lens电压分别为85、89 V;加热毛细管温度为320 ℃;碰撞气压力为1.5 mTorr。
2.3 溶液的配制
2.3.1 储备液的配制
取SYHA1809 对照品适量,精密称定,加DMSO 溶解后,用甲醇稀释,即得质量浓度为2 mg/mL的储备液。取内标对照品适量,精密称定,加DMSO溶解后,用甲醇稀释,即得质量浓度为1 mg/mL的内标储备液。上述储备液均置于-20 ℃保存备用。
2.3.2 系列标准溶液和质控溶液的配制
精密吸取SYHA1809储备液适量,以50%甲醇倍比稀释,得到质量浓度分别为400、200、80.0、40.0、10.0、2.00、0.800、0.400 μg/mL的系列标准溶液。另精密吸取SYHA1809 储备液适量,以50%甲醇稀释,得到质量浓度分别为320、160、1.20、0.400 μg/mL的质控(QC)溶液。
2.3.3 内标溶液的配制
精密吸取内标储备液,以50%甲醇稀释,即得质量浓度为1 000 ng/mL的内标溶液。
2.4 生物样品预处理
取30 μL 比格犬血浆,加入30 μL 内标溶液和300 μL 乙腈,振摇15 min,以3 700 r/min 离心15 min,取1 μL,按“2.1”“2.2”项下条件进样分析。
2.5 方法学验证
按照《药物非临床药代动力学研究技术指导原则》[8]和生物样品分析国际规范的有关要求[9—10],对比格犬血浆中SYHA1809 的LC-MS/MS 测定方法进行方法学验证,包括方法的专属性、准确度与精密度、残留效应、提取回收率、基质效应、稀释效应以及稳定性考察。
2.5.1 专属性考察
采集6 只比格犬给药前的血浆并混合,得到空白血浆。取空白血浆适量,除不加内标外,其余按“2.4”项下方法处理,然后进样分析,得空白血浆样品色谱图(见图1A);取空白血浆适量,加内标同法处理,得空白血浆+内标样品色谱图(见图1B);取空白血浆适量,加入定量下限质量浓度(20 ng/mL)的SYHA1809溶液,按“2.4”项下方法处理,然后进样分析,得定量下限血浆样品色谱图(见图1C);取空白血浆适量,加入定量上限质量浓度(20 000 ng/mL)的SYHA1809溶液,除不加内标外,其余同法处理,得不含内标的定量上限血浆样品色谱图(见图1D);取比格犬灌胃给药8 h 后的血浆样品,同法处理,得灌胃给药8 h后血浆样品色谱图(见图1E)。结果显示,SYHA1809 与内标的保留时间分别为1.38、1.40 min,空白血浆样品中内源性物质和内标均不干扰待测物的测定。
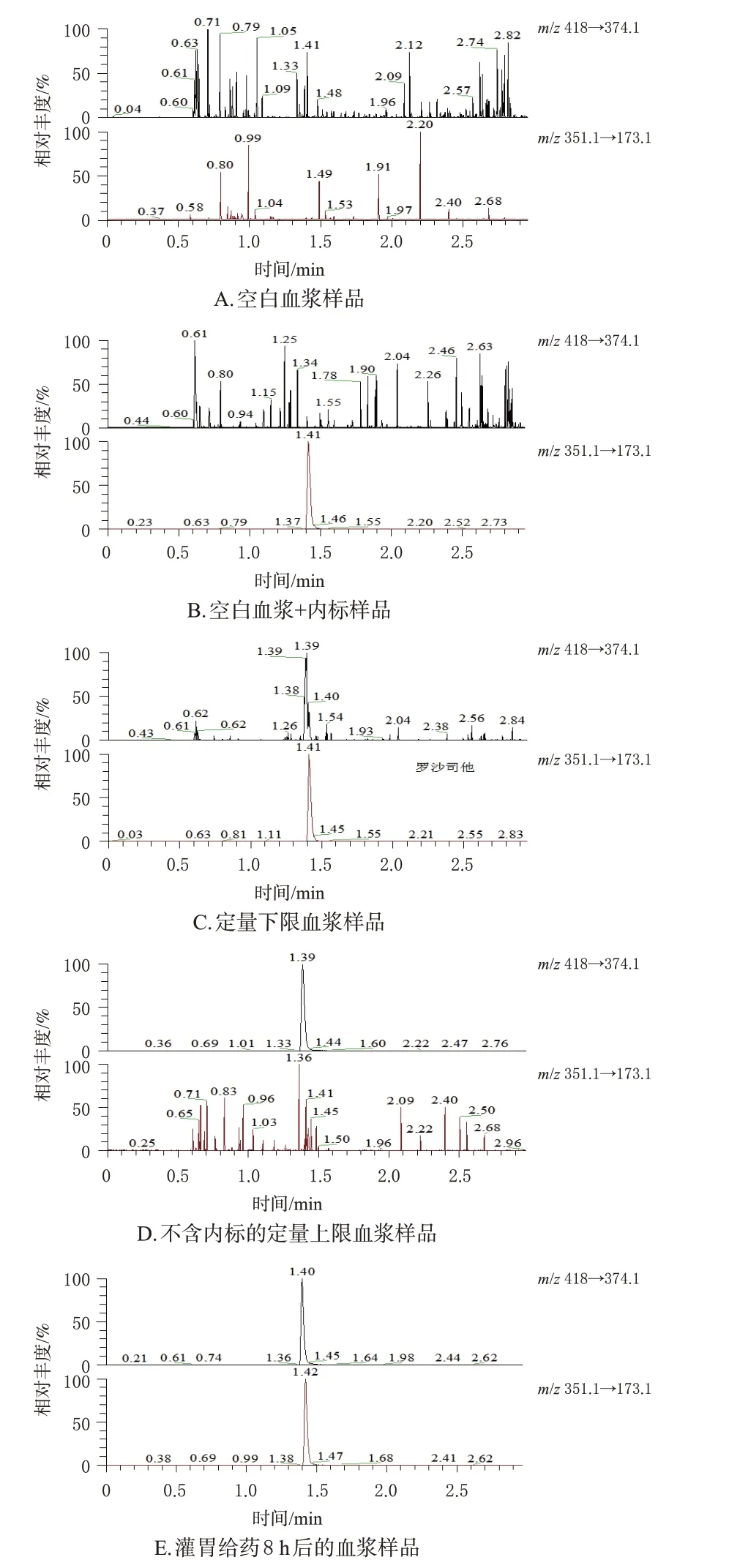
图1 专属性考察的LC-MS/MS图
2.5.2 标准曲线考察
取一定量的系列标准溶液,用空白血浆稀释20 倍后,得到质量浓度为20 000、10 000、4 000、2 000、500、100、40、20 ng/mL 的系列标准样品溶液,按“2.4”项下方法操作后,进样分析。以血浆样品溶液中SYHA1809的质量浓度为横坐标(X)、SYHA1809 与内标的峰面积比值为纵坐标(Y),采用加权最小二乘法进行线性回归,得回归方程为Y=0.000 921X-0.00 140(r2=0.995 8),SYHA1809的线性范围为20~20 000 ng/mL。
2.5.3 准确度与精密度考察
取质量浓度分别为0.400、1.20、160、320 μg/mL 的QC溶液,用空白血浆稀释20倍后,得到质量浓度分别为20.0、60.0、8 000、16 000 ng/mL的QC样品溶液。取上述溶液各30 μL,按“2.4”项下方法处理,每一质量浓度平行6 个样本,连续测定3 个分析批,根据当日的标准曲线,计算QC样品溶液的测得浓度,考察本方法的准确度与精密度。结果显示,各质量浓度QC 样品溶液的准确度为90.1%~107.2%,批内精密度的RSD为0.9%~8.2%(n=6),批间精密度的RSD 为2.3%~7.4%(n=18)。SYHA1809在定量下限质量浓度下的准确度为86.5%~112.3%,日内RSD 为4.2%~8.2%(n=6),日间RSD 为7.4%(n=18)。上述结果表明批内与批间的准确度和精密度均符合生物样品分析方法验证的要求。
2.5.4 残留效应考察
将空白血浆样品按“2.4”项下方法处理,在方法验证每一个分析批的定量上限样品分析结束后,立即进行空白血浆样品分析,考察高浓度样品残留对测定的影响。结果显示,空白血浆中待测物响应低于定量下限的20%,内标响应低于定量下限的5%,表明该方法条件下,待测物和内标均无残留效应。
2.5.5 提取回收率考察
配制SYHA1809 低、中、高质量浓度(60.0、8 000、16 000 ng/mL)的QC 溶液,按“2.4”项下方法处理,每一质量浓度平行6个样本,记录峰面积(A);另将空白血浆进行样品预处理后,取上清液加入上述不同质量浓度的SYHA1809 QC溶液和内标溶液,每一质量浓度平行6个样本,记录峰面积(B);以A/B计算提取回收率。结果显示,低、中、高质量浓度SYHA1809 的提取回收率为(82.8±7.37)%~(84.9±1.30)%,RSD<15%(n=6),具体见表1。

表1 SYHA1809的基质效应和提取回收率测定结果
2.5.6 基质效应考察
将6份来源于不同比格犬的空白血浆经样品预处理后,制备低、高质量浓度(60.0、16 000 ng/mL)的QC 样品,按“2.1”“2.2”项下条件进样分析后,计算SYHA1809与内标的峰面积比值(C);以水代替空白血浆,同法操作后进样分析,计算SYHA1809与内标的峰面积比值(D);以C/D计算得经内标归一化的基质因子。结果显示,低、高质量浓度SYHA1809 的基质效应分别为(90.2±5.90)%、(90.2±0.90)%,RSD<15%(n=6)。
2.5.7 稀释效应考察
取SYHA1809储备液适量,用50%甲醇稀释成质量浓度为1 600 μg/mL 的溶液,用比格犬空白血浆稀释20倍后得到质量浓度为80 000 ng/mL的QC样品。取上述QC 样品,再用比格犬空白血浆稀释5 倍,平行稀释6 个样本;按“2.4”项下方法处理,再根据当日标准曲线进行计算。结果显示,SYHA1809的准确度为99.9%,RSD为2.2%(n=6),表明SYHA1809 的QC 样品经空白血浆稀释5倍后不影响测定结果的准确性。
2.5.8 稳定性考察
取低、高质量浓度(60.0、16 000 ng/mL)的QC 样品溶液,考察其室温放置24 h、蛋白沉淀后室温放置24 h、自动进样器(4 ℃)放置24 h、-70 ℃~室温反复冻融5次、-70 ℃冻存58 d 的稳定性,按“2.4”项下方法处理,每一质量浓度平行6个样本。结果显示,考察样品在上述条件下稳定性良好,准确度偏差均在±15%以内,具体见表2。
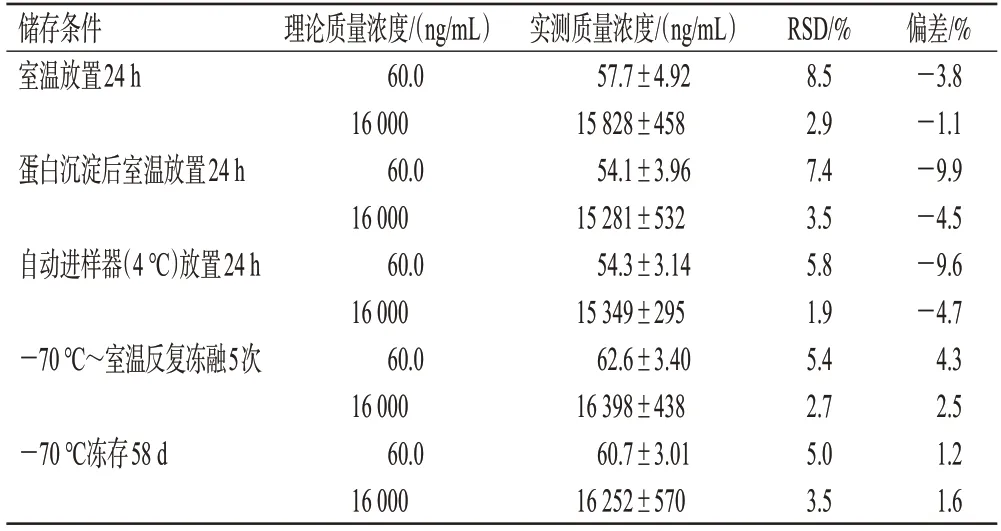
表2 SYHA1809在血浆中的稳定性
2.6 药动学研究
将比格犬随机分为单次静脉给药组(3.75 mg/kg)、单次低剂量灌胃组(3.75 mg/kg)、单次中剂量灌胃组(7.5 mg/kg)、单次高剂量灌胃组(15 mg/kg)和多次灌胃组(7.5 mg/kg,每天1次,连续7 d),每组6只,雌雄各半。给药前各组比格犬禁食不少于12 h,自由饮水;给药后4 h统一进食(包括多次给药在内的所有组别,均在给药前禁食)。各单次灌胃组和多次灌胃组分别在给药第1天和第7 天的给药前和给药后0.25、0.5、1.0、2.0、3.0、4.0、6.0、8.0、12、24 h时经四肢静脉取血0.6 mL,单次静脉给药组于给药前和给药后5 min 和0.25、0.5、1.0、2.0、4.0、6.0、8.0、12、24 h时经四肢静脉取血0.6 mL,置于EDTAK2抗凝试管中,以3 500 r/min离心10 min,取上清液,按“2.4”项下方法处理,再按“2.1”“2.2”项下条件进样分析,记录峰面积。采用Phoenix WinNonlin 8.0软件的非房室模型计算各组比格犬给药后的药动学参数,再用Graph-Pad Prism 8.0软件绘制各组比格犬给予SYHA1809后的平均血药浓度-时间曲线。结果见图2、图3、表3。
表3 各组比格犬给予SYHA1809后的药动学参数比较(±s,n=6)
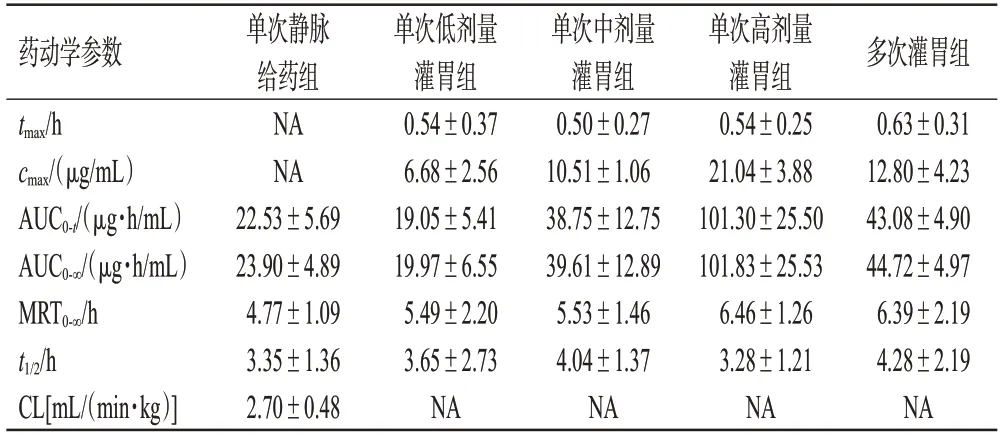
表3 各组比格犬给予SYHA1809后的药动学参数比较(±s,n=6)
NA:无相应数据。
药动学参数tmax/h cmax/(μg/mL)AUC0-t/(μg·h/mL)AUC0-∞/(μg·h/mL)MRT0-∞/h t1/2/h CL[mL/(min·kg)]单次静脉给药组NA NA 22.53±5.69 23.90±4.89 4.77±1.09 3.35±1.36 2.70±0.48单次低剂量灌胃组0.54±0.37 6.68±2.56 19.05±5.41 19.97±6.55 5.49±2.20 3.65±2.73 NA单次中剂量灌胃组0.50±0.27 10.51±1.06 38.75±12.75 39.61±12.89 5.53±1.46 4.04±1.37 NA单次高剂量灌胃组0.54±0.25 21.04±3.88 101.30±25.50 101.83±25.53 6.46±1.26 3.28±1.21 NA多次灌胃组0.63±0.31 12.80±4.23 43.08±4.90 44.72±4.97 6.39±2.19 4.28±2.19 NA

图2 比格犬静脉给药后血浆中SYHA1809的平均血药浓度-时间曲线(n=6)

图3 比格犬单次及多次灌胃给药后血浆中SYHA1809的平均血药浓度-时间曲线(n=6)
由表3可知,静脉注射给药后,SYHA1809在比格犬体内的CL为(2.70±0.48) mL/(min·kg),相当于比格犬肝脏血流量[约31 mL/(min·kg)[11]]的8.7%;稳态分布体积(steady-state distribution volume,Vss)为0.757 L/kg,高于比格犬体液总量(0.6 L/kg[11]);t1/2为(3.35±1.36) h,表明SYHA1809在比格犬体内清除率低,广泛分布于比格犬体内。单次灌胃给药后,低、中、高剂量的SYHA1809在比格犬体内的平均tmax为(0.53±0.02) h,血药浓度随给药剂量的增加而升高,3 个剂量的cmax分别为(6.68±2.56)、(10.51±1.06)、(21.04±3.88)μg/mL,给药24 h后均降至峰浓度的1/20 以下。单次灌胃给予3.75 mg/kg的SYHA1809 后,以AUC0-∞计算SYHA1809 的绝对生物利用度为83.5%,表明SYHA1809 灌胃给药的生物利用度高。另外,在3.75~15 mg/kg剂量范围内,SYHA1809的cmax和AUC增加与剂量呈正相关,cmax增加比例略低于剂量增加比例,AUC 增加比例略高于剂量增加比例(回归方程斜率为0.90~1.10 时,判断为正相关[12])。SYHA1809 连续以7.5 mg/kg 灌胃7 d 后,与同剂量单次灌胃给药后的药动学参数相当,差异无统计学意义(P>0.05),其中cmax、AUC0-t分别为同剂量单次灌胃给药后的1.22、1.11 倍,表明SYHA1809 在比格犬体内无明显蓄积。
3 讨论
本研究建立了测定比格犬血浆中SYHA1809 含量的LC-MS/MS 法,血浆样品经沉淀蛋白处理后,采用加热电喷雾电离源,以SRM 扫描方式进行定量分析。结果显示,血浆样品中的内源性物质不干扰SYHA1809的测定,SYHA1809的检测线性范围为20~20 000 ng/mL,表明本方法具有快速、准确、灵敏度高的特点,可用于SYHA1809在比格犬体内的药动学研究。
HIF-PHD抑制剂是目前极具潜力的贫血治疗药物。在临床前药动学研究中,Roxadustat 在动物体内吸收速度快、半衰期较短、分布容积小[13—14]。SYHA1809的药动学行为与Roxadustat相似,静脉给药后,SYHA1809在比格犬体内为低清除药物,CL 约为比格犬肝脏血流量的8.7%,且Vss较高,体内分布广泛;灌胃给药后,SYHA1809在比格犬体内的吸收速度很快,1 h内即可达峰,t1/2约为3~5 h;当灌胃3.75 mg/kg 的SYHA1809 后,其绝对生物利用度为83.5%。3.75~15 mg/kg 的SYHA1809 单次灌胃给药后在比格犬体内为非线性动力学过程。7.5 mg/kg的SYHA1809连续灌胃7 d后与同剂量单次灌胃给药后相比,其在比格犬体内无明显蓄积。
综上所述,小分子抑制剂SYHA1809在比格犬体内吸收迅速,血药浓度呈剂量依赖性,生物利用度高,多次灌胃给药后无明显蓄积,药动学行为良好。
(利益声明:本文作者无利益冲突)

