穿心莲内酯对糖尿病足大鼠血管生成的影响及机制Δ
张丽晓 ,戴守方 ,李 蕾 ,王瑞锋 ,杨丽丽 ,邱金霞 ,尹永波 (1.邢台市人民医院中医内科,河北 邢台 05000;.邢台市人民医院放射科,河北 邢台 05000;.邢台市人民医院内分泌科,河北 邢台 05000;.邢台市人民医院耳鼻喉科,河北 邢台 05000)
糖尿病足与糖尿病神经病变、外周血管疾病有关,是1 型和2 型糖尿病最常见的慢性并发症之一,发病率有逐年增加的趋势;其特征是血管生成受损,如果治疗不当,严重时会导致患者截肢或引发脓毒血症,严重影响了患者的生活质量和生命健康[1—3]。促进血管生成及创面愈合是治疗糖尿病足的有效方法之一[4]。因此,研究糖尿病足的发病机制对于探索新的治疗药物具有重要意义。穿心莲内酯(andrographolide,Andro)具有抗炎、抗氧化和抗肿瘤等多种药理作用[5]。有研究发现,Andro 可通过降低糖尿病小鼠空腹血糖(fasting blood glucose,FBG)、甘油三酯、肾/体重比、血尿素氮、血清肌酐、24 h 尿蛋白,抑制氧化应激产物活性氧产生和增加促炎细胞因子,从而改善小鼠的糖尿病肾病[6]。Liang等[7]研究发现,Andro 通过减轻氧化应激、炎症和细胞凋亡能延缓糖尿病心肌病的进展。Hippo通路及其效应物Yes 相关蛋白(Yes-associated protein,YAP)在调节器官生长、组织修复和再生方面起着重要作用[8]。Hippo通路的活化使YAP 失活,从而抑制细胞存活、增殖和血管生成,该通路和YAP是血管生成和伤口愈合的关键调节因子[9—10],但尚不清楚Andro 能否通过调控Hippo-YAP 信号通路影响糖尿病足血管生成。因此,本研究主要探究Andro 对糖尿病足大鼠血管生成的影响以及其机制,以期为糖尿病足的治疗提供新的参考依据。
1 材料
1.1 主要仪器
ACCU-CHEK Performa 型卓越快速血糖仪购自美国罗氏生物科技公司;3100型全自动生化分析仪购自日本日立有限公司;H1-16K 型冷冻高速离心机购自湖南可成仪器设备有限公司;DM500型光学显微镜购自德国Leica仪器有限公司;FACSCalibur型流式细胞仪购自美国BD公司。
1.2 主要药品与试剂
Andro标准品(纯度≥98%,货号B20207)、维替泊芬(Hippo-YAP 信号通路特异性抑制剂,纯度为97%,货号S80258)均购自上海源叶生物科技有限公司;链脲佐菌素(货号S0130)购自上海宝曼生物科技有限公司;蛋白提取试剂盒(货号YT8951)购自北京伊塔生物科技有限公司;苏木精-伊红(HE)染色试剂盒(货号G1120-100)购自北京索莱宝科技有限公司;空腹胰岛素(fasting insulin,FINS)ELISA 试剂盒(货号FY-A014648)购自上海富雨生物科技有限公司;兔源缺氧诱导因子1α(hypoxiainducible factor 1α,HIF-1α)单克隆抗体(货号ab179483)、兔源血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体(货号ab32152)、兔源哺乳动物Ste20样激酶1(mammalian sterile20-like kinase 1,MST1)单克隆抗体(货号ab245190)、兔源磷酸化MST1(p-MST1)单克隆抗体(货号ab51134)、兔源大肿瘤抑制基因1(large tumor suppressor gene1,LATS1)单克隆抗体(货号ab243656)、兔源磷酸化LATS1(p-LATS1)单克隆抗体(货号ab111334)、兔源磷酸化YAP(p-YAP)单克隆抗体(货号ab76252)、兔源YAP单克隆抗体(货号ab81183)、兔源三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(货号ab9485)均购自美国Abcam 公司;辣根过氧化物酶标记羊抗兔免疫球蛋白G二抗(货号XY0650)购自上海信裕生物科技有限公司。
1.3 实验动物
SPF 级SD 大鼠,5~7 周龄,雌雄各半,体重180~200 g,购自武汉云克隆动物有限公司,生产许可证编号为SCXK(鄂)2018-0021。设置饲养温度为22 ℃,湿度为55%~60%,12 h光暗循环适应性喂养1周。
2 方法
2.1 动物建模、分组和给药
将90 只大鼠随机分成Control 组(12 只)和建模组(78 只),各组大鼠雌雄各半。Control 组用普通饲料喂养。建模组参考相关文献[11],采用小剂量链脲佐菌素联合高脂高糖饮食复制2型糖尿病大鼠模型,高脂高糖饮食喂养4周后,按35 mg/kg一次性腹腔注射0.3%链脲佐菌素(Control 组按10 mL/kg 注射等体积的柠檬酸-柠檬酸钠缓冲液),注射后3、7、10 d 取尾静脉血测量大鼠FBG,连续3 次测得FBG≥16.7 mmol/L,则为糖尿病模型造模成功。在此基础上,采用烫伤法建立糖尿病足大鼠模型[12]:将糖尿病模型大鼠用普通饲料喂养4周后,按30 mg/kg 腹腔注射3%戊巴比妥钠,用恒温恒压电热烫伤仪在压力为0.5 kg、温度为80 ℃、作用时间为4 s的设置下,在大鼠右后肢足背造成烫伤,深至皮下,观察烫伤处皮肤出现苍白、肿胀、破溃等症状;Control组同法进行烫伤处理。将建模成功的大鼠(共60 只)随机分为Model 组,Andro 低、中、高剂量组和抑制剂组,每组12只。Andro 低、中、高剂量组分别灌胃1、10、20 mg/kg 的Andro溶液[7]和腹腔注射等体积的生理盐水,抑制剂组灌胃20 mg/kg 的Andro 溶液和腹腔注射100 mg/kg 的维替泊芬[13],每日1次,连续给药2周;Control组、Model组灌胃和腹腔注射等体积的生理盐水。
2.2 大鼠创面愈合情况的检测
在造模及给药期间对大鼠创面边缘进行测量并拍照,采用Image Pro Plush 6.0 图像分析系统对创面面积进行测定,并计算创面愈合率。创面愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
2.3 大鼠FBG及FINS含量的测定
药物处理结束后,大鼠禁食不禁水12 h,剪尾取血,用卓越快速血糖仪测定大鼠的FBG。腹腔注射3%戊巴比妥钠麻醉大鼠后,腹主动脉取血,离心后得到血清,于-20 ℃保存。严格按照FINS ELISA试剂盒说明书测量大鼠的FINS含量。
2.4 大鼠创面组织损伤及毛细血管数的检测
药物处理结束后,腹腔注射3%戊巴比妥钠麻醉大鼠,分离大鼠创面组织及创面周边肉芽组织,部分创面及创面周边肉芽组织在4%多聚甲醛中过夜固定,经蔗糖梯度脱水、石蜡包埋后切片(3 µm)。切片经二甲苯、乙醇脱蜡和水化,以HE染色,然后在显微镜下观察染色结果并拍照,录入MPIAS-400 彩色病理图文分析系统,观察毛细血管数。
2.5 大鼠外周血内皮祖细胞数量的检测
药物处理结束后,大鼠腹主动脉取血,用流式细胞仪检测大鼠外周血内皮祖细胞(endothelial progenitor cells,EPCs)数量,具体操作参考文献[14]。结果以EPCs数量占外周血单核细胞数量的百分比表示。
2.6 大鼠血清生化指标的检测
取“2.3”项下血清,用全自动生化分析仪检测各组大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)的含量。
2.7 大鼠创面组织中HIF-1α、VEGF 及Hippo-YAP 信号通路相关蛋白表达的检测
采用Western blot 法进行检测。提取6 只大鼠创面组织总蛋白,对蛋白进行定量后变性处理。取变性后的蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转至聚偏二氟乙烯膜上,在室温条件下封闭2 h;加入HIF-1α、VEGF、MST1、p-MST1、LATS1、p-LATS1、p-YAP、YAP、GAPDH 一抗(p-MST1 的稀释比例为1∶2 000,其余一抗稀释比例均为1∶1 000),4 ℃孵育过夜,洗膜后加入二抗(稀释比例为1∶2 000),37 °C孵育90 min;洗膜后显影,以Image J软件分析蛋白条带的灰度值。以HIF-1α、VEGF 蛋白与内参蛋白(GAPDH)条带的灰度值比值表示上述蛋白的表达水平,以p-MST1 与MST1、p-LATS1与LATS1、p-YAP 与YAP 蛋白条带的灰度值比值表示MST1、LATS1、YAP蛋白的磷酸化水平。
2.8 统计与分析
采用SPSS 25.0 软件对数据进行统计分析,计量资料以±s表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 Andro对大鼠创面愈合情况的影响
Control组,Model组,Andro低、中、高剂量组及抑制剂组大鼠创面愈合率分别为(42.75±2.31)%、(19.65±1.24)% 、(23.68±1.37)% 、(27.83±1.51)% 、(34.26±2.04)%、(21.59±1.26)%。与Control 组比较,Model 组大鼠创面愈合率显著降低(P<0.05);与Model 组比较,Andro 低、中、高剂量组大鼠创面愈合率显著升高,且呈剂量依赖性(P<0.05);与Andro 高剂量组比较,抑制剂组大鼠创面愈合率显著降低(P<0.05)。
3.2 Andro对大鼠FBG及FINS含量的影响
与Control 组比较,Model 组大鼠FBG、FINS 含量均显著升高(P<0.05);与Model 组比较,Andro 低、中、高剂量组大鼠FBG、FINS含量均显著降低,且呈剂量依赖性(P<0.05);与Andro 高剂量组比较,抑制剂组大鼠FBG、FINS含量均显著升高(P<0.05),结果见表1。
表1 各组大鼠FBG 及FINS 含量的测定结果(±s,n=12)

表1 各组大鼠FBG 及FINS 含量的测定结果(±s,n=12)
a:与Control组比较,P<0.05;b:与Model组比较,P<0.05;c:与Andro低剂量组比较,P<0.05;d:与Andro中剂量组比较,P<0.05;e:与Andro高剂量组比较,P<0.05。
FINS/(mU/L)15.37±1.12 37.52±2.65a 32.10±2.14b 25.45±1.48bc 18.64±1.21bcd 30.25±2.08e分组Control组Model组Andro低剂量组Andro中剂量组Andro高剂量组抑制剂组FBG/(mmol/L)4.67±0.64 19.38±1.36a 16.52±1.21b 12.37±1.04bc 6.87±0.79bcd 17.65±1.34e
3.3 Andro对大鼠创面组织损伤及毛细血管数的影响
Control 组大鼠创面组织结构正常,细胞排列有序,毛细血管数较多;与Control 组比较,Model 组大鼠创面组织结构不完整,有大量炎症细胞浸润,毛细血管数显著减少(P<0.05);与Model 组比较,Andro 低、中、高剂量组大鼠创面组织结构稍显完整,炎症细胞浸润减少,毛细血管数显著增加,且呈剂量依赖性(P<0.05);与Andro 高剂量组比较,抑制剂组大鼠创面组织结构损伤严重,炎症细胞浸润增加,毛细血管数显著减少(P<0.05),结果见图1和表2。
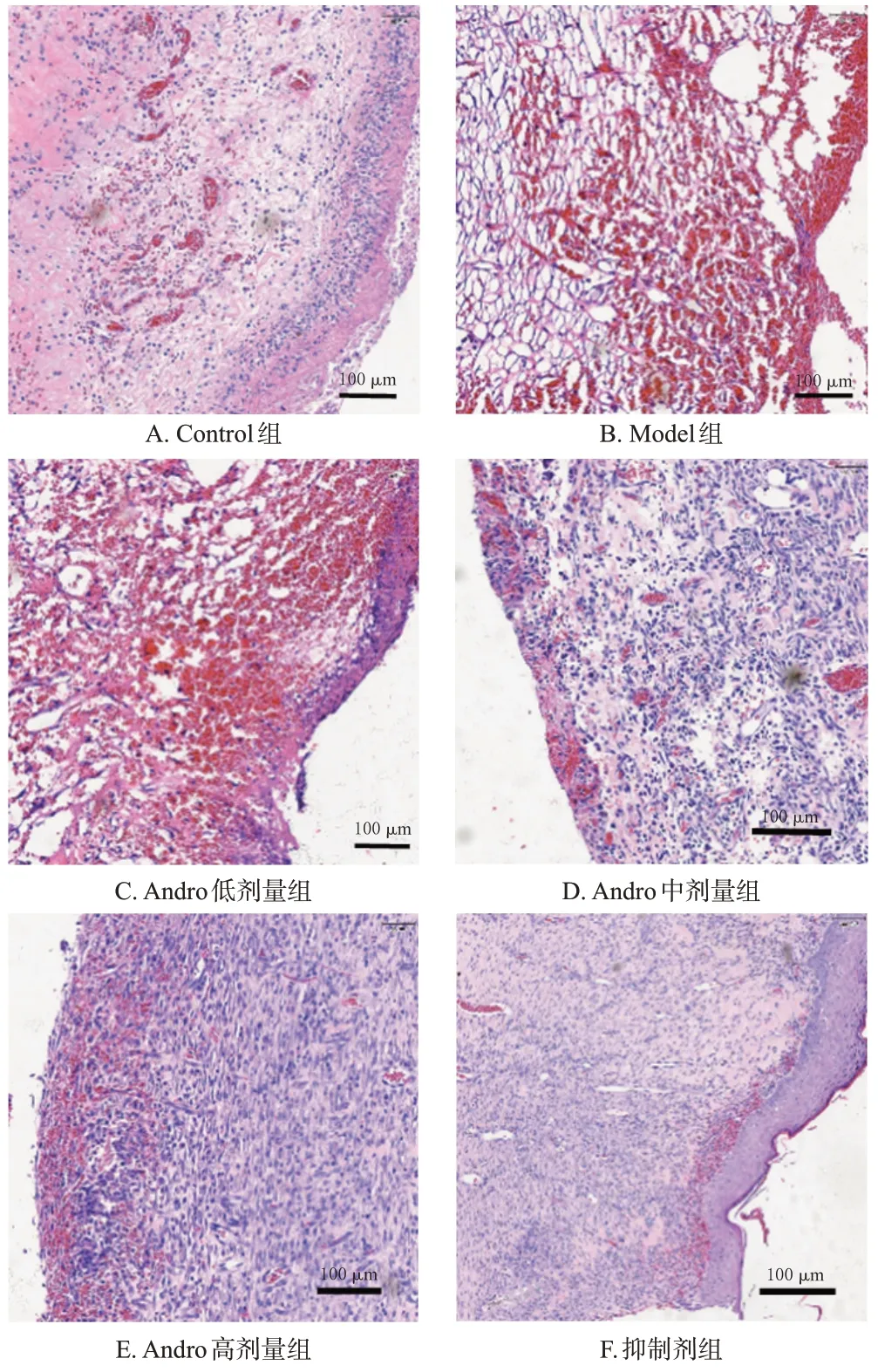
图1 各组大鼠创面组织HE染色图
表2 各组大鼠毛细血管数、EPCs比例的检测结果(±s,n=12)
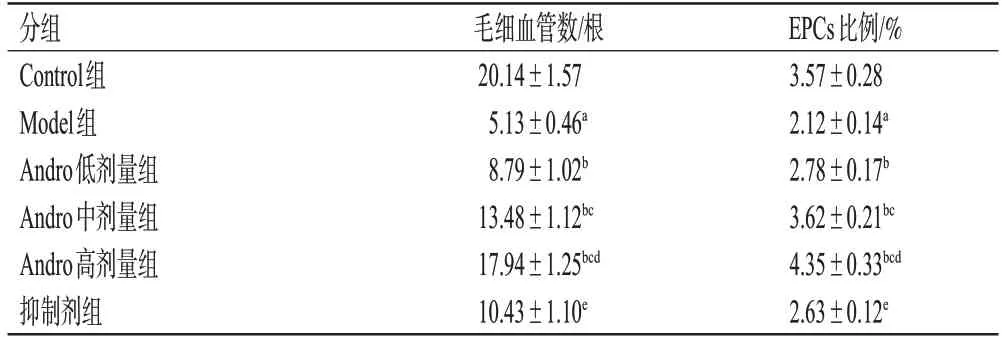
表2 各组大鼠毛细血管数、EPCs比例的检测结果(±s,n=12)
a:与Control组比较,P<0.05;b:与Model组比较,P<0.05;c:与Andro低剂量组比较,P<0.05;d:与Andro中剂量组比较,P<0.05;e:与Andro高剂量组比较,P<0.05。
EPCs比例/%3.57±0.28 2.12±0.14a 2.78±0.17b 3.62±0.21bc 4.35±0.33bcd 2.63±0.12e分组Control组Model组Andro低剂量组Andro中剂量组Andro高剂量组抑制剂组毛细血管数/根20.14±1.57 5.13±0.46a 8.79±1.02b 13.48±1.12bc 17.94±1.25bcd 10.43±1.10e
3.4 Andro对大鼠外周血EPCs数量的影响
与Control 组比较,Model 组大鼠EPCs 比例显著降低(P<0.05);与Model 组比较,Andro 低、中、高剂量组大鼠EPCs 比例均显著升高,且呈剂量依赖性(P<0.05);与Andro高剂量组比较,抑制剂组大鼠EPCs比例显著降低(P<0.05),结果见图2和表2。

图2 各组大鼠外周血EPCs数量检测的流式细胞图
3.5 Andro 对大鼠血清中TC、TG、HDL-C、LDL-C 含量的影响
与Control 组比较,Model 组大鼠TC、TG、LDL-C 含量均显著升高(P<0.05),HDL-C 含量均显著降低(P<0.05);与Model组比较,Andro低、中、高剂量组大鼠TC、TG、LDL-C 含量均显著降低,HDL-C 含量均显著升高,且呈剂量依赖性(P<0.05);与Andro 高剂量组比较,抑制剂组大鼠TC、TG、LDL-C含量均显著增加,HDL-C含量显著降低(P<0.05),结果见表3。
表3 各组大鼠血清中TC、TG、HDL-C、LDL-C含量的检测结果(±s,n=12,mmol/L)
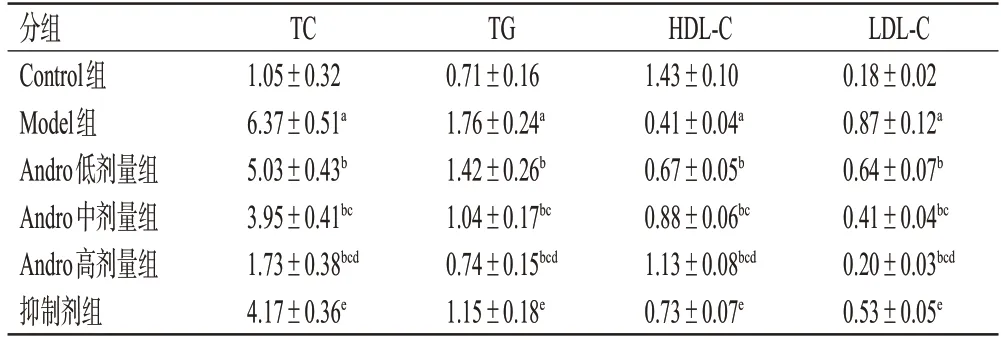
表3 各组大鼠血清中TC、TG、HDL-C、LDL-C含量的检测结果(±s,n=12,mmol/L)
a:与Control组比较,P<0.05;b:与Model组比较,P<0.05;c:与Andro低剂量组比较,P<0.05;d:与Andro中剂量组比较,P<0.05;e:与Andro高剂量组比较,P<0.05。
分组Control组Model组Andro低剂量组Andro中剂量组Andro高剂量组抑制剂组TC 1.05±0.32 6.37±0.51a 5.03±0.43b 3.95±0.41bc 1.73±0.38bcd 4.17±0.36e TG 0.71±0.16 1.76±0.24a 1.42±0.26b 1.04±0.17bc 0.74±0.15bcd 1.15±0.18e HDL-C 1.43±0.10 0.41±0.04a 0.67±0.05b 0.88±0.06bc 1.13±0.08bcd 0.73±0.07e LDL-C 0.18±0.02 0.87±0.12a 0.64±0.07b 0.41±0.04bc 0.20±0.03bcd 0.53±0.05e
3.6 Andro 对大鼠创面组织中HIF-1α、VEGF 及Hippo-YAP信号通路相关蛋白表达的影响
与Control 组比较,Model 组大鼠创面组织中HIF-1α、VEGF 蛋白表达水平,MST1、LATS1、YAP 蛋白的磷酸化水平均显著降低(P<0.05);与Model组比较,Andro低、中、高剂量组大鼠创面组织中HIF-1α、VEGF蛋白表达水平,MST1、LATS1、YAP 蛋白的磷酸化水平均显著升高,且呈剂量依赖性(P<0.05);与Andro 高剂量组比较,抑制剂组大鼠创面组织中HIF-1α、VEGF 蛋白表达水平,MST1、LATS1、YAP 蛋白的磷酸化水平均显著降低(P<0.05)。结果见图3和表4。
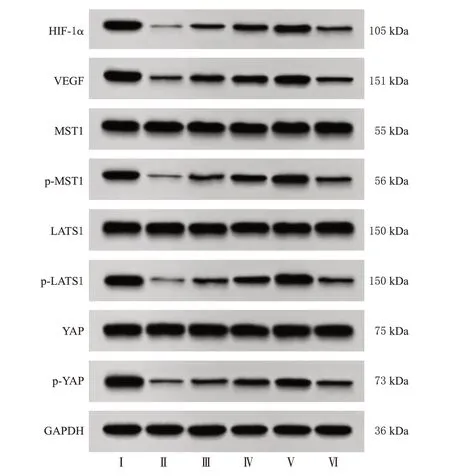
图3 各组大鼠创面组织中HIF-1α、VEGF 及Hippo-YAP信号通路相关蛋白表达的电泳图
表4 各组大鼠创面组织中HIF-1α、VEGF 及Hippo-YAP信号通路相关蛋白表达情况比较(±s,n=6)
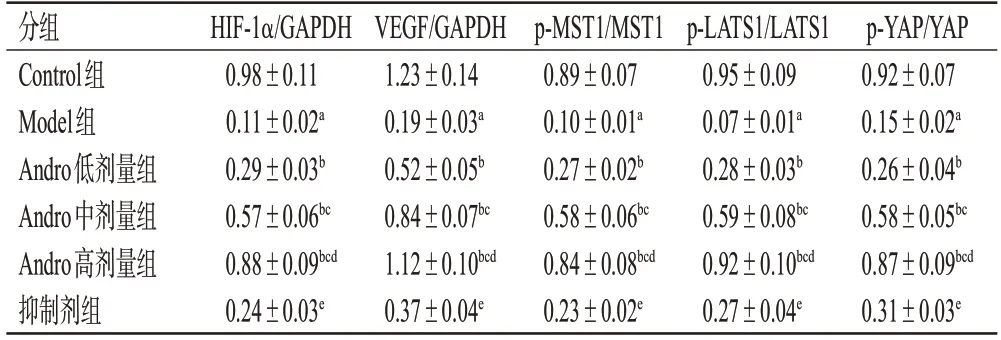
表4 各组大鼠创面组织中HIF-1α、VEGF 及Hippo-YAP信号通路相关蛋白表达情况比较(±s,n=6)
a:与Control组比较,P<0.05;b:与Model组比较,P<0.05;c:与Andro低剂量组比较,P<0.05;d:与Andro中剂量组比较,P<0.05;e:与Andro高剂量组比较,P<0.05。
分组Control组Model组Andro低剂量组Andro中剂量组Andro高剂量组抑制剂组HIF-1α/GAPDH 0.98±0.11 0.11±0.02a 0.29±0.03b 0.57±0.06bc 0.88±0.09bcd 0.24±0.03e VEGF/GAPDH 1.23±0.14 0.19±0.03a 0.52±0.05b 0.84±0.07bc 1.12±0.10bcd 0.37±0.04e p-MST1/MST1 0.89±0.07 0.10±0.01a 0.27±0.02b 0.58±0.06bc 0.84±0.08bcd 0.23±0.02e p-LATS1/LATS1 0.95±0.09 0.07±0.01a 0.28±0.03b 0.59±0.08bc 0.92±0.10bcd 0.27±0.04e p-YAP/YAP 0.92±0.07 0.15±0.02a 0.26±0.04b 0.58±0.05bc 0.87±0.09bcd 0.31±0.03e
4 讨论
糖尿病足是糖尿病的严重并发症,也是糖尿病患者住院的最常见原因之一。糖尿病足发生的常见危险因素包括血糖控制不良、周围神经病变、外周血管疾病和免疫抑制等,具有伤口极易感染、较难愈合、反复发作等特点[15]。糖尿病足患者伤口愈合延迟的关键因素是局部新生毛细血管生成和外周血流的减少。因此,促进血管新生及创面愈合、改善并恢复足部血流是治疗糖尿病足的关键。大量研究表明,二甲双胍可通过减少炎症、氧化应激、减轻局部胰岛素抵抗和促进血管生成等促进创面愈合,但也有研究表明二甲双胍能通过抑制角质细胞增殖延长创面愈合时间[16]。此外,尚未有研究表明二甲双胍可以通过调节Hippo-YAP 信号通路促进糖尿病足大鼠血管生成,因此本研究未用二甲双胍作为阳性对照药物进行研究。
Andro是从草本植物穿心莲中分离出来的一种二萜类化合物,具有广泛的药理活性[5]。近年来研究发现,Andro 能够通过抑制氧化应激与炎症反应,改善糖尿病肾病、糖尿病心肌病[6—7]。此外有研究发现,Andro 具有一定的糖代谢调节能力,与没食子酸联用可显著降低链脲佐菌素诱导的糖尿病大鼠的血糖[17—18]。本研究发现,Andro 能有效降低糖尿病足大鼠FBG、FINS、TC、TG、LDL-C 含量,显著增加HDL-C 含量,表明Andro 具有降低糖尿病足大鼠血糖、血脂的作用。由此推测,Andro可能对糖尿病足创面愈合有一定的积极作用。
HIF-1α/VEGF 轴功能受损是糖尿病相关血管生成障碍的主要机制。HIF-1是一种由翻译后调控的α-亚基和组成型表达的β-亚基组成的异源二聚体,被广泛认为是氧稳态的主要调节因子。在缺氧组织条件下,HIF-1α的羟基化作用减弱,导致HIF-1α蛋白不稳定,并启动多个对血管生成至关重要的基因表达,最明显的是VEGF[19]。糖尿病患者HIF-1α 的功能活性降低,这种变化导致VEGF 不能上调以应对软组织缺血,使血管生成和伤口愈合受损。研究已经证明,上调HIF-1α/VEGF轴可有效促进糖尿病足大鼠血管生成及伤口愈合[19]。EPCs 既能分化为内皮细胞,又能分泌生长因子、细胞因子和血管活性物质,促进血管生成,维持血管稳态[20]。EPCs 的数量和功能异常是判断糖尿病血管病变严重程度的一种可靠指标,也是导致患者伤口不愈合的关键因素[21]。本研究发现,糖尿病足大鼠创面组织中HIF-1α、VEGF 蛋白表达水平,创面愈合率,毛细血管数和外周血中EPCs比例均明显降低,而给予Andro后则显著提高了糖尿病足大鼠创面组织中HIF-1α、VEGF 蛋白表达水平,创面愈合率,毛细血管数和外周血中EPCs 比例,提示Andro具有促进糖尿病足大鼠血管生成及伤口愈合的作用。
Hippo-YAP 信号通路包含MST1/2、调节蛋白和LATS1/2。YAP 和带有PDZ 结合基序的转录辅激活因子是Hippo 通路的主要下游效应物。MST1/2 磷酸化并激活LATS1/2,LATS1/2 在Ser-127 或Ser-381 位点磷酸化YAP,导致其细胞质保留和降解,并随后抑制其靶基因转录。研究发现,中性粒细胞胞外陷阱可抑制Hippo-YAP 信号通路,使YAP 与转录因子Smad2 结合,并从细胞质转移到细胞核,从而促进内皮-间充质转化,最终阻碍糖尿病足小鼠血管生成并延迟伤口愈合[22]。本研究发现,Andro 可提高糖尿病足大鼠创面组织中MST1、LATS1、YAP蛋白的磷酸化水平,提示Andro可能通过激活Hippo-YAP信号通路,从而起到促进糖尿病足大鼠血管生成及创面愈合的作用;使用Hippo-YAP信号通路抑制剂维替泊芬后,减少了Hippo-YAP信号通路蛋白的表达,减弱了Andro对血管生成及创面愈合的促进作用,再次说明了Andro 可能通过激活Hippo-YAP 信号通路,促进糖尿病足大鼠血管生成及创面愈合。
综上所述,Andro 具有降低糖尿病足大鼠血糖、血脂,促进糖尿病足大鼠血管生成及创面愈合的作用,其作用机制可能与激活Hippo-YAP 信号通路有关。然而本研究尚存在不足之处,仅验证了Andro 对Hippo-YAP信号通路的作用,未对其他靶点、途径进行验证,后续研究将会进一步明确Andro在糖尿病足中的作用机制。

