基于美国FAERS 数据库对未成年人群肝衰竭ADE 信号的挖掘与分析Δ
李 冰 ,梁 力 ,陈 燕 ,郭宇航 ,刘 霞 ,郭晋敏 #(.中国人民解放军联勤保障部队第九六〇医院临床药学科,济南 5003;.海军军医大学药学院临床药学教研室,上海 00433)
药源性肝损伤(drug-induced liver injury,DILI)作为一种常见的药物不良反应越来越引起人们重视,成为发达国家急性肝功能衰竭(acute liver failure,ALF)的首要病因,也是美国FDA对临床用药采取警示的最常见原因之一[1]。据报道,目前世界范围内含潜在肝损伤且已上市的药物超过1 100种,涵盖中草药、保健药及药物的赋形剂等[2]。DILI可表现为已知的各种类型的急慢性肝疾病,其中急性肝损伤占比达到90%,有3%~10%可进展成慢性肝疾病,患者会出现肝硬化、长期肝功能异常,少数患者可发生威胁生命的暴发性或重症肝功能衰竭。ALF 是DILI 较严重的类型,病理机制复杂、病情进展迅猛,可引起肝性脑病、多系统衰竭等并发症,病死率高达30%[3]。近年来,有文献报道部分药物存在肝衰竭毒性反应,如异烟肼、利福平、对乙酰氨基酚等[4],肝衰竭作为罕见不良反应值得更多关注。
未成年人这个特殊用药群体处于生长发育的关键阶段,由于身体器官未发育成熟,导致对药物的敏感性增强。与成人相比,未成年人更易发生药物损害,进而导致未成年人和成人在药物疗效、毒性及给药方案等方面的差异[5]。
美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)是目前应用于药品不良反应监测的自发呈报数据库之一,因其自发性、自愿性和公开性而被用于开展药物不良事件(adverse drug event,ADE)信号挖掘研究。该系统包含的美国和其他地区的卫生专业人员、消费者、律师和药品生产企业提交的不良反应和用药错误报告信息,在一定程度上反映了真实世界中ADE 的发生情况[6]。本研究采用比例失衡法对美国FAERS 数据库中未成年人群因药物引起的肝衰竭进行分析,挖掘更多潜在的肝衰竭ADE信号,以期为未成年人群的临床合理用药提供参考。
1 资料与方法
1.1 数据来源
美国FAERS数据库中的ADE和用药错误术语依据《监管活动医学词典》(MedicalDictionaryforRegulatory Activities,MedDRA)进行编码[7]。本研究数据来源于美国FAERS 数据库中2013 年第1 季度-2022 年第3 季度的数据,检索出39 个季度期间年龄小于18 岁人群的ADE 报告,剔除重复数据,并采用MedexUIMA 1.3.7 系统对数据表的药物名称进行标准化。
1.2 “0~18岁不同年龄段人群”和“肝衰竭”的定义
以美国FAERS 数据库中的变量“age”为检索范围,检索患者年龄0~18 岁(不含18 岁)的ADE,按照WHO年龄划分规则[8],对年龄段进行分层分析:≤1 岁为婴儿,>1~<6 岁为幼儿,6~<12 岁为儿童,12~<18 岁为少年,提取到相应人群的ADE报告记录。
标准MedDRA 分析查询(standardized MedDRA queries,SMQ)由若干组MedDRA 组成。本研究以首选术语(preferred term,PT)为单位[9],查询SMQ 为肝衰竭、肝纤维化、肝硬化以及其他涉及肝损伤的病症(编码20000013)中有关肝衰竭的所有PT,得到急性肝衰竭、慢性肝衰竭急性加重、慢性肝功能衰竭、肝衰竭、肝肾衰竭和亚急性肝功能衰竭共6 个PT。以上述6 个PT 为检索词,筛选未成年人群肝衰竭的ADE报告。
1.3 药物ADE信号检测方法
本研究采用比例失衡法进行ADE信号分析,包括报告比值比(reporting odds ratio,ROR)法、比例报告比值(proportional reporting ratio,PRR)法和贝叶斯置信区间递进神经网络(Bayesian confidence propagation neural network,BCPNN)法。当ROR 法满足报告数≥3、95%置信区间(confidence interval,CI)下限≥1 时,提示检出1个风险信号;当PRR≥2且χ2≥4时,提示检出1个风险信号[10];BCPNN法的信号检测指标为信息成分(information component,IC)值,其阳性信号生成条件为IC 下限(即IC-2SD)>0。BCPNN法灵敏度一般但特异度较高,能减少ROR法检出的假阳性信号。本研究要求需同时满足以上条件,才能确认生成1个有效信号,信号一旦生成即提示目标药物与肝衰竭之间存在统计学关联[11]。统计分析采用R语言软件和Microsoft Excel 2016软件,计数资料采用例数(占比)描述,检验水准α=0.05。
2 结果
2.1 ADE报告基本情况
美国FAERS 数据库2013 年第1 季度-2022 年第3季度共收录ADE报告12 391 896份,去除成年人群(n=12 000 869),得到未成年人群ADE报告391 027份,采用“1.2”项下6个PT检索词检索出与肝衰竭相关的ADE报告1 412份。经去重等筛选后,得到与目标ADE相关的药物248种、ADE报告1 398份,其中判定为有效信号的相关药物60种、ADE报告1 051份。
2.2 人口学基本特征
1 051例发生肝衰竭ADE的未成年人的人口学信息见表1。在性别方面,男性患儿占52.14%,女性患儿占41.20%,两者之间无明显差异;年龄方面,12~<18岁的少年发生率最高(410 例,占39.01%),其次是幼儿(297例,占28.26%);ADE 报告主要来自美国、法国及德国;56.04%的报告来源于卫生专业人员。
2.3 肝衰竭ADE信号检测结果
本研究筛选出涉及肝衰竭风险的药物,与说明书比对,主要分为3类:(1)说明书中明确提及有肝衰竭风险——9 个药物,报告例数496 例(占47.19%)。(2)说明书中未提及肝衰竭风险,但提及了肝胆系统损伤——37个药物,报告例数390例(占37.11%)。(3)说明书中未提及肝胆系统损伤和肝衰竭风险——14个药物,报告例数165例(占15.70%)。具体信息见表2。
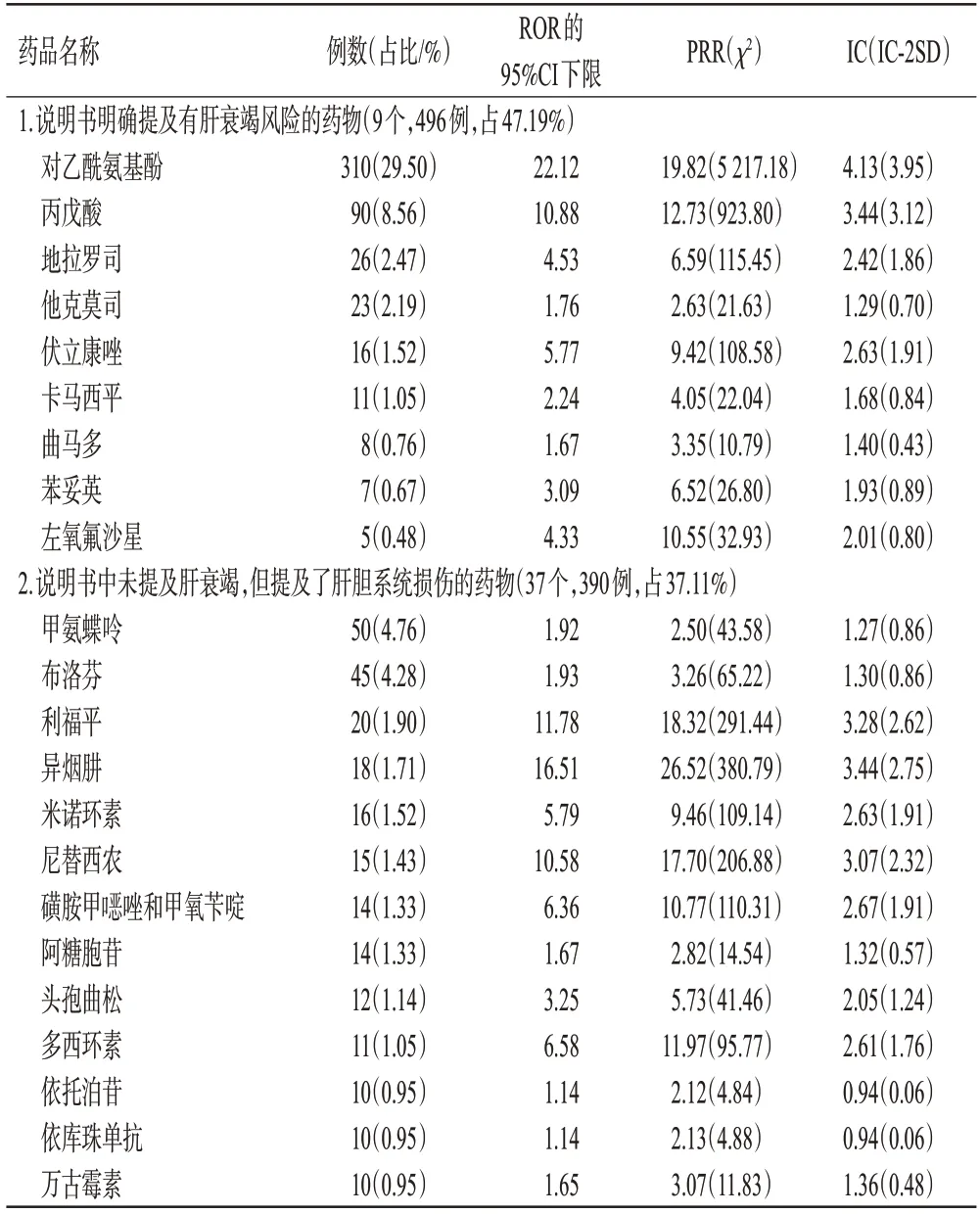
表2 肝衰竭相关ADE信号
2.4 肝衰竭转归情况
临床转归结果显示,发生死亡和住院或住院时间延长的病例数量较多。在不同年龄层次,转归结果存在差异性。其中,幼儿病例中,死亡病例数位列第一,其次为住院或住院时间延长;婴儿、儿童和少年病例中,以住院或住院时间延长为主,见图1。这提示对于幼儿而言,发生肝衰竭的预后更差。

图1 未成年人群肝衰竭转归情况
临床结局为死亡的病例共317 例,占总报告数的30.16%;威胁生命的病例有224 例,占总报告数的21.31%。肝衰竭病例结局为死亡和威胁生命的ADE报告例数排前5位的药物如表3所示。由表3可知,临床结局为死亡的药物中丙戊酸位列第一,占肝衰竭死亡报告总数的15.14%,在单药病例中占比达到53.33%(48/90);甲硝唑作为一个新的ADE信号,虽上报例数仅13例,但在单药病例中的占比达到了72.22%(13/18),应引起重视。在结局为威胁生命的病例中,左乙拉西坦作为新的ADE信号值得关注,其单药占比为22.58%(7/31)。

表3 肝衰竭病例结局为死亡和威胁生命的ADE 报告例数排前5位的药物
3 讨论
DILI 用于描述常用药物可能对肝脏造成的意外损害。肝脏易受药物不良反应影响的主要原因可能是肝脏在进入胃肠道的外源性物质的生物转化(代谢)中起核心作用[2]。与药物有关的肝毒性根据化合物的作用机制被经典地分为固有的和特异的。固有的DILI 与剂量相关,在大多数暴露于药物的个体中,在暴露后不久(数小时至数天)发生,药物在给定阈值水平下是有毒的。相比之下,特异的DILI(间接或不可预测)变化由环境、宿主因素与药物的相互作用决定[12],通常在每10 000名暴露个体中发生的人数<1 人,并且具有更长的潜伏期(从几天到几个月)。特异性DILI 的结局可能是非常严重的,在某些情况下是致命的。因此,研究药物所致肝衰竭是十分重要的。对于未成年人群,尤其是婴幼儿的各个系统发育不全,免疫功能低下,抗感染能力较弱,而肝衰竭病情危重,相关并发症的发生会极大增加治疗难度,影响临床治疗效果,因此临床应提高对肝衰竭的识别和处理能力,采取积极措施降低并发症的发生率,从而改善患儿预后。本研究从美国FAERS 数据库中挖掘未成年人群目标不良事件的药物警戒信号,筛选出可疑的肝衰竭高风险药物,旨在为临床提供参考。
3.1 新的ADE信号
本研究发现未成年人群肝衰竭的有效信号涉及60个药物,其中14个是药品说明书未提及肝胆系统损伤和肝衰竭风险的新的药物警戒信号,涉及ADE 报告165例,占报告总数的15.70%。
这60 个药物中,除二甲双胍外,其他药物主要经肝代谢,存在一定的肝损伤风险和进展为肝衰竭的可能性。如Selvaraj 等[13]报道1 例左乙拉西坦导致肝功能衰竭的可疑病例;Tsien等[14]报道1例小儿患者接受托吡酯治疗后,表现为ALF、显著的凝血功能障碍和高氨血症,而停用托吡酯后,临床指标得以改善,患儿的ALF 和高氨血症被认为是托吡酯毒性的结果;孙颖等[15]报道了甲硝唑注射液致肝衰竭;甲泼尼龙也有导致患者肝损伤的案例[16];一项日本的临床研究中发现替沙仑赛可导致肝功能异常[17];过量硫酸亚铁可导致儿童肝损害,与对乙酰氨基酚机制相同[18];白消安治疗窗窄,易引起肝损伤不良反应[19],等等。
二甲双胍作为降糖的一线用药,不经肝脏代谢,一般认为无肝毒性[20]。但在本研究中发现二甲双胍存在肝衰竭风险。进一步挖掘相关病例资料,发现相关病例均有胰岛素抵抗基础疾病,但胰岛素抵抗与肝衰竭风险是否存在因果关系未见相关报道;而患儿均为单药使用,无联合用药,无其他肝衰竭高危药物的叠加影响,可以排除患儿基础疾病和合并用药的影响。通过文献检索,未见二甲双胍导致肝衰竭的报道,但吴璟玲等[21]报道1例50岁女性患者因糖尿病自行口服二甲双胍,出现皮肤、巩膜黄染和乏力,排除相关因素后,考虑为二甲双胍导致的肝损伤。从药动学考虑,二甲双胍虽经肾代谢,但当患者本身具有肝脏基础疾病时,有可能会影响到乳酸的清除能力,造成乳酸堆积,发生乳酸酸中毒,也在一定程度上加大了肝衰竭风险[22]。这提示肝肾功能受损者的血清转氨酶超过3倍正常上限值时应避免使用二甲双胍,肾功能不全的患者需通过估算肾小球滤过率水平调整药物剂量[23]。
3.2 肝衰竭风险病例临床结局分析
药物引起的肝衰竭预后通常较差,如不进行肝移植,肝衰竭的病死率可达80%[23]。本研究发现的新的信号中,甲硝唑临床结局为死亡的例数排在第5 位,72.22%(13/18)的病例均为单独用药,不存在其他联合用药,所以该药更加值得关注。具体分析其适应证,87.50%病例的适应证为腹泻、口腔感染,无肝衰竭基础疾病风险;另外,在18 例报告中,有56.25%的病例使用剂量符合说明书规定,43.75%的剂量缺失,故从用药剂量无法评估肝衰竭风险。因此,未成年人群临床应用甲硝唑时,需高度重视其用法用量,根据年龄、体重计算药量,避免长时间使用该类药物,以减少肝衰竭ADE的发生。在结局为威胁生命的病例中,报告例数排在前5位的药物中,左乙拉西坦为新的信号,但其均存在与具有肝衰竭风险的药物联用的情况,如丙戊酸、卡马西平、阿昔洛韦等,这可能导致肝衰竭风险的叠加效应。
3.3 美国FAERS数据库的局限性
美国FAERS数据库中的ADE报告是自愿和自发报告,存在患者相关信息缺失的问题,如本研究中有6.66%的报告缺失患儿性别,59.66%(627/1 051)的报告缺失患儿用药剂量,报告的数量和质量难以控制,影响研究结果。本研究所得结果仅能反映真实世界中与肝衰竭相关的药物警戒信号,通过ROR 法检测出的ADE 信号只能表明药物与肝衰竭风险之间存在统计学关联,而非必然的因果关系[24],故仍需要更多的数据来验证信号的可信度和强弱;同时,应在临床上对这些药物的使用实施重点监测,并通过有效途径预警该类药物可能导致的肝衰竭风险。
综上,基于美国FAERS数据库对未成年人群中引起肝衰竭的药物进行数据挖掘,共有14个药物(左乙拉西坦、甲硝唑、托吡酯、甲泼尼龙、地塞米松、替沙仑赛、硫酸亚铁、二甲双胍、白消安、丙泊酚、onasemnogene abeparvovec、苯海拉明、奥美拉唑和sebeliesterase α)发现了新的风险信号。在使用这些药物时,应密切监测患儿肝功能,若其用药后出现转氨酶升高的情况,应给予及时处理,必要情况下需停药。其中二甲双胍既不经过肝脏代谢,也未见相关文献报道,其引发的肝衰竭风险值得进一步关注;甲硝唑和左乙拉西坦引起的临床结局较为严重,需要引起足够重视。

