化学酶法转化羟乙基芦丁合成槲皮素
李佳瑞,顾 洁,徐晓宇,聂 尧,徐 岩
(江南大学生物工程学院,江苏 无锡 214122)
槲皮素是一种多羟基黄酮类化合物,化学名为3,3′,4′,5,7-五羟基黄酮,又名栎精,槲皮黄素。槲皮素在自然界中主要存在于蔬菜、水果和草药当中,如洋葱、花椰菜、蓝莓、皱叶芥蓝和韭菜中含有丰富的槲皮素[1]。槲皮素具有广泛的药理作用,包括抗过敏、抗炎、抗癌、抗心血管保护、抗肿瘤、抗病毒、免疫调节、调节血糖、抗高血压和胃保护等作用[1-3],是一种药用价值极高的天然产物。槲皮素结构的复杂性和在自然界中较低的丰富度给槲皮素的合成与提取带来了阻碍[4]。目前,槲皮素多是从天然植物中提取或从植物中提取芦丁,进而采用酸水解的方式制备槲皮素[5-7]。传统方法涉及化学试剂的使用或需要提供高温高压环境,从而带来环境污染及生产安全等问题。生物发酵法以其条件温和、对环境污染小等优势越来越受到重视。李琦玲等[8]采用青霉菌固态发酵的方法,以桂被金槐槐米为原料发酵生产槲皮素,产量达33.67 mg/g。Tartik等[4]对酵母的生物合成途径进行改造使其生产槲皮素,产量达930 mg/L。
曲克芦丁是羟乙基芦丁的混合物,可经芦丁(槲皮素3-O-芸香糖苷)羟乙基化得到[9]。工业上生产曲克芦丁的废液中仍有较多的羟乙基芦丁残留,且该残留物主要为羟乙基芦丁混合物,80%以上为三羟乙基芦丁,同时还含有少量的单羟乙基芦丁、二羟乙基芦丁和四羟乙基芦丁[10]。由于母液中的羟乙基芦丁不易提取,因此造成生产原料的浪费。从羟乙基芦丁的结构考虑(图1),若能在去除其羟乙基的同时,选用合适的β-糖苷酶去除芸香糖苷,则能得到高价值的槲皮素,减少资源的浪费。
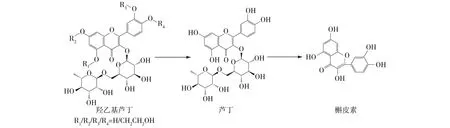
图1 本文研究技术路线Fig.1 The reaction route studied in this work
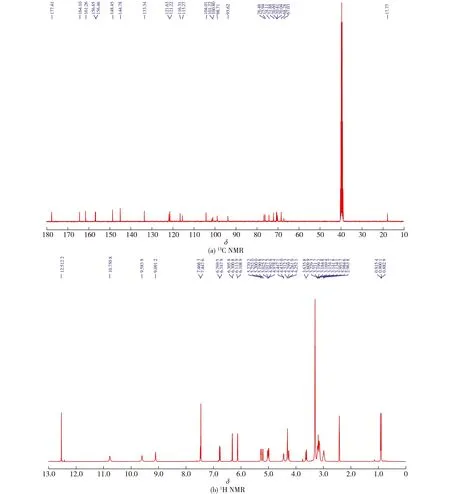
图2 芦丁核磁共振鉴定结果Fig.2 Identification of rutin by NMR
将0.5 mmol曲克芦丁与1.635 g[BMIM]Cl、2 mmol AlCl3在120 ℃及N2保护下进行反应,得到芦丁粗品,再重结晶提纯备用,反应收率为89.26%。产物经13C NMR、1H NMR鉴定为芦丁(图2):13C NMR (101 MHz,DMSO)δ177.41、164.10、161.26、156.65、156.46、148.45、144.78、133.34、121.63、121.22、116.31、115.27、104.01、101.22、100.80、98.71、93.62、76.48、75.94、74.11、71.88、70.60、70.41、70.04、68.28、67.03和17.77;1H NMR (400 MHz,DMSO-d6)δ12.51 (s,1H)、10.75 (s,1H)、9.58 (s,1H)、9.09 (s,1H)、7.46 (d,J=7.5 Hz,2H)、6.76 (d,J=8.7 Hz,1H)、6.30 (d,J=2.0 Hz,1H)、6.11 (d,J=2.0 Hz,1H)、5.26 (d,J=7.3 Hz,1H)、5.20 (d,J=3.7 Hz,1H)、5.02 (d,J=3.2 Hz,1H)、4.99 (d,J=5.7 Hz,1H)、4.44 (d,J=4.8 Hz,1H)、4.36~4.19 (m,3H)、3.62 (d,J=10.4 Hz,1H)、3.18 (ddd,J=20.3,10.1,5.1 Hz,7H)、3.03~2.92 (m,2H)、0.91 (d,J=6.1 Hz,3H)。
芦丁降解酶(rutin-degrading enzymes,RDEs,ATW 21594.1)是一种专一性酶,可在水溶液中将芦丁降解为槲皮素和芸香糖。研究表明,苦荞中含有天然高活性的芦丁降解酶[11]。苦荞中的芦丁被该酶降解为槲皮素,从而表现出苦味。Zhou等[12]的研究表明,芦丁降解酶在含有水醇(ROH,R=甲基、乙基、丙基、异丙基和苄基)混合的溶液中也可以得到不同的芸香糖苷衍生物(R-β-芸香糖苷)。Jia等[13]从苦荞中获取RDE基因序列,成功实现在毕赤酵母中的异源表达,同时证明了芦丁降解酶中催化关键残基为2个谷氨酸(E171、E182)。
本文拟通过将芦丁降解酶在毕赤酵母中异源表达,实现芦丁到槲皮素的高效转化,以实现羟乙基芦丁的回收利用。
目前还没有工业生产的曲克芦丁母液回收利用并转化为槲皮素的报道。本研究将以羟乙基芦丁为底物,通过化学法去除羟乙基得到芦丁,同时结合酶法将其转化为槲皮素(图1),以利于生产曲克芦丁母液的资源回收利用。
1 材料和方法
1.1 实验材料
大肠杆菌Top 10,江苏赛索飞生物科技有限公司;感受态细胞SMD1168H毕赤酵母(Pichia pastoris),上海瑞楚生物科技有限公司;质粒抽提试剂盒,天根生化科技(北京)有限公司;DNA纯化试剂盒,康为世纪生物科技有限公司;酵母提取物、蛋白胨,Oxiod公司;限制性内切酶、DNA分子量标准、蛋白分子量标准,TaKaRa公司;无氨基酵母氮源(YNB),北京索莱宝科技有限公司;[BMIM]Cl(1-丁基-3-甲基-咪唑氯盐),上海麦克林生化科技股份有限公司;博来霉素(Zecion),赛默飞世尔科技公司;NaCl、葡萄糖和乙酸钠等,国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 化学法制备芦丁
在50 mL Schlenk管中加入0.5 mmol 羟乙基芦丁、1.635 g[BMIM]Cl(1-丁基-3-甲基-咪唑氯盐)和2 mmol AlCl3,N2保护下,120 ℃搅拌反应22 h,油浴120 ℃,反应22 h。反应完成后加入水,冷却过夜,减压抽滤并用去离子水冲洗滤饼2~3次,干燥后即得芦丁粗品。取少量粗品于圆底烧瓶中,加热至110 ℃回流,同时不断加入乙醇至溶液澄清透明。室温下静置一夜,抽滤并自然晾干后即可得到精制的产物。
1.2.2 芦丁与槲皮素的定量分析方法
配制不同浓度的芦丁和槲皮素标品溶液,通过高效液相色谱(HPLC)方法检测。色谱柱为Kromasil C18 (4.6 mm×250 mm,3.5 μm);流动相为甲醇与水(体积比50∶50);流速为1 mL/min;采用Waters 2998光电二极管阵列(PDA)检测器检测,检测波长为370 nm;进样量20 μL;柱温维持在35 ℃。
1.2.3 密码子的优化与质粒的构建
密码子优化是基因工程中根据生物的密码子偏好改变同义密码子以提高基因表达的一种方法。对芦丁降解酶基因以Pichia pastoris为宿主进行了密码子优化,并选择穿梭质粒pPICZαA用于毕赤酵母分泌表达外源蛋白。
密码子优化后的RDE基因委托江苏赛索飞生物科技有限公司合成。以毕赤酵母SMD1168H为表达宿主,参照文献[14]方法完成载体的构建。构建的质粒参照SMD1168H Chemically Competent Cell(上海瑞楚生物科技有限公司)标准操作步骤,化学转化至毕赤酵母SMD1168H中。
1.2.4 阳性菌株的鉴定
在平板上挑取单菌落分别加入装有20 μL Lysis Buffer for Microorganism to Direct PCR的200 μL离心管,于80 ℃金属浴保温15 min。所得产物通过PCR得到大量目的片段。上游引物AOX - F:GAATTCATGGCCACTACCAAGTCCAGCTTCATCPCR;下游引物AOX - R:GTCGACGTTAGCCAGGAAGTTCTTGTACCAGTAG。产物通过琼脂糖凝胶鉴定是否含有目标条带。
1.2.5 毕赤酵母中RDE的诱导表达
选择琼脂糖检测结果中含有目标条带的菌落,挑菌至25 mL BMGY 培养基,30 ℃、200 r/min摇床培养16~18 h。培养完成后转接至100 mL BMMY培养基中,于30 ℃、200 r/min摇床培养,每24 h加入1%纯甲醇诱导一次,共诱导4次,同时进行取样,通过SDS-PAGE检测蛋白的表达。培养96 h后于4 ℃下离心,11 000 r/min离心10 min,收集上清液作为酶液冷藏备用。
1.2.6 RDE活性鉴定
以化学法重结晶后所得芦丁作为底物,鉴定RDE的活性。在1.5 mL 离心管中加入60 μL 甲醇溶解的芦丁溶液(1 mg/mL),45 μL上清液,195 μL 50 mmol/L乙酸-乙酸钠缓冲液(pH=4),混匀后在50 ℃温育10 min。一个单位的酶活定义为在上述标准条件下催化形成 0.1 nmol 槲皮素所需的酶量。反应完成后加入800 μL甲醇停止反应。反应液通过HPLC检测有无槲皮素生成。
1.2.7 RDE反应体系的优化
1.2.7.1 底物浓度与酶添加量的优化
取60 μL不同浓度的芦丁溶液(反应体系终浓度为1、2、3、4、5和6 mmol/L),同时改变反应体系中酶的添加量(5%、10%、15%和20%),加50 mmol/L乙酸-乙酸钠缓冲液(pH=4)补足体积至300 μL,反应10 min后加入800 μL甲醇终止反应,通过HPLC测定槲皮素的产率。
1.2.7.2 pH对RDE催化活性的影响
选择不同pH的缓冲液(pH 3.0~8.0),配制反应体系,反应10 min后加入800 μL甲醇终止反应。通过HPLC测定槲皮素的产率。
1.2.7.3 温度对RDE催化活性的影响
按照RDE活性鉴定的方法配制反应体系,置于25、30、35、40、45、50、55、60、65和70 ℃环境下进行反应,反应10 min后加入800 μL甲醇终止反应。通过HPLC测定槲皮素的产率。
1.2.8 化学酶法转化羟乙基芦丁合成槲皮素
按照体系优化的反应条件,以化学法合成的芦丁为底物,通过RDE合成槲皮素。产物通过HPLC和核磁共振(NMR)来鉴定。
2 结果与讨论
2.1 芦丁的制备与鉴定
2.2 重组大肠杆菌E.coli Top 10、pPICZαA-RDE的构建
2.2.1 重组质粒的构建
质粒pPICZαA含有毕赤酵母表达系统中常用的强启动子AOX,可通过甲醇诱导来实现严格的调控。同时该质粒还含有博来霉素抗性基因(BleoR),可用于转化子的筛选。重组后的质粒pPICZαA-RDE图谱如图3所示。
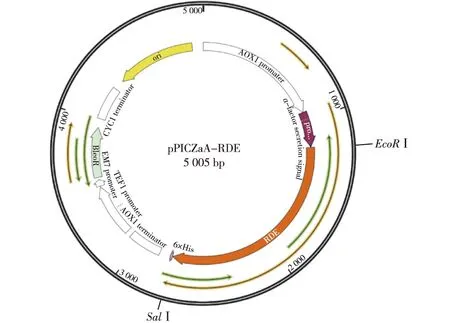
图3 pPICZαA-RDE质粒图谱Fig.3 Plasmid map of pPICZαA-RDE
2.2.2 重组大肠杆菌的构建与验证
将上述构建好的重组质粒pPICZαA-RDE 转化入E.coliTop 10得到含有目的基因的重组菌株。利用上下游引物分别对空质粒pPICZαA、重组质粒pPICZαA-RDE与单菌落E.coliTop 10/pPICZαA-RDE进行PCR,并对扩增后的特异性产物进行核酸胶电泳验证,结果如图4所示。由图4可知,重组菌中存在与目的基因片段大小一致的基因。

1—空质粒pPICZαA;2—pPICZαA-RDE;3—转入pPICZαA-RDE的E.coli Top 10图4 核酸凝胶电泳Fig.4 Nucleic acid gel electrophoresis
2.2.3 重组菌株P.pastorisSMD1168H/pPICZαA-RDE的构建与鉴定
培养重组大肠杆菌后提取质粒,并对其线性化、纯化和浓缩,通过化学转化法转入P.pastorisSMD1168H,于Zeocin抗性的YPD固体平板上培养。再挑取转化得到的阳性转化子进行PCR扩增,然后通过1%琼脂糖凝胶电泳鉴定目标质粒pPICZαA-RDE是否成功转入P.pastorisSMD1168H中,结果见图5。由图5可知,在挑取的菌落中检测到1 500 bp的目标条带(条带2),说明重组菌株构建成功。
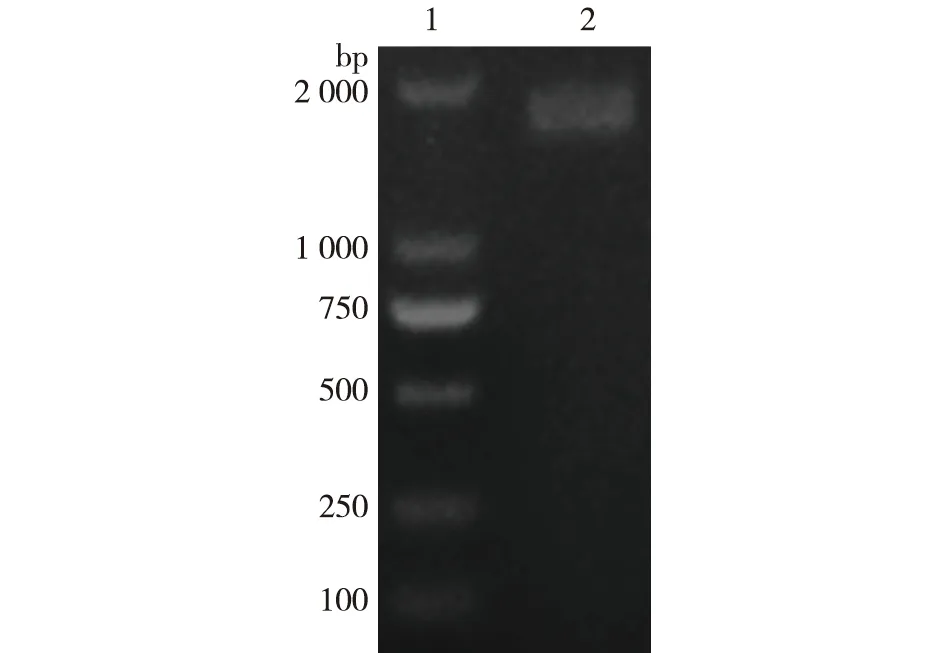
1—DL2000 DNA Marker;2—PCR产物图5 PCR扩增产物检测Fig.5 Detection of PCR amplification product
2.3 毕赤酵母中RDE的表达
选取通过琼脂糖凝胶鉴定为阳性的菌株,在BMGY和BMMY培养基中培养96 h,每24 h用1%纯甲醇诱导,在48、72和96 h时分别取样,样品离心后通过SDS-PAGE分析上清液中是否含有目标蛋白,结果见图6。由图6可知,6.6×104附近有清晰的目标条带,表明RDE成功表达。
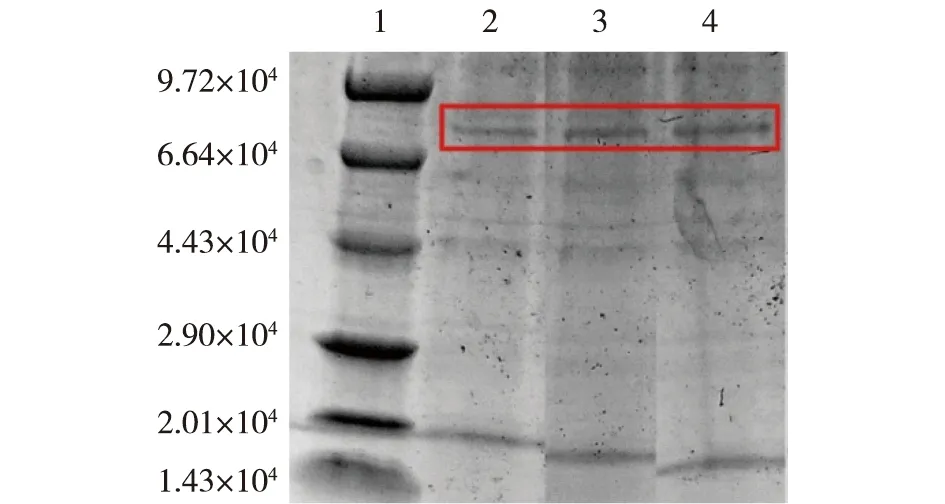
1—Premixed Protein Marker (Low);2~4—分别为48、72和96 h取样的结果图6 SDS-PAGE分析鉴定RDE表达Fig.6 RDE expression by SDS-PAGE analysis

图7 槲皮素核磁共振鉴定结果Fig.7 Identification of quercetin by NMR
2.4 RDE活性验证
由芦丁、乙酸-乙酸钠缓冲液和发酵上清液构成的300 μL反应体系,在50 ℃温育3 min,反应结束后加入800 μL甲醇终止反应,利用半制备HPLC在370 nm检测波长下检测并收集反应液。产物通过13C NMR、1H NMR鉴定为槲皮素(图7):13C NMR (101 MHz,DMSO)δ176.30、164.34、161.18、156.60、148.16、147.26、145.51、136.19、122.42、120.44、116.07、115.53、103.48、98.64和93.81;1H NMR(400 MHz,DMSO-d6)δ12.39 (s,1H)、10.67 (s,1H)、9.48 (s,1H)、9.22 (d,J=18.6 Hz,2H)、7.58 (d,J=2.2 Hz,1H),7.44 (dd,J=8.5,2.2 Hz,1H),6.79 (d,J=8.5 Hz,1H)、6.31 (d,J=2.0 Hz,1H)、6.09 (d,J=2.0 Hz,1H)。这表明重组菌株P.pastorisSMD1168H能够实现胞外表达RDE,转化芦丁生成槲皮素,转化率为32.63%。在该条件下,酶活为522.08 U/mL。
2.5 RDE 反应体系优化结果
2.5.1 底物浓度与酶添加量的优化
改变反应体系的底物浓度与酶添加比例,通过HPLC测定槲皮素产率,比较不同底物浓度与酶添加比例对槲皮素产率的影响,结果如图8所示。由图8可知:随着底物浓度的增加,槲皮素产率呈下降趋势;酶的添加比例为15%(体积分数)时整体产率相对较高。综合考虑两因素对产率的影响,采用2 mmol/L底物浓度与15%酶添加比例进行后续实验。
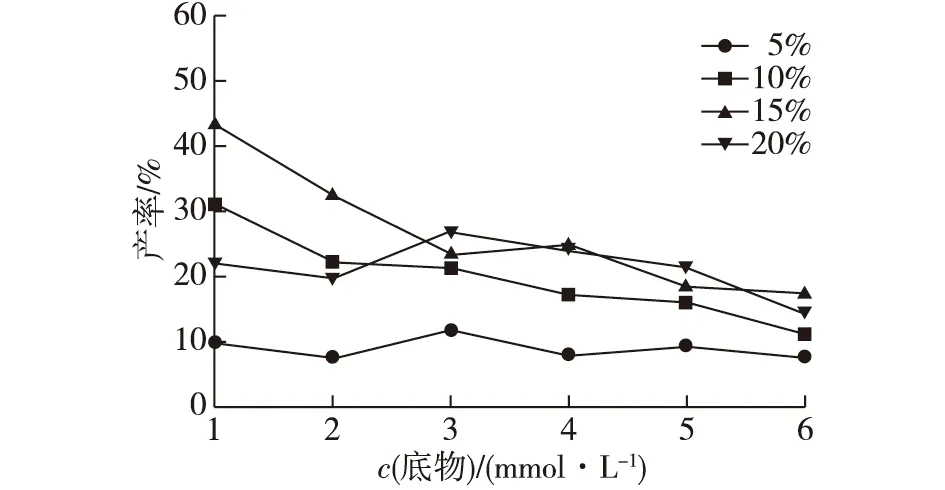
图8 不同底物浓度与酶比例对槲皮素产率的影响Fig.8 Effects of different substrate concentrations and enzyme ratios on quercetin yield
2.5.2 不同pH对产率的影响
考察不同pH下RDE催化芦丁反应的产率,结果如图9所示。由图9可知:当反应的pH为4.0~6.0时,RDE呈现较好的催化活性,但当pH超过6.0时,产物产率快速下降。可见,在pH为5.0时,RDE反应产率最高,达49.15%。
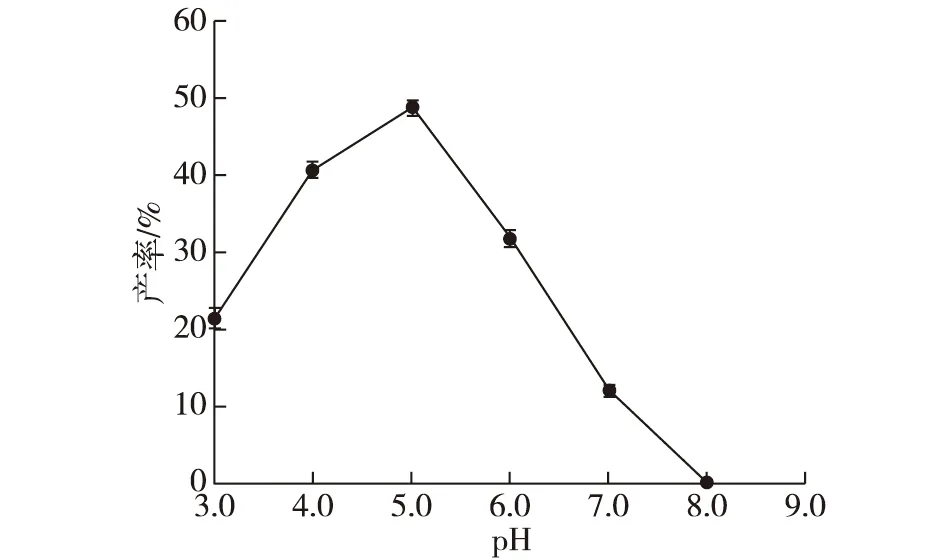
图9 pH对RDE催化芦丁转化为槲皮素反应体系的影响Fig.9 Effect of pH on RDE catalyzed conversion of rutin to quercetin
2.5.3 不同温度对产率的影响
考察不同温度下RDE催化芦丁反应的产率,结果如图10所示。由图10可知:在25~55 ℃条件下,RDE都呈现催化活性,但当温度超过55 ℃时,产物产率快速下降,而且当温度达70 ℃时RDE产量极低。可见,当反应温度为55 ℃时,RDE的反应产率最高,达到53.96%。

图10 温度对RDE催化芦丁转化为槲皮素反应体系的影响Fig.10 Effect of temperature on the reaction system of rutin to Quercetin catalyzed by RDE
2.6 化学酶法转化羟乙基芦丁合成槲皮素
以化学法得到的芦丁作为酶反应的底物,在优化后的条件下(温度为55 ℃、pH=5.0)进行脱糖苷的反应,产物通过HPLC检测,结果如图11所示。由图11数据测算,化学-酶法总转化率为47.17%。

图11 HPLC检测RDE催化芦丁结果Fig.11 Results of RDE catalyzed rutin by HPLC
3 结论
以羟乙基芦丁为原料,利用化学法合成了槲皮素,收率为89.26%。以质粒pPICZαA为载体,实现了芦丁降解酶在毕赤酵母SMD1168H中的异源表达。通过对底物浓度、酶添加量、反应pH与温度的优化,芦丁降解酶转化芦丁合成槲皮素的产率为53.96%。最终实现了化学-酶法转化羟乙基芦丁合成槲皮素,总转化率为47.17%。

